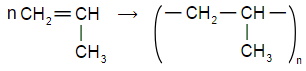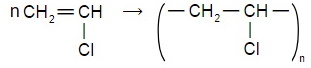Что же такое полимеризация?
и связанные с ними процессы, ведь, оказывается, почти весь наш мир — полимерный.
Автор статьи — Саид Лутфуллин
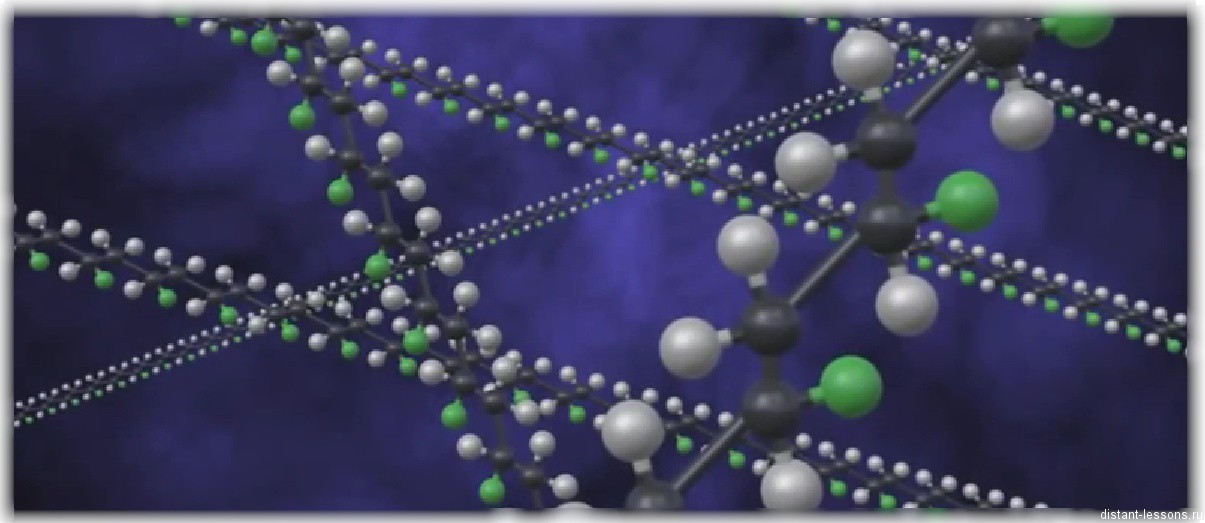
Полимеризация – это реакция образования высокомолекулярного соединения из низкомолекулярного. Высокомолекулярное соединение (полимер) – это вещество с большой молекулярной массой, состоящее из многократно повторяющихся сегментов (структурных звеньев), связанных между собой.
Где мы в повседневной жизни можем встретить полимеры?
Везде. Куда бы вы ни поглядели. Полимеры глубоко связались с нашей жизнью, собственно и образовали ее.
Ткани (как синтетические, так и натуральные), пластмассы, резина образованны полимерами. Кроме того, мы сами – тоже состоим из полимеров.
Вспомним определение жизни по Энгельсу:
«Жизнь есть способ существования белковых тел…».
Белки – это природные биополимеры, так же к биополимерам относятся нуклеиновые кислоты и полисахариды.
Какие вещества могут вступать в реакцию полимеризации?
Ответ простой: вещества, содержащие кратные (двойные, тройные) связи.
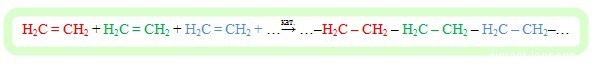
Давайте рассмотрим первое уравнение полимеризации — схему реакции образования полиэтилена (из него делают пакеты, бутылки, упаковочную пленку и многое другое):
Как мы видим, π-связь рвется, и атомы углерода одной молекулы связываются с атомами углерода соседних молекул. Так образуется длинная цепь полимера. Так как длина полимера может достигать нескольких сотен структурных звеньев, точное число которых, предсказать невозможно, так как в разных молекулах она различная и чтобы не записывать целиком эту цепь, реакцию полимеризации записывают следующим образом:
Где, n – число структурных звеньев в молекуле.
Исходное низкомолекулярное вещество, вступающее в реакцию полимеризации, называется мономер.
Не следует путать структурное звено с мономером.
Мономер и структурное звено имеют одинаковый качественный и количественный состав, но разное химическое строение (отличаются друг от друга количеством кратных связей).
Уравнения полимеризации:
Реакции получения наиболее часто встречающихся полимеров:
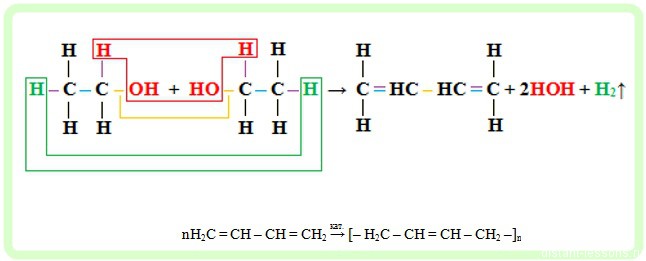
- Образование изопренового каучука (природный каучук тоже изопреновый, но строго цис- строения) из 2-метилбутадиена-1,3 (изопрена):
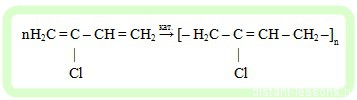
- Образование хлорпренового каучука (синтетический каучук) из 2-хлорбутадиена-1,3 (хлорпрена):
- Образование полистирола (пластмасса) из винилбензола (стирола):
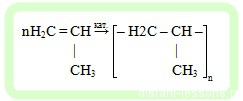
- Образование полипропилена из пропена (пропилена):
Каучуки – это группа полимеров, объединенные общими качествами (эластичность, электроизоляция и т.д.), сырье для производства резины. Раньше для этого использовали натуральный каучук из сока так называемых каучуконосных растений. Позже стали изготавливать искусственные каучуки.
В СССР в 1926 году был объявлен конкурс на лучший способ получения синтетического каучука. Конкурс выиграл Лебедев С.В.
Его метод заключался в следующем:
из этилового спирта производили бутадиен-1,3. Этиловый спирт получали брожением из растительного сырья, которого в СССР было предостаточно, это делало производство дешевле. Бутадиен-1,3 после полимеризации образовывал синтетический каучук:
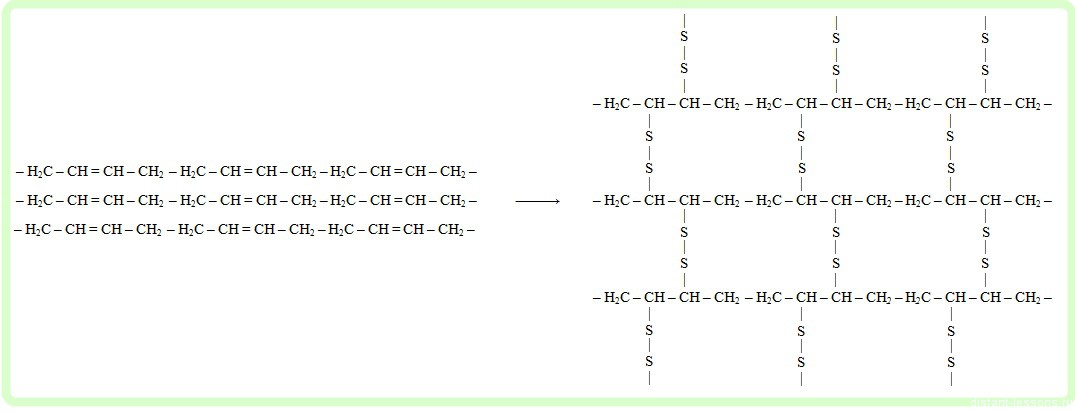
Чтобы превратить каучук в резину, его подвергают вулканизации.
Вулканизация – это процесс сшивания нитей полимера-каучука в единую сеть, вследствие чего улучшается эластичность, прочность, устойчивость к органическим растворителям .
На схеме ни же показан процесс вулканизации бутадиеновго каучука, путем образования между молекулами полимера дисульфидных мостиков:
Следует отличать реакции полимеризации от реакций поликонденсации.
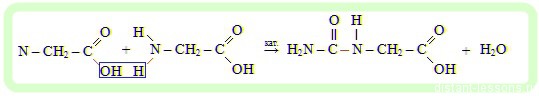
Реакция поликонденсации – это реакця образования высокомолекулярного соединения из низкомолекулярного, при которой выделяется побочный продукт (вода, аммиак, слороводород и др.)
Способность вещества вступать в реакцию поликонденсации обучлавливается у него наличием покрайней мере двух разных функциональных групп .
Рассмотрим на примере аминокислот:
Две аминокислоты соединились друг с другом, образовав пептидную связь, с выделением побочного продукта – воды. Если процесс продолжить – присоединять к этой цепи остатки аминокислот – по получим белок. Способность аминокислот вступать в реакцию поликонденсации обуславливает наличие в их строение двух функциональных групп: карбоксильной и аминогруппы. В результате реакции поликонденсации помимо полипептидов (белков), образуются нуклеиновые кислоты и полисахариды.
В погоне за качеством продукции, человек научился создавать такие стойкие полимеры, что они не разлагаются несколько тысяч лет. А иногда при разложении выделяют в окружающую среду опасные вещества. Это большая экологическая проблема. Сейчас открываются пункты переработки пластмасс.
Если мы все вместе будет сдавать туда пластмассовые отходы, то внесем огромный вклад в сохранение нашего общего дома – планеты Земля и ее природы.
Видео:Как написать уравнения реакции полимеризации?Скачать

Please wait.
Видео:Реакция полимеризации. 1 часть. 11 класс.Скачать

We are checking your browser. gomolog.ru
Видео:78. Что такое реакции полимеризацииСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e259debce51168f • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Полимеризация и поликонденсация | Химия ЕГЭ с Юлией ВишневскойСкачать

Уравнение реакции полимеризации 1 хлорэтана
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Определите молекулярную формулу алкена, молярная масса которого в три раза больше, чем у этилена.
Дано: M(CnH2n)/M(C2H4)=3
Найти: формулу CnH2n — ?
Решение
M(CnH2n)=3•M(C2H4)=3•28 г/моль=84 г/моль
M(CnH2n)=n • Ar(C)+2n • Ar(H)=n • 12+2n • 1=14 n
Имеем уравнение: 14n=84, n=84:14=6, следовательно формула имеет вид C6H12
Ответ: C6H12
Задание 2
Назовите этиленовый углеводород по международной номенклатуре. 2-метилпропен
Задание 3
Каковы основные источники промышленного получения этиленовых углеводородов? Крекинг нефти (термический, каталитический) и пиролиз (сильное нагревание) алканов.
Задание 5
Как отличить друг от друга этан и этилен? Этилен, в отличие от этана, обесцвечивает бромную воду и раствор перманганата калия.
Напишите уравнение реакции.
CH2=CH2 + Br2 H₂O ⟶ BrCH2 — CH2Br
CH2=CH2 + [O] + H2O ⟶ CH2OH — CH2OH
Задание 6
В чём состоит основное отличие химических свойств предельных и непредельных углеводородов? Непредельные углеводороды, в отличие от предельных, способны к реакциям присоединения по кратной связи.
Задание 7
Напишите уравнения реакций пропена с водородом, бромом, хлороводородом и водой. Помните, что присоединение несимметричных реагентов происходит по правилу Марковникова.
CH3 — CH=CH2 + H2 кат. ⟶ CH3 — CH2 — CH3
CH3 — CH=CH2 + Br2 ⟶ CH3 — CHBr — CH2Br
CH3 — CH=CH2 + HCl ⟶ CH3 — CHCl — CH3
Задание 8
С каким жидким веществом при обычных условиях реагируют как алканы, так и алкены? С бромом.
Чем отличаются эти реакции? Реакция брома с алканами является реакцией замещения, а с алкенами — реакцией присоединения.
Задание 9
Объясните, почему химические свойства полиэтилена отличаются от свойств этилена. Полиэтилен, в отличие от этилена, не содержит кратных связей, поэтому для него характерны химические свойства предельных алканов.
Задание 10
Напишите уравнение реакции полимеризации:
а) пропена;
б) 1-хлорэтена.
Задание 11
Используя Интернет, подготовьте сообщение об областях применения и свойствах одного из полимеров:
1) полиэтилен,
Применение: производство плёнки, различной тары, труб, электроизоляции, термоклея, брони.
Свойства: малопрозрачное вещество, значительно легче воды (плотность примерно 0,92 г/см 3 ) , плохо проводит теплоту и электрический ток, при нагревании размягчается (80°C—120°C) , на ошупь немного жирный, напоминает парафин.
2) полипропилен,
Применение: производство мешков, тары, труб, деталей технической аппаратуры, пластиковых стаканчиков, плёнки для парников, теплиц, предметов домашнего обихода, нетканых материалов, электроизоляционного материала, в строительстве для вибро- и шумоизоляции.
Свойства: обладает большей механической прочностью (стойкий к стиранию) , более термостойкий (начинает размягчаться при 140°С, температура плавления 175°С) , почти не подвергается коррозионному растрескиванию.
3) поливинилхлорид.
Применение: производство линолеума, изоляционной ленты, непромокаемых плащей, искусственных кож, поливинилхлоридного волокна, грязезащитных ковриков, обувных пластикатов, мебельной кромки.
Свойства: отличается химической стойкостью к щелочам, минеральным маслам, многим кислотам и растворителям, в чистом виде не поддерживает горение на воздухе, обладает малой морозостойкостью (-15°C) и нагревостойкостью (66°C) .
Задание 12
При взаимодействии этилена с бромом образовалось 37,6 г дибромэтана. Какой объём этилена (н.у.) вступил в реакцию?
Дано: m(C2H4Br2)=37,6 г
Найти: V(C2H4)-?
Решение
1-й способ
Mr(C2H4Br2)=2•Ar(C)+4•Ar(H)+2•Ar(Br)= 2•12+4•1+2•80= 188, поэтому M(C2H4Br2)=1 88 г/моль
n( C2H4Br2 )=m( C2H4Br2 )/M( C2H4Br2 )=37,6 г : 188 г/моль=0,2 моль
Составляем уравнение реакции: C2H4 + Br2 ⟶ C2H4Br2
По уравнению реакции n(C2H4)/1=n(C2H4Br2)/1, поэтому
n( C2H4 )=n( C2H4Br2 )=0,2 моль
V( C2H4 )=n( C2H4 )•Vm=0,2 моль • 22,4 л/моль=4,48 л
2-й способ
1. Составим химическое уравнение:
х л 37,6 г
C2H4 + Br2 ⟶ C2H4Br2
22,4 л 188 г
Над формулами соединений C2H4 и C2H4Br2 записываем неизвестный объем этилена (х л) и приведенную в условии задачи массу дибромэтана (37,6 г), а под формулами соединений ― массу и объём соответствующего количества вещества согласно коэффициентам в химическом уравнении. При н.у. 1 моль газа при н.у. занимает объем 22,4 л.
Mr(C2H4Br2)=2•Ar(C)+4•Ar(H)+2•Ar(Br)= 2•12+4•1+2•80= 188, поэтому M(C2H4Br2)=1 88 г/моль
2. Объём этилена рассчитываем с помощью пропорции:
х л / 22,4 л = 37,6 г / 188 г, отсюда
х=V( C2H4 )=22,4 л • 37,6 г : 188 г=4,48 л
Ответ: V( C2H4 )=4,48 л
📹 Видео
ПОЛУЧЕНИЕ Галогенпроизводных. Получение хлорэтана. Реакция Этанола, Хлорида Натрия и Серной КислотыСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Реакция полимеризации. 9 класс.Скачать

4.3. Алкадиены (диены): Химические свойства. ЕГЭ по химииСкачать

Визуализируем реакцию полимеризацииСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакции присоединения и полимеризации в органике | Химия ЕГЭ | УмскулСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

79. Что такое реакции поликонденсацииСкачать

25. Схема реакции и химическое уравнениеСкачать

ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Химия с нуля — Химические свойства АлкеновСкачать

Реакция полимеризации. Производство полиэтилена. 10 класс.Скачать

Полимеры. Ч.3-1. Реакции полимеризации и поликонденсации (классификация).Скачать

Реакция поликонденсации. 1 часть. 11 класс.Скачать