Пoликoнденсaция фенолов с фopмaльдeгидом
Реакции между фенолами и альдегидами в кислой или щелочной среде приводят к образованию смолообразных полимеров и воды. Таким образом, эта реакции являются типичными реакциями поликонденсации.
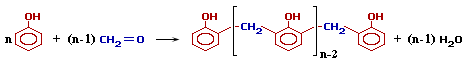
Наиболее изучена реакция поликонденсации фенола с формальдегидом, получившая широкое практическое применение. В качестве промежуточных продуктов этой реакции выделены о- и n-оксибензиловые спирты, а также 4,4′- и 2,4′-диоксидифенилметаиы. В присутствии щелочи образующиеся оксибензиловые спирты реагируют между собой с малой скоростью. Кислоты сильно ускоряют эту реакцию и применяются в качестве катализаторов в тех случаях, когда нет опасности преждевременного отверждения полимера (при избытке фенола).
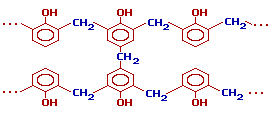
Исключительно большое влияние на свойства продуктов поликонденсации фенола с формальдегидом оказывает соотношение исходных компонентов. Если, количество формальдегида не превышает эквимолекулярного по отношению к количеству фенола, образуются линейные термопластичные полимеры, называемые новолаками. Если же формальдегид взят в избытке, образуются продукты конденсации, называемые резолами. Резолы тоже плавки и растворимы, но в отличие от новолаков они способны при нагревании переходить в неплавкое и нерастворимое состояние. Этот переход осуществляется через образование промежуточного продукта, называемого резитолом, который не способен плавиться и растворяться, но может набухать. Конечный неплавкий, нерастворимый и не набухающий продукт поликонденсации называется резитом.
Резолы и резитолы, вследствие их способности необратимо отверждаться под влиянием тепла, носят название термореактивных материалов. В стадии резита феноло-формальдегадные полимеры (полиметиленокоифенилены) имеют пространственное строение и являются термостабильными.
Реакции фенола с другими альдегидами протекают несколько иначе. Например, при взаимодействии фенола с ацетальдегидом в кислой среде образуется диоксидифенилэтан, а при последующей конденсации — линейные термопластичные полимеры. Присутствие избытка альдегида не приводит к образованию резита. Аналогичное явление наблюдается при конденсации фенола с маслянным альдегидом и бензальдегидом.
В качестве катализаторов реакций поликонденсации фенола с альдегидами применяются HCl, H3PO4, (COOH)2 и другие кислоты, а также NaOH и NH4OH.
При кислом катализаторе получается полимер с линейной структурой. Химизм этого процесса можно представить следующей схемой:
Видео:9.3. Фенол: Химические свойстваСкачать

Уравнение реакции поликонденсации формальдегида с фенолом
Фенолформальдегидные смолы [-C6H3(OH)-CH2-]n – продукты поликонденсации фенола C6H5OH с формальдегидом CH2=O.
Взаимодействие фенола с формальдегидом идет по схеме:
Роль реакционноспособных функциональных групп в этих соединениях играют:
- в феноле – три С-Н-связи в орто— и пара-положениях (легче идет замещение в двух орто-положениях);
- в формальдегиде – двойная связь С=О, способная к присоединению по атомам С и О.
Это определяет возможность образования цепных макромолекул по схеме поликонденсации:
Реакция проводится в присутствии кислых (соляная, серная, щавелевая и другие кислоты) или щелочных катализаторов (аммиак, гидроксид натрия, гидроксид бария).
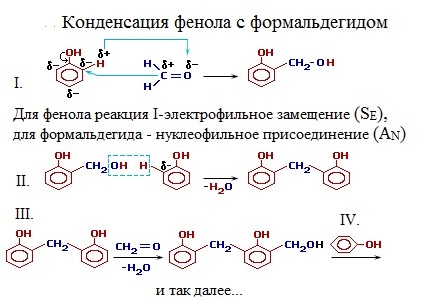
Механизм конденсации фенола с формальдегидом в условиях кислотного катализа
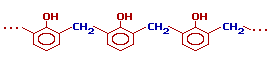
При избытке фенола и кислом катализаторе образуется линейный полимер –новолак, цепь которого содержит приблизительно 10 фенольных остатков, соединенных между собой метиленовыми (-СН2-) мостиками.
Новолаки – термопластичные полимеры, которые сами по себе не способны переходить в неплавкое и нерастворимое состояние. Но они могут превращаться в трехмерный полимер при нагревании их с дополнительной порцией формальдегида в щелочной среде. При использовании щелочных катализаторов и избытка альдегида в начальной стадии поликонденсации получаются линейные цепи резола:
При дополнительном нагревании эти цепи «сшиваются» между собой за счет групп -CH2OH, находящихся в пара-положении фенольного кольца, с образованием трехмерного полимера – резита:
Таким образом, резолы являются термореактивными полимерами. Фенолоформальдегидные полимеры применяются в виде прессовочных композиций с различными наполнителями, а также в производстве лаков и клея.
Учебный фильм «Фенолоформальдегидные пластмассы»
Учебный фильм «Термоактивные пластмассы»
Видео:79. Что такое реакции поликонденсацииСкачать

Конденсация фенолов с альдегидами и кетонами
Вы будете перенаправлены на Автор24
Гидроксиметилирование фенолов — процесс конденсации фенолов с альдегидами и кетонами является методом получения фенолформальдегидиих смол (ФФС), или фенопластов, которые широко применяются в виде клеев, лаков, эмалей, компаундов, защитных пленкообразователей или технических изделий типа текстолита, гетинакса, карболита, пресс-порошков, фаолита тому подобных.
Видео:Реакция поликонденсации. 1 часть. 11 класс.Скачать

Гидроксиметилирование фенола
Реакция гидроксиметилирования фенола или поликонденсация его с альдегидами была открыта А. Байером в 1872 году, а в 1908 А. Бакеланд реализовал ее в промышленности. Легкость протекания этой реакции обусловлена тем, что благодаря сильному активирующему действию $OH$-группы фенолы способны взаимодействовать даже с такими слабыми электрофилами, как альдегиды и кетоны в присутствии кислот или оснований:
Каталитическое действие кислоты заключается в протонировании формальдегида с образованием реакционноспособного электрофила, который замещает атом водорода в о- или п-положении фенола с образованием фенолоспиртов, или метилолфенолов:
Каталитическое действие оснований заключается в образовании фенолят-аниона, нуклеофильные способности которого выше по сравнению с фенолом. Фенолят-анион атакует электрофильный атом углерода формальдегида одним из своих активированных положений:
При избытке формальдегида гидроксиметилирование фенолоспиртов может происходить дальше:
Остановить реакцию на стадии получения моно- или дигидроксиметил- фенолов практически невозможно, и процесс проходит к образованию ФФС.
Такая реакция относится к процессам поликонденсации. При соотношении альдегид: фенол — 6: 7 и комнатной температуре в кислой среде синтезируются новолачные смолы — линейные полимеры (термопласты), которые плавятся при нагревании до 90-130$^circ$С и растворяются в органических растворителях:
Готовые работы на аналогичную тему
Видео:Полимеризация и поликонденсация | Химия ЕГЭ с Юлией ВишневскойСкачать

Особенности процесса поликондесации
Поликонденсацией называют процесс образования высокомолекулярных полимерных соединений из исходных низкомолекулярных веществ, который сопровождается выделением какого-либо побочного низкомолекулярного продукта (воды, галоненоводорода, аммиака и т. п.).
Поликонденсация является обратной реакцией. Ход процесса и характер образующихся продуктов реакции, зависят от числа функциональных групп в начальных мономерах, от соотношения начальных компонентов, а также от скорости и полноты удаления низкомолекулярных продуктов реакции. При наличии в каждом из исходных веществ двух функциональных групп в результате реакции поликонденсации образуется линейный полимер. Если же функциональность хотя бы одного из начальных мономеров больше двух, образуется полимер пространственного строения.
Так, взаимодействие фталевого ангидрида и диолов (этиленгликоля, пропиленгликоля) приводит к образованию линейного полиэстера, в то время как взаимодействие фталевого ангидрида и полиолов (глицерина, пентаэритрита, сорбита, маннита и т. д.) приводит к образованию пространственных полиэфиров. В то же время, некоторые вещества (в зависимости от условий реакции) могут проявлять различную функциональность. Так, во время проведения реакции между фталевым ангидридом и глицерином последний при температуре 170-180$^circ$ С ведет себя как бифункциональное соединение (в реакцию вступают в основном первичные гидроксильные группы), а при 200-220$^circ$ С — как трифункциональное соединение (в реакцию вступают и менее активные вторичные гидроксильные группы.
Реакции поликонденсации носят ступенчатый характер, поскольку каждый акт взаимодействия функциональных групп приводит к образованию устойчивого соединения — димера, тримера и т. д.
В начале реакции происходит взаимодействие молекул исходных веществ друг с другом и с образовавшимися молекулами димеров, триммеров и олигомеров, а затем, по мере исчерпания исходных веществ, начинают реагировать друг с другом диммеры, триммеры и полимеры. Одновременно с ростом цепи полимера протекает ряд побочных реакций, осложняющих течение процесса: деструктивные реакции и реакции между цепями. Реакция прекращается при исчерпании начальных мономеров и достижении равновесия между полимерным продуктом и низкомолекулярными соединениями, которые выделяются. В результате поликонденсации в зависимости от строения исходных компонентов образуются смолы, воски или вязкие жидкости. Они, например, в случае взаимодействия фталевого ангидрида и диолов (глицерина и полиолов), в зависимости от соотношения компонентов — полиэфиры с концевыми карбоксильными или гидроксильными группами.
Видео:ФенолыСкачать

Поликонденсация фенолов
В щелочной среде при избытке формальдегида сначала через стадию образования фенолоспиртов синтезируются растворимые резольные смолы (реактопласты, или термореактивные полимеры) с разветвленной линейной строением аналогично предыдущему случаю:
Затем при нагревании резолы дают нерастворимые резиты с трехмерной (сшитой) структурой.
При избытке фенола резолы способны переходить в новолаки, а новолачные смолы в случае избытка формальдегида — в резолы.
Необходимо отметить, что создание ФФС трудно контролируется и происходит сложным путем с получением молекулярно-неоднородной смеси олигомеров с молекулярной массой примерно 500-8000 для новолаков и резолов. Механизм реакции поликонденсации фенолов с альдегидами полностью еще не определен.
Кроме фенола и формальдегида фенол-альдегидные смолы образуют также другие производные фенола и некоторые альдегиды.
🎥 Видео
ВСЯ ТЕОРИЯ ПО АЛЬДЕГИДАМ ДЛЯ ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать

Фенолы. 1 часть. 10 класс.Скачать

Спирты и фенолы: цепочки. Часть 1/3. 10 класс и ЕГЭ по химииСкачать

9.1. Фенол: Строение, номенклатураСкачать

Химия глобального потепления. Рамиз АлиевСкачать

Химия 10 класс (Урок№7 - Фенолы и ароматические спирты.)Скачать

Альдегиды строение, свойства | Химия 10 класс #28 | ИнфоурокСкачать

Фенол | Органическая химия ЕГЭ, ЦТСкачать

Взаимодействие фенола с бромной водойСкачать

7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать

8.3. Многоатомные спирты (этиленгликоль, глицерин): Химические свойства. ЕГЭ по химииСкачать

9.2. Фенол: Способы полученияСкачать

Качественная реакция на фенолСкачать

Ртуть, алюминий, формальдегид, фенол в прививкахСкачать