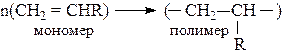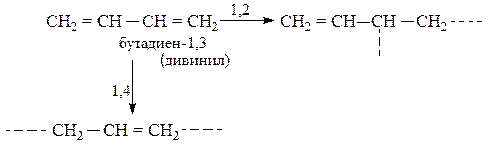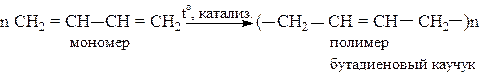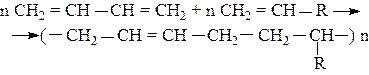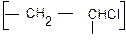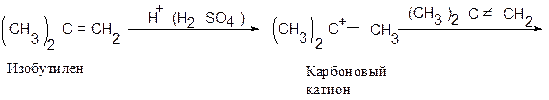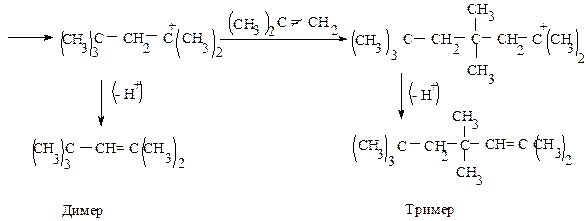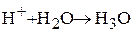Видео:79. Что такое реакции поликонденсацииСкачать

Поликонденсации адипиновой кислоты, гексаметилендиамина и аминокапроновой кислоты
Задание 433
Какие соединения называют аминами? Составьте схему поликонденсации адипиновой кислоты и гексаметилендиамина. Назовите образовавшийся полимер.
Решение:
Аминами называются производные углеводородов, образованные замещением в последних атомов водорода на группы —NH2, —NHR или —NR»:
В зависимости от числа атомов водорода у атома азота, замещённых радикалами (R), амины называются первичными, вторичными или третичными.
Группа —NH2, входящая в состав первичных аминов, называется аминогруппой. Группа атомов >NH во вторичных аминах называется иминогруппой.
Схема поликонденсации адипиновой кислоты и гексаметилендиамина:
Анид (найлон) – продукт поликонденсации адипиновой кислоты и гексаметилендиамина.
Задание 442
Какие соединения называют аминокислотами? Напишите формулу простейшей аминокислоты. Составьте схему поликонденсации аминокапроновой кислоты. Как называют образующийся при этом полимер?
Решение:
Аминокислотами называются соединения, в молекуле которых содержатся одновременно аминные (—NH2) и карбоксильные группы (—СООН). Простейшим представителем их является аминоуксусная кислота (глицин): NH2—CH2—COOH.
Схема поликонденсации аминокапроновой кислоты:
Продукт поликонденсации аминокапроновой кислоты называется капрон (перлон). Из капрона получают волокна, превосходящие по прочности натуральные. Эти волокна применяются в производстве одежды, корда авто- и авиапокрышек, для изготовления прочных и не гниющих рыболовецких сетей и снастей, канатной продукции и т.д.
Видео:Реакция поликонденсации. 1 часть. 11 класс.Скачать

ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Примеры решения задач
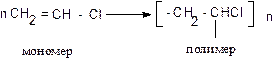
Для получения высокомолекулярных соединений существует два основных способа: полимеризация и поликонденсация.
Полимеризация – реакция соединения молекул мономера, протекающая за счет разрыва кратных связей.
Полимеризацию можно изобразить общей схемой:
где R – заместитель, например, R = H, – СН3, Сl, С6Н5 и др.
n – степень полимеризации.
Полимеризация алкадиенов с сопряженными двойными связями (алкадиены-1,3) протекает за счет раскрытия двойных связей в положениях 1,4 или 1,2, например:
Наиболее ценные полимеры (каучуки) получаются при стереорегулярной полимеризации в 1,4-положение в присутствии катализаторов Циглера-Натта [Al(C2H5)3 + ТiCl4]:
Для улучшения свойств каучуков полимеризацию бутадиена-1,3 и изопрена проводят совместно со стиролом, акрилонитрилом, изобутиленом. Такие реакции называются сополимеризациями. Например,
где R = 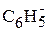
R = -C º N (бутадиен – нитрильный каучук).
Поликонденсация – реакция образования макромолекул из ди или полифункциональных соединений, сопровождающаяся отщеплением низкомолекулярных продуктов (воды, аммиака, хлорида водорода и др.).
Поликонденсация, в которой участвует только один мономер, называется гомополиконденсацией. Например,
nНО – (СН2)6 – СООН 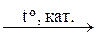
В результате гомополиконденсации 6-аминогексановой кислоты
(e-аминокапроновой кислоты) получается полимер капрон.
Поликонденсация, в которой участвуют два мономера, содержащие различные функциональные группы, называется гетерополиконденсацией. Например поликонденсация между двухосновными кислотами и двухатомными спиртами приводит к получению полиэфиров:
nНООС – R – COOH + nHO – R¢– OH [– OC – R – COOR¢– O –]n + (2n-1) H2O
В результате гетерополиконденсации адипиновой кислоты и гексаметилендиамина получается полиамид (нейлон)
Пример 1.
Сколько структурных звеньев (n) входит в макромолекулу полихлорвинила с молекулярной массой 350000?
M m полимера = 350000
Определить количество структурных звеньев – (n).
1. Схема реакции:
2. Находим молекулярную массу элементарного звена
сложением атомных масс элементов, входящих в его состав – 62,5.
3. Находим (n). Делим молекулярную массу элементарного звена: 3500 : 62,5 = 5600
Пример 2.
Напишите схему образования димера и тримера изобутилена под действием серной кислоты с учетом механизма этой реакции (катионной полимеризации).
Такой процесс полимеризации наблюдал впервые А.М. Бутлеров при действии на изобутилен серной кислоты.
Обрыв цепи в данном случае происходит в результате отщепления протона (Н + ).
Реакция идет в присутствии воды, которая захватывает протон, образуя катион гидроксония
Контрольные задания
191. Какие полимеры называют термопластичными, термореактивными?
192. Составьте уравнение реакции сополимеризации стирола
C6H5–CH=CH2и бутадиена СH2=CH–CH=СH2. Какими свойствами обладает продукт сополимеризации и где он используется?
193. Составьте уравнения реакции полимеризации пропилена
СH2=СH–CH3и изобутилена H2C=C–CH3.
194. Напишите уравнение реакции поликонденсации адипиновой кислоты HOOC(СH2)4COOH и гексаметилендиамина NH2(СH2)6NH2. Какой продукт образуется, какими свойствами обладает и где он применяется?
195. Какие углеводороды называются диеновыми? Приведите при-меры. Какой общей формулой выражают состав диеновых углеводородов? Составьте схему полимеризации одного из диеновых углеводородов.
196. Какие соединения называют аминами? Составьте схему поли-конденсации адипиновой кислоты и гексаметилендиамина. Как называют полимер, образующийся в результате этой реакции?
197. Рассчитайте молекулярную массу полихлорвинила, если степень полимеризации равна 200. Напишите уравнение реакции полимеризации хлорвинила.
198. Какие соединения называют аминокислотами? Напишите фор-мулу простейшей аминокислоты. Составьте схему поликонденсации аминокапроновой кислоты. Как называют полимер, образующийся в ре-зультате этой реакции?
199. Напишите уравнения реакций получения капрона из аминока-проновой кислоты NH2(CH2)5COOH и найлона из адипиновой кислоты COOH(CH2)4COOH и гексаметилендиамина NH2(CH2)6NH2.
200. Как называются углеводороды, представителем которых является изопрен? Составьте схему сополимеризации изопрена и изобутилена.
Видео:Реакция поликонденсацииСкачать

Химия. 10 класс
Конспект урока
Урок № 17. Синтетические волокна
Перечень вопросов, рассматриваемых в теме: урок посвящён общим вопросам химии полимеров – синтетическим волокнам (лавсан и капрон).
Волокна – природные или химические высокомолекулярные вещества, отличающиеся от других полимеров более высокой степенью упорядоченности молекул и, как следствие особыми физическими свойствами, позволяющими использовать их для получения нитей.
Искусственное волокно – это волокно, которое является продуктом химической переработки высокомолекулярных природных веществ (целлюлозы, природного каучука, белков).
Макромолекула — молекула с высокой молекулярной массой, структура которой представляет собой многократные повторения звеньев, образованных из молекул малой молекулярной массы. Число атомов, входящих в состав макромолекул, может быть очень большим (сотни тысяч и миллионы).
Мономер — это низкомолекулярное вещество, образующее полимер в реакции полимеризации или поликонденсации.
Мономерное звено — повторяющийся структурный фрагмент, включающий несколько атомов.
Полиамидные волокна – синтетические волокна, формуемые из расплавов или растворов полиамидов.
Поликонденсация — процесс синтеза полимеров из полифункциональных (чаще всего бифункциональных) соединений, обычно сопровождающийся выделением низкомолекулярных побочных продуктов (воды, спиртов и т. п.) при взаимодействии функциональных групп.
Полимеризация — процесс образования высокомолекулярного вещества (полимера) путём многократного присоединения молекул низкомолекулярного вещества (мономера, олигомера) к активным центрам в растущей молекуле полимера.
Полимеры — неорганические и органические, аморфные и кристаллические вещества, состоящие из «мономерных звеньев», соединённых в длинные макромолекулы химическими или координационными связями.
Полимеры — вещества с молекулярной массой от нескольких тысяч до нескольких миллионов.
Полиэфирное волокно — синтетическое волокно, формируемое из расплава полиэтилентерефталата или его производных.
Синтетическое волокно – это волокно, вырабатываемое из синтетических полимеров (полиамидного, полиэфирного и других волокон).
Степень полимеризации – количество мономерных звеньев в полимере.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
Теоретический материал для самостоятельного изучения
Предпосылки создания синтетических волокон. С давних времен человек широко использовал природные волокнистые материалы. Долгое время это были натуральные материалы растительного и животного происхождения. За последние 150 лет население Земли резко возросло, что привело к возрастанию потребностей человеческого общества. Поэтому объёмов выработки природных полимеров (шерсти, льна, хлопка, конопли, шёлка) не хватало. Устранить несоответствие помогла органическая химия созданием химических волокон. Ежегодно производятся миллионы километров химических волокон.
Классификация волокон. В зависимости от происхождения и способа получения учёные делят волокна на 2 большие группы: природные (натуральные) и химические. Следовательно, волокнами называют природные или химические высокомолекулярные вещества, отличающиеся от других полимеров более высокой степенью упорядоченности молекул и, как следствие особыми физическими свойствами, позволяющими использовать их для получения нитей. Искусственное волокно – это волокно, которое является продуктом химической переработки высокомолекулярных природных веществ (целлюлозы, природного каучука, белков).
Синтетическое волокно – это волокно, вырабатываемое из синтетических полимеров (полиамидного, полиэфирного и других волокон).
Лавсан (полиэтилентерефталат) является представителем полиэфирных волокон. Лавсан является линейным жесткоцепным полимером.
Структурная формула лавсана 
Поскольку сложноэфирные связи –СОО– в макромолекуле повторяются многократно, то образуется полимер, который называют полиэфир. Полимер образуется ввиде смолы с упорядоченной ориентацией макромолекулы, которая достигается следующим образом: смола плавится без разложения при 80– 120 °С, затем пропускается через фильтры, обсушивается, проходя через шахту и вытягивается в нити, что усиливает их ориентацию.
Лавсан – это практичная, удобная в применении, ткань, изделия из которой доступны и долговечны. Достоинства лавсана: прочность, износостойкость (отсутствие усадки и растяжения); свето– и термостойкость; хороший диэлектрик; устойчивость к действию растворов кислот и щелочей средней концентрации; высокая термостойкость (– 70 0 до + 170 0 ). Недостатки лавсана: негигроскопичность (не впитывает воду, т.к. не может образовывать водородные связи с молекулами воды). Применяется лавсан в производстве: волокон и нитей для изготовления трикотажных изделий, и несминаемых тканей (креп, твид, тюль, кружево и другие); заменителя шерсти; пленок, бутылей, упаковочного материала, контейнеров и др.; изделий технического назначения (транспортёрных лент, приводных ремней, канатов, парусов, рыболовных сетей и тралов, бензо- и нефтестойких шлангов и др.); материалов для медицины (хирургических нитей и материалов для имплантации в сердечно-сосудистой системе). Уход за изделиями из ткани лавсан: можно чистить, стирать вручную или с помощью машинки в горячей воде до 60°С (материал хорошо отстирывается); отбеливатели применять не нужно, т.к. красители могут быть неустойчивы; изделия из лавсана можно отжимать в режиме вращения барабана с минимальными скоростями, чтобы на ткани не образовались заломы; высушивать лучше в расправленном состоянии; гладить можно утюгом с максимальной температурой нагрева 140–150°С.
Капрон является представителем полиамидных волокон. Структурная формула капрона [–NH– (CH2)5– CO– ]n.
Способ получения. В промышленности капрон получают поэтапно. Сначала реакцией поликонденсации получают производное ε– аминокапроновой кислоты – капролактам. Во время синтеза молекулы капролактама превращаются в этиламинокапроновую кислоту, которая подвергается реакции поликонденсации. Таким образом молекула образовавшегося полимера состоит из многократно повторяющихся остатков этиламинокапроновой кислоты, содержащих пептидные связи. Процесс ведется в присутствии воды, играющей роль активатора, при температуре 240– 270° С и давлении 15– 20 кгс/см 2 в атмосфере азота.
ε-аминокапроновая кислота полимер-смола
Полимер имеет вид смолы. Для получения волокон смолу плавят, пропускают через фильтры, затем подвергают специальной обработке, после которой скручивают нити.
Достоинства капрона: легкий и очень прочный материал; трудно растворимый высокоплавкий полимер с температурой плавления 180–250 °С; устойчивость к истиранию и деформации; стоек к действию разбавленных растворов кислот и щелочей; не впитывает влагу, следовательно, сохраняет прочность во влажном состоянии. Недостатки капрона: неустойчив к действию концентрированных растворов кислот– щелочей и высоких температур (нельзя изделия гладить горячим утюгом). Применяется капрон в производстве: прочных и износостойких деталей машин и механизмов; трикотажных изделий; для производства технических тканей, канатов, рыболовных сетей. Уход за изделиями из ткани капрон: изделия стирают в теплой воде с мягкими моющими средствами; не сушат в центрифуге; гладят при низкой температуре.
ПРИМЕР И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ.
Решение задачи о способах получения и свойствах органических веществ.
Задача 1. Рассчитайте, какое количество исходного вещества потребуется для получения 702 кг терефталевой кислоты, если выход её составляет 90% от теоретического (ответ округлите до целого числа)?
2. Рассчитаем теоретическую массу терефталевой кислоты: mтеор.= mпракт. х 100%/η; mтеор. (C6H4(COOH)2) = 702 кг х 100% / 90% = 780 кг.
3. Рассчитаем количество вещества терефталевой кислоты:
4. Рассчитаем массу исходного вещества пара– ксилола.
Задача 2. Сколько килограмм этиленгликоля можно получить из 180 л (при н.у.) этилена, если выход 78% (ответ округлите до целого числа)?
2. Рассчитаем количество вещества этилена при н.у.:
3. Количественные отношения веществ по уравнению реакции 1:1, следовательно ν (этиленгликоль) = ν (C2H4) = 8 моль.
4. Рассчитаем теоретическую массу этиленгликоля:
m(теор) (элиленгликоль)= М х ν =8 моль х 62 г/моль = 496 г.
5. Рассчитаем практическую массу этиленгликоля, если теоретический выход составляет 78%:
m практ. = η (выход) х m теор. = 496 г х 0,78 = 378 г.
📹 Видео
II четверть, Химия, 11 класс, Реакции Поликонденсации Полиамиды и полиэфирыСкачать

Полимеризация и поликонденсация | Химия ЕГЭ с Юлией ВишневскойСкачать

Реакция поликонденсации. 2 часть. 11 класс.Скачать

Химия, 11 сынып, Реакции поликонденсацииСкачать

Аминокапроновая кислотаСкачать

Тесты по химии. Тест 39. Полимеры. Реакции полимеризации и поликонденсацииСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Урок №7. Полимеризация через поликонденсацию. Beyond ChemistryСкачать

Схожесть реакций полимеризации и поликонденсацииСкачать

• ПОЛИМЕРЫ. РЕАКЦИИ ПОЛИМЕРИЗАЦИИ И ПОЛИКОНДЕНСАЦИИ • ЗАДАНИЕ 26 ЕГЭ ХИМИЯСкачать

25. Схема реакции и химическое уравнениеСкачать

Какие вещества являются продуктами реакции поликонденсации?1) крахмал; 2) белок; 3) целлюлозаСкачать

Как написать уравнения реакции полимеризации?Скачать

10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать

Полимеры. Ч.3-1. Реакции полимеризации и поликонденсации (классификация).Скачать

Аминокислоты. 3 часть. 11 класс.Скачать

9.3. Фенол: Химические свойстваСкачать