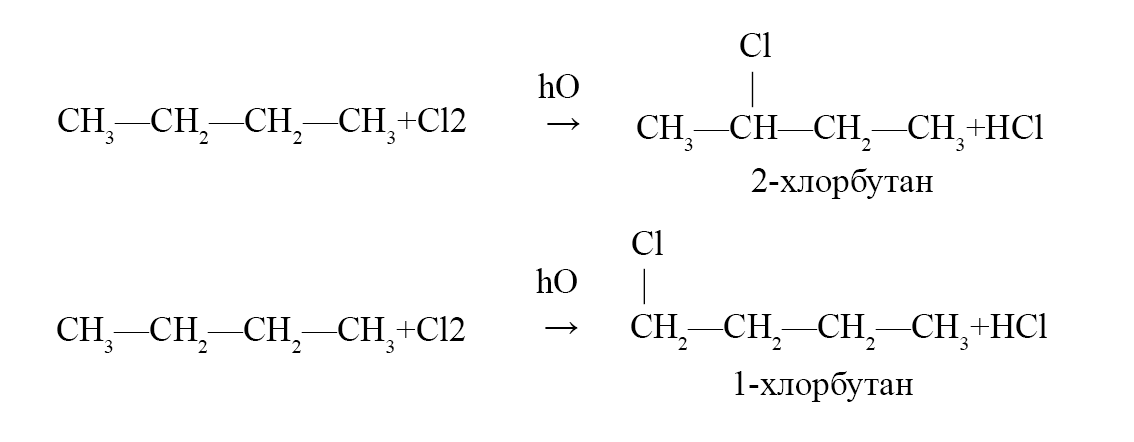Пиролиз метана протекает при высокой температуре в 1200-1500°С с последующим ему быстрым охлаждением продуктов реакции. В результате пиролиза образуется ацитилен, который в дальнейшем используется для производства продуктов органического синтеза.
Ацетилен при 1500°С является термодинамически неустойчивым веществом, и в весьма короткий промежуток времени может разложиться на водород и углерод (сажу). Чтобы избежать разложения получившегося в процессе пиролиза метана ацетилена время пребывания метана в реакционной зоне не превышает сотой доли секунды.
- § 10. Химические свойства, получение и применение алканов
- 1. Напишите уравнение реакции монобромирования этана.
- 2. Напишите уравнения реакций, которые протекают при взаимодействии н-бутана с хлором. Считайте, что только один атом водорода в молекуле н-бутана замещается на хлор. Подпишите названия образующихся органических веществ.
- 3. Сколько хлорпроизводных можно получить в результате хлорирования этана? Напишите уравнения реакций получения всех возможных хлорпроизводных этана, назовите хлорпроизводные. Можно ли при записи уравнений реакций в данном случае использовать молекулярные формулы?
- Пиролиз метана: понятие, реакция, уравнение, продукты
- Пиролиз метана реакция
- Пиролиз метана уравнение
- Продукты пиролиза метана.
- 💥 Видео
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

§ 10. Химические свойства, получение и применение алканов
Видео:Уравнивание реакций горения углеводородовСкачать

1. Напишите уравнение реакции монобромирования этана.
C H 3 − C H 3 + B r 2 → h v C H 3 − C H 2 B r + H B r mathrm<CH_3CH_3Br_2<xrightarrow>CH_3CH_2BrHBr> C H 3 − C H 3 + B r 2 h v
C H 3 − C H 2 B r + H B r
Видео:Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать

2. Напишите уравнения реакций, которые протекают при взаимодействии н-бутана с хлором. Считайте, что только один атом водорода в молекуле н-бутана замещается на хлор. Подпишите названия образующихся органических веществ.
Видео:Вся теория по алканам | Химия ЕГЭ для 10 класса | УмскулСкачать

3. Сколько хлорпроизводных можно получить в результате хлорирования этана? Напишите уравнения реакций получения всех возможных хлорпроизводных этана, назовите хлорпроизводные. Можно ли при записи уравнений реакций в данном случае использовать молекулярные формулы?
Можно получить 9 хлорпроизводных:
1) C H 3 − C H 3 + C l 2 → h v C H 3 − C H 2 C l + H C l mathrm<CH_3CH_3Cl_2<xrightarrow>CH_3CH_2ClHCl> C H 3 − C H 3 + C l 2 h v
C H 3 − C H 2 C l + H C l (хлорэтан)
2) C H 3 − C H 3 + 2 C l 2 → h v C H 3 − C H C l 2 + 2 H C l mathrm<CH_3CH_32Cl_2<xrightarrow>CH_3CHCl_22HCl> C H 3 − C H 3 + 2 C l 2 h v
C H 3 − C H C l 2 + 2 H C l (1,1-дихлорэтан)
3) C H 3 − C H 3 + 2 C l 2 → h v C H 2 C l − C H 2 C l + 2 H C l mathrm<CH_3CH_32Cl_2<xrightarrow>CH_2ClCH_2Cl2HCl> C H 3 − C H 3 + 2 C l 2 h v
C H 2 C l − C H 2 C l + 2 H C l (1,2-дихлорэтан)
4) C H 3 − C H 3 + 3 C l 2 → h v C H 3 − C C l 3 + 3 H C l mathrm<CH_3CH_33Cl_2<xrightarrow>CH_3CCl_33HCl> C H 3 − C H 3 + 3 C l 2 h v
C H 3 − C C l 3 + 3 H C l (1,1,1-трихлорэтан)
5) C H 3 − C H 3 + 3 C l 2 → h v C H C l 2 − C H 2 C l + 3 H C l mathrm<CH_3CH_33Cl_2<xrightarrow>CHCl_2<C_2>Cl3HCl> C H 3 − C H 3 + 3 C l 2 h v
C H C l 2 − C H 2 C l + 3 H C l (1,1,2-трихлорэтан)
6) C H 3 − C H 3 + 4 C l 2 → h v C H 2 C l − C C l 3 + 4 H C l mathrm<CH_3CH_34Cl_2<xrightarrow><C_2>ClCCl_34HCl> C H 3 − C H 3 + 4 C l 2 h v
C H 2 C l − C C l 3 + 4 H C l (1,1,1,2-тетрахлорэтан)
7) C H 3 − C H 3 + 4 C l 2 → h v C H C l 2 − C H C l 2 + 4 H C l mathrm<CH_3CH_34Cl_2<xrightarrow>CHCl_2CHCl_24HCl> C H 3 − C H 3 + 4 C l 2 h v
C H C l 2 − C H C l 2 + 4 H C l (1,1,2,2=тетрахлорэтан)
8) C H 3 − C H 3 + 5 C l 2 → h v C H C l 2 − C C l 3 + 5 H C l mathrm<CH_3CH_35Cl_2<xrightarrow>CHCl_2CCl_35HCl> C H 3 − C H 3 + 5 C l 2 h v
C H C l 2 − C C l 3 + 5 H C l (пентахлорэтан)
9) C H 3 − C H 3 + 6 C l 2 → h v C C l 3 − C C l 3 + 6 H C l mathrm<CH_3CH_36Cl_2<xrightarrow>CCl_3CCl_36HCl> C H 3 − C H 3 + 6 C l 2 h v
C C l 3 − C C l 3 + 6 H C l (гексахлорэтан)
При записи уравнений реакций 2-7 нельзя использовать молекулярные формулы.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Пиролиз метана: понятие, реакция, уравнение, продукты
Какой станет наша планета через пару десятков лет – вот вопрос, который до сих пор мучает все человечество. Превратится ли наш дом в уютный уголок, или же постоянно расширяющаяся свалка скоро доберется до наших дворов? Переработка бытового мусора используется в развитых странах вот уже более 40 лет, но для России до сих пор являются чем-то новым. Тем более, что общественности практически ничего не известно о наиболее прогрессивных технологиях в сфере переработки мусора.
Так, далеко не все из нас знают о том, что из обычного бытового мусора, которым забит каждый полигон ТБО, вернее из его органической составляющей при помощи такого устройства как биореактор можно получить биогаз – газ, имеющий в своем составе метан.
Полученная путем сжигания биогаза электроэнергия способна не только удовлетворить собственные нужды мусороперерабатывающего завода, но и использоваться для последующей продажи. Представьте себе, как это удобно, ведь из обычных отходов можно получить доходы. Причем данная технология переработки мусора является абсолютно безопасной и экологически чистой.
Однако полученный из мусора метан можно не только сжигать для получения тепла и электричества. Из метана путем процесса пиролиза можно получать ацителен. Что же это за вещество, и для чего оно нужно? Об этом мы поговорим чуть позже, а пока сделаем основной упор на самом процессе пиролиза метана.
Видео:1.3. Алканы: Химические свойства. Подготовка к ЕГЭ по химииСкачать

Пиролиз метана реакция
Пиролиз метана это процесс, осуществляемый при высокой температуре в 1200-1500°С с последующим ему быстрым охлаждением продуктов реакции. В результате пиролиза образуется ацитилен, который здесь является скорее не конечной целью, а промежуточным продуктом, необходимым для дальнейшего производства продуктов органического синтеза. Поскольку пиролиз метана только для получения ацетилена экономически невыгоден, данная технология обычно применяется на заводах, осуществляющих его дальнейшую переработку в такие продукты как, например, синтетический каучук. Важным фактором, определяющим степень эффективности процесса пиролиза метана, является стойкость получаемых и исходных углеводородов при высокой температуре.
Судить о термической стойкости углеводородов можно по изменению в зависимости от температуры свободной энергии их образования. Чем ниже при данной температуре будет свободная энергия, тем стабильнее углеводород. Исследования данной зависимости показали, что стабильность ацетилена увеличивается с повышением температуры у, в то время как у других углеводородов стабильность падает. Это означает, что они при соответствующих условиях способны превратиться в ацетилен. Поскольку свободная энергия образования ацетилена при температуре 1200 °С меньше чем свободная энергия образования метана, то это сделало возможным образование ацетилена непосредственно из метана.
Однако ацетилен при 1500°С является термодинамически неустойчивым веществом, и в весьма короткий промежуток времени может разложиться на водород и углерод (сажу). Во избежание разложения получившегося в процессе пиролиза метана ацетилена время пребывания пиролизных газов в реакционной зоне ни в коем случае не должно превышать сотой доли секунды.
Продукты, полученные в результате реакции пиролиза метана, быстро охлаждаются до температуры 90—200 «С. Делается это для того, чтобы сохранить ацитилен, поскольку при такой температуре реакция разложения ацетилена прекращается. Охлаждение ацитилена производят путем впрыскивания в газовый поток воды. Данный процесс называется закалкой ацитилена.
Видео:Новые задачи №28 на выход реакции. ЕГЭ по химии 2023 | Екатерина СтрогановаСкачать

Пиролиз метана уравнение
В настоящее время подробной кинетической схемы процесса пиролиза метана не существует. Однако метод и реакции пиролиза можно представить в виде ряда химических уравнений. Ацетилен добывают из метана путем термического разложения (пиролиза) по реакции:
Для поддержания реакции пиролиза необходимо тепло, которое подводится путем нагрева исходных газов и образуется в результате сжигания непосредственно в реакционном объеме небольшого количества метана. В связи с тем фактом, что процесс пиролиза метана осуществляется в факеле, одновременно с образованием ацетилена протекает целый ряд побочных реакций, среди которых:
Помимо указанных, также протекают и реакции образования высших ацетиленовых углеводородов, например, таких как диацетилен, метил ацетилен, винилацетилен и др.
Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать

Продукты пиролиза метана.
Ацетилен это бесцветный горючий газ с формулой C2H2. Данное вещество, которое по своей массе легче воздуха, обладает резким запахом. Ацетилен был впервые получен в 1836 году химиком Эдмондом Дэви, который получил его путем обработки карбида калия водой. Тогда ацетилен было решено использовать для освещения улиц. Ацетиленовые горелки давали примерно в 15 раз больше света, нежели обычные газовые фонари на метане, которыми освещали улицы. С течением времени они были вытеснены электрическими фонарями, но еще долго использовались в отдельных местностях.
Данное вещество так и осталось бы забытым, если бы не развитие химической промышленности не нашло ему новое применение. В середине прошлого века ацетилен нашел все более широкое применение в качестве исходного сырья при производстве самых различных химических продуктов. Ацитилен используется для получения:
- мономеров для хлоропренового каучука
- различных пластических масс (поливинилхлорид, поливинилацет)
- химических волокон
- растворителей
💥 Видео
Органическая Химия — Алканы и Цепь из АтомовСкачать

1.2. Алканы: Способы получения. Подготовка к ЕГЭ по химииСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Все реакции с металлами за 1 урок | ЕГЭ по химии 2024 | Екатерина СтрогановаСкачать

Реакции присоединения | Химия 10 класс | УмскулСкачать

Предельные углеводороды. Алканы. 10 класс.Скачать

химические свойства алканов/органическая химия/ЕГЭСкачать

Гидрируем и дегидрируем углеводородыСкачать

Вся теория по алкинам | Химия ЕГЭ для 10 класса | УмскулСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Составление уравнений реакций для генетических цепочек по кислородсодержащим. часть 1Скачать