- История открытия кислорода
- Способы получения и собирания кислорода в лаборатории
- 1) Разложение оксида ртути (II)
- 2) Разложение перманганата калия
- Разложение пероксида водорода
- Разложение хлората калия
- Разложение нитратов
- Получение кислорода в промышленности
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Получению кислорода разложением перманганата калия соответствует уравнение реакции : 2KMnO ^ 4 + MnO ^ 2 + O ^ 2 Какое количество оксида марганца (IV) образуется, если в реакцию вступило 0, 6 моль пер?
- Написать уравнение реакции разложения перманганата калия?
- Запишите уровнение реакции получения кислорода из перманганата калии?
- Напишите уравнение реакции взаимодействия перманганата калия с йодидом калия в присутствии серной кислоты?
- Определить какая масса перманганата калия KMnO4 вступило в реакцию разложения, если при этом выделилось 0, 25 моль кислорода O2?
- Бутен2 + перманганат калия реакция?
- Перманганат калия KMnO₄ при нагревании разлагается согласно схеме : KMnO₄ — — — — K₂MnO₄ + MnO₂ + O₂?
- Рассчитайте химическое количество кислорода, которое образуется при разложении перманганата калия массой 15, 8 г, по уравнению химической реакции : 2КМп04 —> ; К2МпО4 + Мп02 + 02?
- Какой объем кислорода образуется при разложении 136 г перманганата калия при его нагревании?
- 3. Какой тип реакции соответствует процессу лабораторного получения кислорода из перманганата калия : А) соединение В) разложение С) обмен Д) замещение?
- СТАВЛЮ 20 БАЛЛОВ ЗА ОБЪЯСНЕНИЕ И РЕШЕНИЕ ЗАДАЧ ПО ХИМИИ?
- 💥 Видео
Видео:Реакция этилена с раствором перманганата калияСкачать

История открытия кислорода
Открытие кислорода ознаменовало новый период в развитии химии. С глубокой древности было известно, что для горения необходим воздух. Процесс горения веществ долгое время оставался непонятным. В эпоху алхимии широкое распространение получила теория флогистона, согласно которой вещества горят благодаря их взаимодействию с огненной материей, то есть с флогистоном, который содержится в пламени. Кислород был получен английским химиком Джозефом Пристли в 70-х годах XVIII века. Химик нагревал красный порошок оксида ртути (II), в итоге вещество разлагалось, с образованием металлической ртути и бесцветного газа:
Оксиды – бинарные соединения, в состав которых входит кислород При внесении тлеющей лучины в сосуд с газом она ярко вспыхивала. Ученый считал, что тлеющая лучина вносит в газ флогистон, и он загорается. Д. Пристли пробовал дышать полученным газом, и был восхищен тем, как легко и свободно им дышится. Тогда ученый и не предполагал, что удовольствие дышать этим газом предоставлено каждому. Результатами своих опытов Д. Пристли поделился с французским химиком Антуаном Лораном Лавуазье.
Имея хорошо оснащенную на то время лабораторию, А. Лавуазье повторил и усовершенствовал опыты Д. Пристли. А. Лавуазье измерил количество газа, выделяющееся при разложении определенной массы оксида ртути. Затем химик нагрел в герметичном сосуде металлическую ртуть до тех пор, пока она не превратилась в оксид ртути (II). Он обнаружил, что количество выделившегося газа в первом опыте равно газу, поглотившемуся во втором опыте. Следовательно, ртуть реагирует с каким-то веществом, содержащимся в воздухе. И это же вещество выделяется при разложении оксида. Лавуазье первым сделал вывод, что флогистон здесь совершенно ни при чем, и горение тлеющей лучины вызывает именно неизвестный газ, который в последствии был назван кислородом. Открытие кислорода ознаменовало крах теории флогистона!
Видео:Получение кислорода из перманганата калияСкачать

Способы получения и собирания кислорода в лаборатории
Лабораторные способы получения кислорода весьма разнообразны. Существует много веществ, из которых можно получить кислород. Рассмотрим наиболее распространенные способы.
1) Разложение оксида ртути (II)
Одним из способов получения кислорода в лаборатории, является его получение по описанной выше реакции разложения оксида ртути (II). Ввиду высокой токсичности соединений ртути и паров самой ртути, данный способ используется крайне редко.
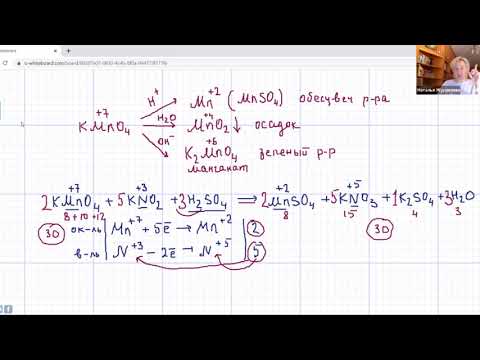
2) Разложение перманганата калия
Перманганат калия (в быту мы называем его марганцовкой) – кристаллическое вещество темно-фиолетового цвета. При нагревании перманганата калия выделяется кислород. В пробирку насыплем немного порошка перманганата калия и закрепим ее горизонтально в лапке штатива. Недалеко от отверстия пробирки поместим кусочек ваты. Закроем пробирку пробкой, в которую вставлена газоотводная трубка, конец которой опустим в сосуд- приемник. Газоотводная трубка должна доходить до дна сосуда-приемника. Ватка, находящаяся около отверстия пробирки нужна, чтобы предотвратить попадание частиц перманганата калия в сосуд-приемник (при разложении выделяющийся кислород увлекает за собой частички перманганата). Когда прибор собран, начинаем нагревание пробирки. Начинается выделение кислорода.
Уравнение реакции разложения перманганата калия:
2KMnO4 t° → K2MnO4 + MnO2 + O2↑
Как обнаружить присутствие кислорода? Воспользуемся способом Пристли. Подожжем деревянную лучину, дадим ей немного погореть, затем погасим, так, чтобы она едва тлела. Опустим тлеющую лучину в сосуд с кислородом. Лучина ярко вспыхивает! Газоотводная трубка была не случайно опущена до дна сосуда-приемника. Кислород тяжелее воздуха, следовательно, он будет собираться в нижней части приемника, вытесняя из него воздух. Кислород можно собрать и методом вытеснения воды. Для этого газоотводную трубку необходимо опустить в пробирку, заполненную водой, и опущенную в кристаллизатор с водой вниз отверстием. При поступлении кислорода газ вытесняет воду из пробирки.
Разложение пероксида водорода
Пероксид водорода – вещество всем известное. В аптеке оно продается под названием «перекись водорода». Данное название является устаревшим, более правильно использовать термин «пероксид». Химическая формула пероксида водорода Н2О2 Пероксид водорода при хранении медленно разлагается на воду и кислород. Чтобы ускорить процесс разложения можно произвести нагрев или применить катализатор.
Катализатор – вещество, ускоряющее скорость протекания химической реакции
Нальем в колбу пероксид водорода, внесем в жидкость катализатор. Катализатором может служить порошок черного цвета – оксид марганца MnO2. Тотчас смесь начнет вспениваться вследствие выделения большого количества кислорода. Внесем в колбу тлеющую лучину – она ярко вспыхивает. Уравнение реакции разложения пероксида водорода:
2H2O2 MnO2 → 2H2O + O2↑
Обратите внимание: катализатор, ускоряющий протекание реакции, записывается над стрелкой, или знаком «=», потому что он не расходуется в ходе реакции, а только ускоряет ее.
Разложение хлората калия
Хлорат калия – кристаллическое вещество белого цвета. Используется в производстве фейерверков и других различных пиротехнических изделий. Встречается тривиальное название этого вещества – «бертолетова соль». Такое название вещество получило в честь французского химика, впервые синтезировавшего его, – Клода Луи Бертолле. Химическая формула хлората калия KСlO3. При нагревании хлората калия в присутствии катализатора – оксида марганца MnO2, бертолетова соль разлагается по следующей схеме:
2KClO3 t°, MnO2 → 2KCl + 3O2↑.
Разложение нитратов
Нитраты – вещества, содержащие в своем составе ионы NO3⎺. Соединения данного класса используются в качестве минеральных удобрений, входят в состав пиротехнических изделий.
Нитраты – соединения термически нестойкие, и при нагревании разлагаются с выделением кислорода:
Обратите внимание, что все рассмотренные способы получения кислорода схожи. Во всех случаях кислород выделяется при разложении более сложных веществ.
Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые В общем виде реакцию разложения можно описать буквенной схемой:
Реакции разложения могут протекать при действии различных факторов. Это может быть нагревание, действие электрического тока, применение катализатора. Существуют реакции, в которых вещества разлагаются самопроизвольно.
Видео:Опыты по химии. Получение кислорода из перманганата калияСкачать

Получение кислорода в промышленности
В промышленности кислород получают путем выделения его из воздуха.
Воздух – смесь газов, основные компоненты которой представлены в таблице.
Сущность этого способа заключается в глубоком охлаждении воздуха с превращением его в жидкость, что при нормальном атмосферном давлении может быть достигнуто при температуре около -192°С. Разделение жидкости на кислород и азот осуществляется путем использования разности температур их кипения, а именно: Ткип.
N2 = -196°С (при нормальном атмосферном давлении).
При постепенном испарении жидкости в газообразную фазу в первую очередь будет переходить азот, имеющий более низкую температуру кипения, и, по мере его выделения, жидкость будет обогащаться кислородом. Многократное повторение этого процесса позволяет получить кислород и азот требуемой чистоты. Такой способ разделения жидкостей на составные части называется ректификацией жидкого воздуха.
- В лаборатории кислород получают реакциями разложения
- Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые
- Кислород можно собрать методом вытеснения воздуха или методом вытеснения воды
- Для обнаружения кислорода используют тлеющую лучину, она ярко вспыхивает в нем
- Катализатор – вещество, ускоряющее химическую реакцию, но не расходующееся в ней
Видео:Получение кислорода разложение перманганата калияСкачать

Please wait.
Видео:получение кислородаСкачать

We are checking your browser. gomolog.ru
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Перманганат калия разложениеСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2983e93e1c4c07 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Опыты по химии. Получение кислорода из перманганата калия и собирание его способом вытеснения водыСкачать

Получению кислорода разложением перманганата калия соответствует уравнение реакции : 2KMnO ^ 4 + MnO ^ 2 + O ^ 2 Какое количество оксида марганца (IV) образуется, если в реакцию вступило 0, 6 моль пер?
Химия | 5 — 9 классы
Получению кислорода разложением перманганата калия соответствует уравнение реакции : 2KMnO ^ 4 + MnO ^ 2 + O ^ 2 Какое количество оксида марганца (IV) образуется, если в реакцию вступило 0, 6 моль перманганата калия.
2KMnO4 = K2MnO4 + MnO2 + O2↑ если в реакцию вступило 0, 6 моль перманганата, то оксида , согласно уравнения, получится в 2 раза меньше, т.
Е. n(MnO2) = 0, 6 / 2 = 0, 3 моль.
Видео:Опыты по химии. Каталитическое разложение пероксида водородаСкачать

Написать уравнение реакции разложения перманганата калия?
Написать уравнение реакции разложения перманганата калия.
Видео:Разложение перманганата калия I ЕГЭ по химииСкачать

Запишите уровнение реакции получения кислорода из перманганата калии?
Запишите уровнение реакции получения кислорода из перманганата калии.
К какому типк относится эта реакция?
Видео:Окисление органических соединений перманганатом калияСкачать

Напишите уравнение реакции взаимодействия перманганата калия с йодидом калия в присутствии серной кислоты?
Напишите уравнение реакции взаимодействия перманганата калия с йодидом калия в присутствии серной кислоты.
Какая масса йода выделится, если в реакцию вступило 0, 3 л раствора перманганата калия (р = 1, 04 г / мл) с массовой долей перманганата 8%?
Видео:Разложение перманганата калия. Химический опытСкачать

Определить какая масса перманганата калия KMnO4 вступило в реакцию разложения, если при этом выделилось 0, 25 моль кислорода O2?
Определить какая масса перманганата калия KMnO4 вступило в реакцию разложения, если при этом выделилось 0, 25 моль кислорода O2.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Бутен2 + перманганат калия реакция?
Бутен2 + перманганат калия реакция.
Видео:ПЕРМАНГАНАТ КАЛИЯ | МАРГАНЦОВКА | Химические свойства марганцовки | Химические реакции | ХимияСкачать

Перманганат калия KMnO₄ при нагревании разлагается согласно схеме : KMnO₄ — — — — K₂MnO₄ + MnO₂ + O₂?
Перманганат калия KMnO₄ при нагревании разлагается согласно схеме : KMnO₄ — — — — K₂MnO₄ + MnO₂ + O₂.
РАССТАВЬТЕ КОЭФФИЦИЭНТЫ В СХЕМЕ ЭТОЙ ХИМ.
РАССЧИТАЙТЕ МАССУ ПЕРМАНГАНАТА калия , необходимого для получения кислорода объёмом 33.
Видео:Задание 29 ОВР: перманганат калия в разных средах - видимые признаки реакций | Химия ЕГЭ | УМСКУЛСкачать

Рассчитайте химическое количество кислорода, которое образуется при разложении перманганата калия массой 15, 8 г, по уравнению химической реакции : 2КМп04 —> ; К2МпО4 + Мп02 + 02?
Рассчитайте химическое количество кислорода, которое образуется при разложении перманганата калия массой 15, 8 г, по уравнению химической реакции : 2КМп04 —> ; К2МпО4 + Мп02 + 02.
Видео:Получение кислорода в лаборатории и проба на кислород. Задание 13. Химия ОГЭСкачать

Какой объем кислорода образуется при разложении 136 г перманганата калия при его нагревании?
Какой объем кислорода образуется при разложении 136 г перманганата калия при его нагревании?
Видео:Получение кислорода в лаборатории из перманганата калия методом вытеснения воздухаСкачать

3. Какой тип реакции соответствует процессу лабораторного получения кислорода из перманганата калия : А) соединение В) разложение С) обмен Д) замещение?
3. Какой тип реакции соответствует процессу лабораторного получения кислорода из перманганата калия : А) соединение В) разложение С) обмен Д) замещение.
Видео:Выделение кислорода при помощи химической реакции (добавим перекись водорода к перманганату калия)Скачать

СТАВЛЮ 20 БАЛЛОВ ЗА ОБЪЯСНЕНИЕ И РЕШЕНИЕ ЗАДАЧ ПО ХИМИИ?
СТАВЛЮ 20 БАЛЛОВ ЗА ОБЪЯСНЕНИЕ И РЕШЕНИЕ ЗАДАЧ ПО ХИМИИ.
1. вычислите количество кислорода разложением 2 моль перманганата калия.
2. Разложением перманганата калия получено 5 моль оксида марганца (римская 4).
Вычислите количество кислорода, выделившегося в этой же реакции.
KMnO4 = K2MnO4 + MnO2 + O2.
На этой странице сайта размещен вопрос Получению кислорода разложением перманганата калия соответствует уравнение реакции : 2KMnO ^ 4 + MnO ^ 2 + O ^ 2 Какое количество оксида марганца (IV) образуется, если в реакцию вступило 0, 6 моль пер? из категории Химия с правильным ответом на него. Уровень сложности вопроса соответствует знаниям учеников 5 — 9 классов. Здесь же находятся ответы по заданному поиску, которые вы найдете с помощью автоматической системы. Одновременно с ответом на ваш вопрос показаны другие, похожие варианты по заданной теме. На этой странице можно обсудить все варианты ответов с другими пользователями сайта и получить от них наиболее полную подсказку.
CuO + 2HCl = CuCl₂ + H₂O по уравнению реакции m(CuO) / M(CuO) = m(CuCl₂) / M(CuCl₂) = n(CuCl₂) откуда масса оксида меди m(CuO) = n(CuCl₂) * M(CuO) m(CuO) = 2моль * 79, 55г / моль = 159, 1г.
Реакция горения : СН4 + 2О2 = СО2 + 2Н2О.
)))))))))))) * ))))))) * * * )))) количество вещества карбоната натрия приблизительно *.
В так мне так сказал учитель.
Cu ⇄CuO→CuSO4→ Cu(OH)2→Cu2O ↓ CuI 2Cu + O2 = 2CuO 3CuO + 2NH3 = N2 + 3Cu + 3H2O CuO + H2SO4 = CuSO4 + H2O 2CuSO4 + 4KI = 2K2SO4 + 2CuI + I2 CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2 2Cu(OH)2 + CH3—CHO (t) = Cu2O + 2H2O + CH3—COOH.
AgNO3 + HCl — > AgCl↓ + HNO3 Ag( + ) + NO3( — ) + H( + ) + Cl( — ) — > AgCl↓ + H( + ) + NO3( — ) Ag( + ) + Cl( — ) — > AgCl↓ Na2SiO3 + H2SO4 — > Na2SO4 + H2SiO3↓ 2Na( + ) + SiO3( — 2) + 2H( + ) + SO4( — 2) — > 2Na( + ) + SO4( — 2) + H2SiO3↓ 2H( + ) +..
Ракообразующие : Е 142, 210, 211, 212, 213, 215, 216, 217, 240.
Метилциклопропан (2 — метилциклопропан — неправильное название) CH₃ | СH / / H₂C — — — — — CH₂.
M(CxHy) = D(H2) * 2 = 27 * 2 = 54 г / моль x : y = 89 / 12 : 11 / 1 = 7, 416 : 11 = 1 : 1, 48 = 4 : 5, 92 = 4 : 6 = C4H6 (бутин) M(C4H6) = (12 * 4) + (6 * 1) = 54 г / моль Ответ : C4H6.
1) NaOH + H2 2) ZnS 3) ZnO 4) ZnCl2 + H2 5) ZnCl2 + Fe 6) Mg(OH)2 + H2 7) Mg3P2 8) — 9) MgCl2 10) — 11) MgSO4 + Ni 12) AlBr3 13) Al2(SO4)3 + Fe 14) AlI3 + H2.
💥 Видео
ОВР с перманганатом калия.Скачать
Кислород. Физические свойства. Получение. Урок 17. Химия 7 класс.Скачать










