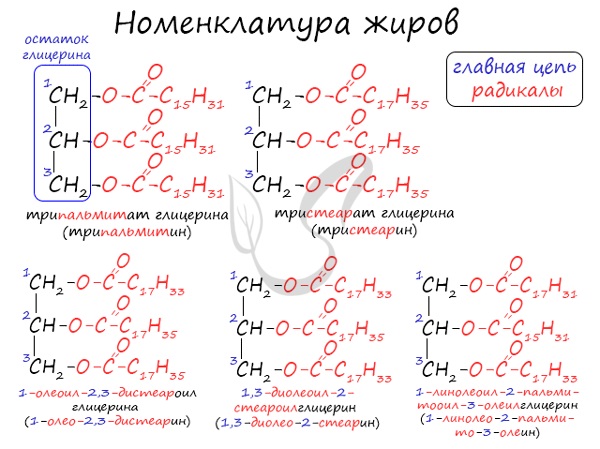
Общее название жиров – триацилглицерины (триглицериды).
Существует несколько способов назвать молекулу жира.
Например, жир, образованный тремя остатками стеариновой кислоты, будет иметь следующие названия:
- Физические свойства жиров
- Химические свойства жиров
- 1.1. Кислотный гидролиз
- 1.2. Щелочной гидролиз — омыление жиров
- 2. Гидрирование (гидрогенизация) ненасыщенных жиров
- 3. Мыло и синтетические моющие средства
- Уравнение реакции омыления жира содержащего остатки пальмитиновой кислоты
- Сложные эфиры. Жиры
- 📹 Видео
Видео:Коваль А.Н. Лекция БХ липидов МПД (2 часть)Скачать

Физические свойства жиров
Жиры растворимы в органических растворителях и нерастворимы в воде. С водой жиры не смешиваются.
| Животные жиры — предельные | Растительные жиры (масла) — непредельные |
| Твёрдые, образованы предельными кислотами – стеариновой и пальмитиновой. Все животные жиры, кроме рыбьего – твёрдые. | Жидкие, образованы непредельными кислотами – олеиновой, линолевой и другими. Все растительные жиры, кроме пальмового масла – жидкие. |
Видео:13.3. Сложные эфиры: Химические свойстваСкачать

Химические свойства жиров
1. Гидролиз (омыление) жиров
Жиры подвергаются гидролизу в кислой или щелочной среде или под действием ферментов.
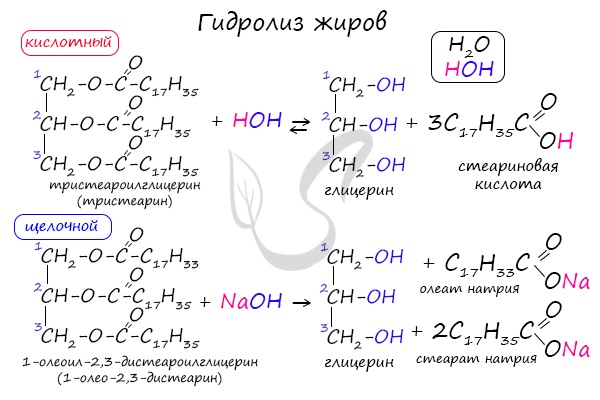
1.1. Кислотный гидролиз
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
| Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин |
1.2. Щелочной гидролиз — омыление жиров
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
| Например, при гидролизе тристеарата глицерина гидроксидом натрия образуется стеарат натрия . |
Видео:Жиры. 1 часть. 11 класс.Скачать

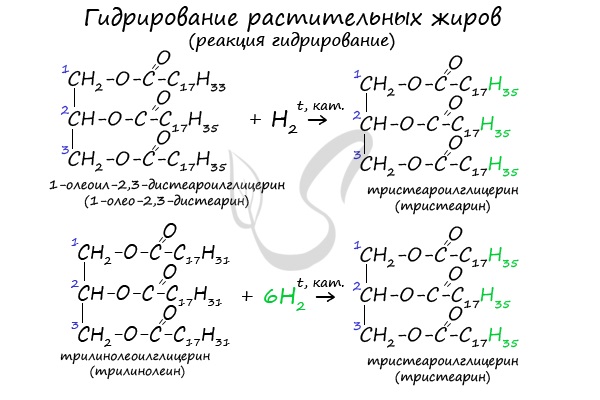
2. Гидрирование (гидрогенизация) ненасыщенных жиров
Гидрогенизация жиров — это процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира.
При этом остатки непредельных кислот переходят в остатки предельных, жидкие растительные жиры превращаются в твёрдые (маргарин).
| Например, триолеат глицерина при гидрировании превращается в тристеарат глицерина: |
| Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее, какая масса йода может присоединиться по двойным связям к 100 г жира. |
Видео:Реакции кислот-окислителей со сложными веществами: как понять? | Химия ЕГЭ 2022 | УмскулСкачать

3. Мыло и синтетические моющие средства
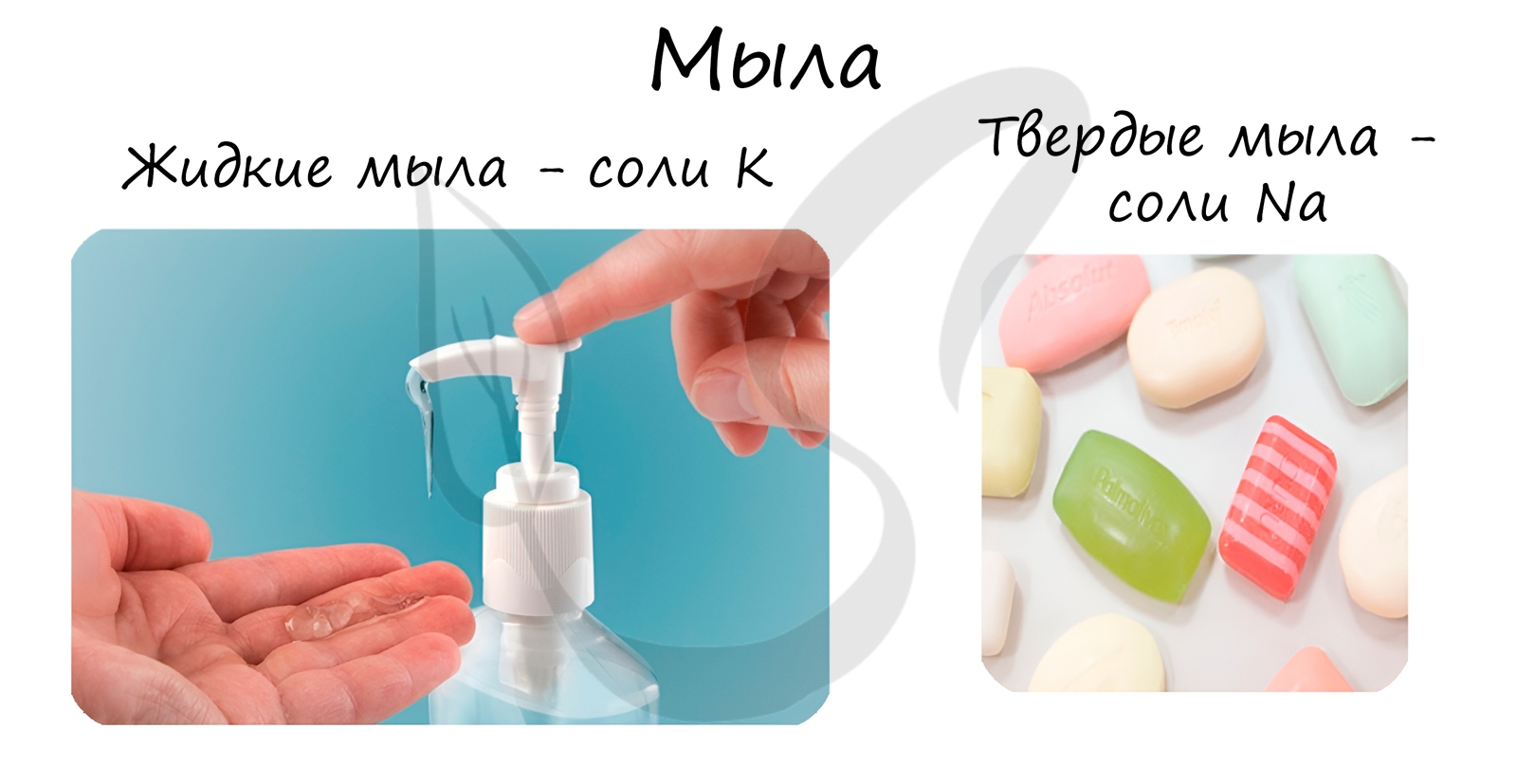
При щелочном гидролизе жиров образуются мыла – соли высших жирных кислот.
Стеарат натрия – твёрдое мыло.
Стеарат калия – жидкое мыло.
Моющая способность мыла зависит от жесткости воды. Оно хорошо мылится и стирает в мягкой воде, плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы Ca 2+ и Mg 2+ образуют с высшими кислотами нерастворимые в воде соли.
| Например, стеарат глицерина взаимодействует с сульфатом кальция |
Поэтому наряду с мылом используют синтетические моющие средства.
Их производят из других веществ, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты.
Спирт реагирует с серной кислотой с образованием алкилсульфата .
Далее алкилсульфат гидролизуется щелочью:
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли этих веществ растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Видео:25. Схема реакции и химическое уравнениеСкачать

Уравнение реакции омыления жира содержащего остатки пальмитиновой кислоты
Жиры — органические соединения, по строению являющиеся сложными эфирами трехатомного спирта глицерина и высших карбоновых (жирных) кислот.
К жирным кислотам (их формулы лучше выучить 😉 относятся:
- Пальмитиновая — C15H31COOH (предельная)
- Стеариновая — C17H35COOH (предельная)
- Олеиновая — C17H33COOH (непредельная, 1 двойная связь в радикале)
- Линолевая — C17H31COOH (непредельная, 2 двойные связи в радикале)
- Линоленовая — C17H29COOH (непредельная, 3 двойные связи в радикале)
Растительные и животные жиры
Жиры образуются в организме растений и животных, служат запасным питательным веществом. В строении растительных и животных жиров есть некоторые важные отличия.
Заметьте, что растительные жиры чаще жидкие и в них входят преимущественно остатки непредельных жирных кислот, а животные жиры — твердые и содержат остатки предельных жирных кислот.
Номенклатура жиров
По систематической номенклатуре жиры принято называть триацилглицеринами. Названия жирам дают в зависимости от ацилов — остатков жирных кислот, входящих в их состав. Для формирования единого названия к остаткам кислот добавляют суффикс «оил».
В соответствии с тривиальной номенклатурой, жиры называют, добавляя окончание «ин» к названию кислоты и приставку, указывая, сколько гидроксогрупп в молекуле глицерина подверглось этерификации. В общем лучше 1 раз увидеть, чем 100 раз услышать 😉
Получение жиров
Жиры (по строению сложные эфиры) получаются в реакции этерификации, протекающей между трехатомным спиртом глицерином и высшими карбоновыми (жирными) кислотами.
В зависимости от того, какие именно кислоты участвуют в реакции, образуются различные жиры.
Химические свойства жиров
- Гидрирование растительных жиров
В состав растительных жиров входят непредельные кислоты, которые поддаются гидрированию и превращаются в предельные. Таким путем в пищевой промышленности получают маргарин.
Как сложные эфиры, жиры способны вступать в реакцию гидролиза, который может быть кислотным и щелочным. В результате кислотного гидролиза образуется глицерин и исходные жирные кислоты, в результате щелочного гидролиза — глицерин и соли жирных кислот.
Реакция щелочного гидролиза жиров называется реакцией омыления, в результате получаются соли жирных кислот — мыла. Кислотный гидролиз протекает обратимо, щелочной — необратимо.
В состав твердого мыла входят соли Na, в состав жидкого — K.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:ЛЕКЦИЯ 3. ЛИПИДЫСкачать
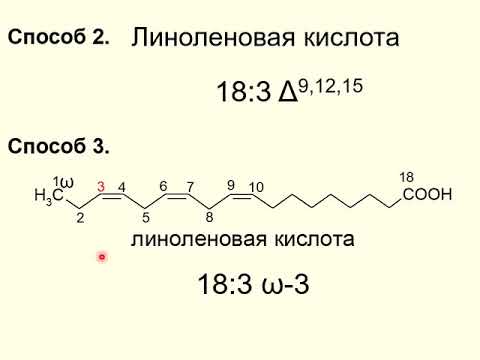
Сложные эфиры. Жиры
Сложные эфиры — это производные карбоновых кислот, в которых гидроксильная группа замещена на остаток спирта.
Номенклатура и изомерия
По систематической номенклатуре названия сложных эфиров производят от названия углеводородного радикала и кислотного остатка, с которым связан радикал. При названии кислотного остатка вместо окончания «-овая» и слова «кислота» используют суффикс «-ат».
Часто сложные эфиры называют по остаткам кислот и спиртов, из которых они состоят. Эфиры, рассмотренные выше, могут быть названы уксуснопропиловым и муравьиноэтиловый соответственно.
Для сложных эфиров характерны:
1) изомерия углеродного скелета:
2) изомерия положения сложноэфирной группы (начинается со сложных эфиров, в молекуле которых содержится не менее 4-х атомов углерода):
3) межклассовая изомерия:
Физические свойства и применение
Сложные эфиры низших карбоновых кислот и спиртов — летучие, легковоспламеняющиеся жидкости с плотностью меньше 1,0. Они практически нерастворимы в воде, зато хорошо растворяются в неполярных органических растворителях. Сложные эфиры не участвуют в образовании межмолекулярных водородных связей, поэтому температуры их кипения ниже, чем у карбоновых кислот со сходной молекулярной массой. Многие низкомолекулярные эфиры обладают приятным фруктовым запахом, например масляноэтиловый эфир — запахом абрикосов, маслянобутиловый — ананасов, уксусноизоамило- вый — груши и т. д. Их применяют в качестве отдушек при приготовлении напитков. Многие сложные эфиры — прекрасные растворители, поэтому они используются в химическом синтезе и технике.
Сложные эфиры высших жирных кислот и высших одноатомных спиртов называют восками. Это твёрдые вещества, обладающие слабым запахом, с низкими температурами кипения, нерастворимые в воде.
Например, основным веществом пчелиного воска является сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
Сложные эфиры получают реакцией этерификации — взаимодействием карбоновой кислоты со спиртом в присутствии сильной минеральной кислоты при нагревании:
Этерификация — обратимый процесс. Прямая реакция — это образование сложного эфира, обратная — его кислотный гидролиз. Для смещения равновесия в сторону образования конечного продукта реакции необходимо отгонять воду.
Сложные эфиры можно получить из хлорангидридов прямым взаимодействием со спиртами:
Сложные эфиры характеризуются низкой реакционной способностью. Они вступают в химические реакции только при нагревании и в присутствии катализатора. Особого внимания заслуживает гидролиз сложных эфиров. Эти соединения подвергаются гидролизу при нагревании в присутствии минеральных кислот или щелочей. В кислой среде реакция обратима и, как было сказано, представляет собой реакцию, обратную этерификации.
При нагревании со щелочью сложные эфиры необратимо гидролизуются с образованием соли исходной карбоновой кислоты и спирта:
Под действием аммиака при нагревании сложные эфиры превращаются в амиды соответствующих карбоновых кислот:
Среди сложных эфиров особое место занимают жиры.
Жиры — это природные сложные эфиры различных высших монокарбоновых кислот и трёхатомного спирта глицерина. Поэтому эти соединения называют глицеридами или по современной номенклатуре — триацилглицери- нами (триацилглицеролами).
В основном остатки карбоновых кислот, входящие в состав жиров, имеют неразветвленную углеродную цепь с четным количеством атомов углерода (обычно С16 — С22)* Наиболее часто в состав жиров входят остатки предельных пальмитиновой (С16) и стеариновой (С18) кислот и непредельной олеиновой (С18) кислоты. Хотя в некоторых жирах встречаются и низшие кислоты, например в сливочном масле содержатся остатки масляной кислоты (С4).
Формально образование жиров можно представить, как результат взаимодействия глицерина и карбоновых кислот, хотя процесс синтеза этих соединений очень сложен.
Жиры относят к простым, если они содержат остатки одной и той же кислоты:
или смешанным, если в их состав входят остатки разных кислот:
Все жиры легче воды и в ней нерастворимы. Они хорошо растворяются в неполярных органических растворителях (бензине, бензоле, диэтиловом эфире, дихлорэтане и др.). Хорошо впитываются волокнистыми и пористыми веществами, кожей, бумагой.
По агрегатному состоянию жиры делятся на твёрдые, обычно это животные жиры, и жидкие — растительные масла. Агрегатное состояние жиров определяется природой карбоновых кислот, входящих в состав этих соединений. Твёрдые жиры (свиной, бараний, говяжий) представлены глицеридами в состав, которых входят высшие предельные кислоты, тогда как в составе масел (подсолнечное, оливковое, хлопковое, кукурузное) преобладают глицериды высших непредельных кислот.
Жиры (глицериды) обладают всеми свойствами сложных эфиров. Жиры, включающие остатки непредельных кислот, проявляют свойства алкенов, они вступают в реакции присоединения, окисления и полимеризации.
При кислотном гидролизе и под действием перегретого пара обычно получают карбоновые кислоты и глицерин:
При щелочном гидролизе жиров получают глицерин и щелочные соли карбоновых кислот:
Щелочные соли высших жирных кислот обладают моющим действием, поэтому их называют мылами, а сам щелочной гидролиз — процессом омыления жиров. Обычные мыла состоят главным образом из смеси солей стеариновой, пальмитиновой и олеиновой кислот, причём натриевые соли образуют твёрдые мыла, а калиевые — жидкие. Исходным сырьём для получения мыла служат растительные масла и животные жиры. А также едкий натр или кальцинированная сода.
Очищающие (моющие) свойства мыла связаны с определёнными особенностями строения молекул щелочных солей высших карбоновых кислот. Каждая такая молекула имеет два фрагмента: небольшую полярную (гидрофильную) головку и крупный неполярный (гидрофобный) углеродный хвост:
Поэтому мыла обладают сродством как к жировым загрязнениям на поверхности кожи или ткани (за счёт гидрофобного хвоста), так и к воде (за счёт гидрофобной головки).
В процессе стирки молекулы мыла гидрофильными концами проникают в частицы жирового загрязнения на
Рис. 39. Схема разрушения жира молекулами мыла (а) и мицеллы (б)
поверхности ткани, в то время как гидрофильные головки остаются в водной фазе (рис. 39, а), что приводит к изменению этих частиц и превращению их в более мелкие мицеллы (рис. 39, б), растворимые в воде. Мицеллы не могут сливаться друг с другом, так как благодаря гидрофильным головкам, обращённым к воде, имеют одноименные заряды. Удаление мицелл с загрязненной поверхности достигается её промыванием водой.
Гидрирование (восстановление) жиров
Присоединение водорода по двойным связям остатков ненасыщенных карбоновых кислот в молекуле жира лежит в основе процесса отверждения жиров — превращение жидких растительных масел в твёрдый жир. Реакция протекает при нагревании под давлением в присутствии катализатора — мелко раздробленного никеля.
Продукт восстановления — твёрдый жир (искусственное сало), называемый саломасом (идёт на производство мыла, высших жирных кислот и глицерина). Маргарин — пищевой жир, состоящий из смеси гидрированных масел (хлопкового, подсолнечного и др.).
При длительном хранении на свету под действием кислорода воздуха протекают процессы расщепления жиров с образованием смеси карбоновых кислот, альдегидов и кетонов, обладающих неприятным (прогорклым) запахом и вкусом. Фотохимическое окисление жиров называется про- горканием. Особенно сильно этому процессу подвержены жиры, содержащие остатки непредельных жирных кислот.
Растительные масла (льняное, конопляное, тунговое), содержащие полиненасыщенные жирные кислоты, при взаимодействии с кислородом воздуха способны образовывать твёрдые, прочные плёнки — «сшитые полимеры». Такие масла называют высыхающими. Они служат основой для приготовления натуральной олифы и красок.
Жиры играют важную роль в жизни человека и животных, так как являются одним из основных источников энергии, затрачиваемой в процессе жизнедеятельности.
Жиры применяются в пищевой, фармацевтической и косметической промышленности.
ВОПРОСЫ И УПРАЖНЕНИЯ
- 1. Напишите структурные формулы всех изомерных сложных эфиров, имеющих состав С4Н802. Назовите их.
- 2. Составьте структурные формулы следующих сложных эфиров: а) пропилового эфира муравьиной кислоты; б) изобутилового эфира уксусной кислоты; в) изопропилового эфира пропионовой кислоты; г) этилацетата; д) метил- формиата.
- 3. Напишите структурные формулы сложных эфиров изомерных по составу капроновой кислоте.
- 4. Напишите уравнения реакций получения: а) абрикосовой эссенции из масляной кислоты и этанола; б) ананасовой эссенции из масляной кислоты и бутанола; в) грушевой эссенции из уксусной кислоты и изоамилового спирта.
- 5. Какие соединения образуются при взаимодействии этилпропионата: а) с водным раствором аммиака; б) с водным раствором гидроксида натрия при нагревании; в) с водным раствором серной кислоты? Напишите уравнения реакций.
- 6. Напишите уравнение реакции этерификации пропи- оновой кислоты этиловым спиртом.
- 7. Рассмотрите схемы кислотного и щелочного гидролиза следующих триглицеридов: а) пальмитодистеарина; б) паль- митоолеостеарина. Какие вещества называют мылами?
- 8. Напишите уравнения реакций гидрирования пальми- тодиолеина и олеодистеарина. В каких условиях проводят эту реакцию? Какое применение она находит в промышленности?
- 9. Путём взаимодействия хлорангидридов соответствующих карбоновых кислот и спиртов получите следующие эфиры: а) этилпропионат; б) бутилацетат; в) изопропи- лацетат.
- 10. При нагревании тристеарина в щелочной среде был получен глицерин массой 18,4 кг. Сколько килограммов гидроксида натрия было использовано для гидролиза?
- 1. Сколько изомерных сложных эфиров соответствуют молекулярной формуле С4Н802?
- а) 3; 6)4; в) 5; г) 6.
- 2. Сколько изомерных сложных эфиров соответствует веществу с молекулярной формулой С5Н10О2?
- а) 7; 6)8; в) 9; г) 10.
- 3. Раствор вещества состава С4Н802 не меняет окраску индикаторов. Какое это вещество, если при взаимодействии его с раствором щёлочи образуется метанол?
- а) Бутановая кислота; в) метил пропионат;
- б) этилацетат; г) пропилформиат
- 4. На гидрирование какого вещества расходуется большее количество водорода?
- а) Тристеарина; в) триолеина;
- б) олеодистеарина; г) диолеостеарина.
- 5. Тристеарин при нагревании обработали:
- а) раствором NaOH; в)Са(ОН)2;
- б) К20; г) раствор H2S04. В каком случае не образуется мыло?
📹 Видео
Мобилизация жиров и регуляция. Бета окисление жирных кислот и регуляцияСкачать
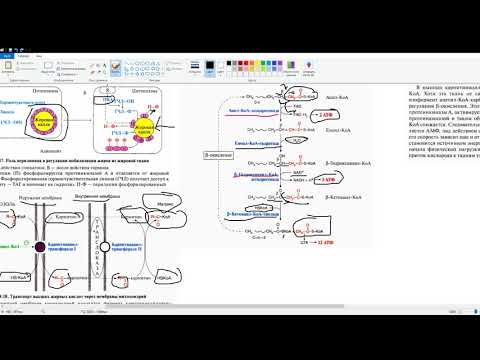
Асеев В. В. - Биохимия - Синтез жирных кислот и липидовСкачать

Химия 10 класс (Урок№9 - Жиры. Моющие средства.)Скачать

Задачи по химии. Щелочной гидролиз жиров. В2 ЦТ 2011Скачать

Занятие по химииСкачать

Как определить кислотность желудка? 3 домашних теста🧐Скачать
ЦТ 2011 по химии | Часть В | Вариант 1Скачать

Содовый тест на измерение кислотности в домашних условияхСкачать

КАК ОПРЕДЕЛИТЬ КИСЛОТНОСТЬ ЖЕЛУДКА? Изжога, язвы, гастриты: пониженная кислотность VS повышенная.Скачать

Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать

Задание №13 | Азотсодержащие вещества, углеводы, жиры | ЕГЭ по химии 2024Скачать

Совместный гидролиз в реакциях ионного обмена: за что?! | Химия ЕГЭ | УмскулСкачать

Сложные эфиры ЖирыСкачать

Сложные эфирыСкачать