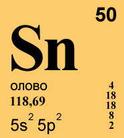Химические свойства олова
Олово – это легкий металл с атомным номером 50, который находится в 14-й группе периодической системы элементов. Этот элемент был известен еще в древности и считался одним из самых редких и дорогих металлов, поэтому изделия из олова могли позволить себе самые богатые жители Римской Империи и Древней Греции. Из олова изготавливали специальную бронзу, которой пользовались еще в третьем тысячелетии до нашей эры. Тогда бронза была самым прочным и популярным сплавом, а олово служило одной из примесей и использовалось более двух тысяч лет.
На латыни этот металл называли словом «stannum», что означает стойкость и прочность, однако таким названием ранее обозначался сплав свинца и серебра. Только в IV веке этим словом начали называть само олово. Само же название «олово» имеет множество версий происхождения. В Древнем Риме сосуды для вина делались из свинца. Можно предположить, что оловом называли материал свинец, из которого изготавливали сосуды для хранения напитка оловина, употребляемого древними славянами.
В природе этот металл встречается редко, по распространенности в земной коре олово занимает всего лишь 47-е место и добывается из касситерита, так называемого оловянного камня, который содержит около 80 процентов этого металла.
Видео:Серная кислота. Химические свойства. Реакции с металлами.Скачать

Применение в промышленности
Так как олово является нетоксичным и весьма прочным металлом, он применяется в сплавах с другими металлами. По большей части его используют для изготовления белой жести, которая применяется в производстве банок для консервов, припоев в электронике, а также для изготовления бронзы.
Видео:Серная кислота и ее соли. 9 класс.Скачать

Физические свойства олова
Этот элемент представляет собой металл белого цвета с серебристым отблеском.
Если нагреть олово, можно услышать потрескивание. Этот звук обусловлен трением кристалликов друг о друга. Также характерный хруст появится, если кусок олова просто согнуть.
Олово весьма пластично и ковко. В классических условиях этот элемент существует в виде «белого олова», которое может модифицироваться в зависимости от температуры. Например, на морозе белое олово превратится в серое и будет иметь структуру, схожую со структурой алмаза. Кстати, серое олово очень хрупкое и буквально на глазах рассыпается в порошок. В связи с этим в истории есть терминология «оловянная чума».
Раньше люди не знали о таком свойстве олова, поэтому из него изготавливались пуговицы и кружки для солдат, а также прочие полезные вещи, которые после недолгого времени на морозе превращались в порошок. Некоторые историки считают, что именно из-за этого свойства олова снизилась боеспособность армии Наполеона.
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Получение олова
Основным способом получения олова является восстановление металла из руды, содержащей оксид олова(IV) с помощью угля, алюминия или цинка.
Особо чистое олово получают электрохимическим рафинированием или методом зонной плавки.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Химические свойства олова
При комнатной температуре олово довольно устойчиво к воздействию воздуха или воды. Это объясняется тем, что на поверхности металла возникает тонкая оксидная пленка.
На воздухе олово начинает окисляться только при температуре свыше 150 °С:
Если олово нагреть, этот элемент будет реагировать с большинством неметаллов, образуя соединения со степенью окисления +4 (она более характерна для этого элемента):
Взаимодействие олова и концентрированной соляной кислоты протекает довольно медленно:
Sn + 4HCl → H₂[SnCl₄] + H₂
С концентрированной серной кислотой олово реагирует очень медленно, тогда как с разбавленной в реакцию не вступает вообще.
Очень интересна реакция олова с азотной кислотой, которая зависит от концентрации раствора. Реакция протекает с образованием оловянной кислоты, H₂SnO₃, которая представляет собой белый аморфный порошок:
3Sn + 4HNO₃ + nH₂O = 3H₂SnO₃·nH₂O + 4NO
Если же олово смешать с разбавленной азотной кислотой, этот элемент будет проявлять металлические свойства с образованием нитрата олова:
4Sn + 10HNO₃ = 4Sn(NO₃)₂ + NH₄NO₃ + 3H₂O
Нагретое олово нагреть может реагировать со щелочами с выделением водорода:
Sn + 2KOH + 4H₂O = K₂[Sn(OH)₆] + 2H₂
Здесь вы найдете безопасные и очень красивые эксперименты с оловом.
Степени окисления олова
В простом состоянии степень окисления олова равняется нулю. Также Sn может иметь степень окисления +2: оксид олова(II) SnO, хлорид олова(II) SnCl₂, гидроксид олова(II) Sn(OH)₂. Степень окисления +4 наиболее характерна для оксида олова(IV) SnO₂, галогенидах(IV), например хлорид SnCl₄, сульфид олова(IV) SnS₂, нитрид олова(IV) Sn₃N₄.
Видео:Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Sn Олово
ОЛОВО (лат. Stannum), Sn, химический элемент с атомным номером 50, атомная масса 118,710. О происхождении слов «stannum» и «олово» существуют различные догадки. Латинское «stannum», которое иногда производят от саксонского «ста» прочный, твердый, первоначально означало сплав серебра и свинца. «Оловом» в ряде славянских языков называли свинец. Возможно, русское название связано со словами «ол», «оловина» пиво, брага, мед: сосуды из олова использовались для их хранения. В англоязычной литературе для названия олова используется слово tin. Химический символ олова Sn читается «станнум».
Природное олово состоит из девяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96% по массе), 114 (0,66%), 115 (0,35%), 116 (14,30%), 117 (7,61%), 118 (24,03%), 119 (8,58%), 120 (32,85%), 122 (4,72%), и одного слабо радиоактивного олова-124 (5,94%). 124 Sn b -излучатель, его период полураспада очень велик и составляет T1/2 = 10 16 10 17 лет. Олово расположено в пятом периоде в IVА группе периодической системы элементов Д. И. Менделеева. Конфигурация внешнего электронного слоя 5s 2 5p 2 . В своих соединениях олово проявляет степени окисления +2 и +4 (соответственно валентности II и IV).
Металлический радиус нейтрального атома олова 0,158 нм, радиусы иона Sn 2+ 0,118 нм и иона Sn 4+ 0,069 нм (координационное число 6). Энергии последовательной ионизации нейтрального атома олова равны 7,344 эВ, 14,632, 30,502, 40,73 и 721,3 эВ. По шкале Полинга электроотрицательность олова 1,96, то есть олово находится на условной границе между металлами и неметаллами.
Физические и химические свойства: простое вещество олово полиморфно. В обычных условиях оно существует в виде b -модификации (белое олово), устойчивой выше 13,2°C. Белое олово это серебристо-белый, мягкий, пластичный металл, обладающий тетрагональной элементарной ячейкой, параметры a = 0.5831, c = 0.3181 нм. Координационное окружение каждого атома олова в нем октаэдр. Плотность b -Sn 7,228 г/см 3 . Температура плавления 231,9°C, температура кипения 2270°C.
При охлаждении, например, при морозе на улице, белое олово переходит в a -модификацию (серое олово). Серое олово имеет структуру алмаза (кубическая кристаллическая решетка с параметром а = 0,6491 нм). В сером олове координационный полиэдр каждого атома тетраэдр, координационное число 4. Фазовый переход b -Sn a -Sn сопровождается увеличением удельного объема на 25,6% (плотность a -Sn составляет 5,75 г/см 3 ), что приводит к рассыпанию олова в порошок. В старые времена наблюдавшееся во время сильных холодов рассыпание оловянных изделий называли «оловянной чумой». В результате этой «чумы» пуговицы на обмундировании солдат, их пряжки, кружки, ложки рассыпались, и армия могла потерять боеспособность. (Подробнее об «оловянной чуме» см. интересные факты об олове, ссылка внизу этой страницы).
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, b -Sn металл, а a -Sn относится к числу полупроводников. Ниже 3,72 К a -Sn переходит в сверхпроводящее состояние. Стандартный электродный потенциал E °Sn 2+ /Sn равен 0.136 В, а E пары °Sn 4+ /Sn 2+ 0.151 В.
При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C:
При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Например:
С концентрированной соляной кислотой олово медленно реагирует:
Возможно также образование хлороловянных кислот составов HSnCl3, H2SnCl4 и других, например:
В разбавленной серной кислоте олово не растворяется, а с концентрированной реагирует очень медленно.
Состав продукта реакции олова с азотной кислотой зависит от концентрации кислоты. В концентрированной азотной кислоте образуется оловянная кислота b -SnO2·nH2O (иногда ее формулу записывают как H2SnO3). При этом олово ведет себя как неметалл:
При взаимодействии с разбавленной азотной кислотой олово проявляет свойства металла. В результате реакции образуется соль нитрат олова (II):
При нагревании олово, подобно свинцу, может реагировать с водными растворами щелочей. При этом выделяется водород и образуется гидроксокомплекс Sn (II), например:
Гидрид олова станнан SnH4 можно получить по реакции:
Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0°C.
Олову отвечают два оксида SnO2 (образующийся при обезвоживании оловянных кислот) и SnO. Последний можно получить при слабом нагревании гидроксида олова (II) Sn(OH)2 в вакууме:
При сильном нагреве оксид олова (II) диспропорционирует:
При хранении на воздухе монооксид SnO постепенно окисляется:
При гидролизе растворов солей олова (IV) образуется белый осадок так называемая a -оловянная кислота:
Свежеполученная a -оловянная кислота растворяется в кислотах и щелочах:
При хранении a -оловянная кислота стареет, теряет воду и переходит в b -оловянную кислоту, которая отличается большей химической инертностью. Данное изменение свойств связывают с уменьшением числа активных HOSn группировок при стоянии и замене их на более инертные мостиковые SnOSn связи.
При действии на раствор соли Sn (II) растворами сульфидов выпадает осадок сульфида олова (II):
Этот сульфид может быть легко окислен до SnS2 раствором полисульфида аммония:
Образующийся дисульфид SnS2 растворяется в растворе сульфида аммония (NH4)2S:
Четырехвалентное олово образует обширный класс оловоорганических соединений, используемых в органическом синтезе, в качестве пестицидов и других.
История открытия: когда человек впервые познакомился с оловом точно сказать нельзя. Олово и его сплавы известны человечеству с древнейших времен. Упоминание об олове есть в ранних книгах Ветхого Завета. Сплавы олова с медью, так называемые оловянные бронзы, по-видимому, стали использоваться более чем за 4000 лет до нашей эры. А с самим металлическим оловом человек познакомился значительно позже, примерно около 800 года до нашей эры.
Из чистого олова в древности изготовляли посуду и украшения, очень широко применяли изделия из бронзы.
Нахождение в природе: олово редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Содержание олова в земной коре составляет, по разным данным, от 2·10 4 до 8·10 3 % по массе. Основной минерал олова касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) Cu2FeSnS4 (27,5 % Sn).
Получение: для добычи олова в настоящее время используют руды, в которых его содержание равно или немного выше 0,1%. На первом этапе руду обогащают (методом гравитационной флотации или магнитной сепарации). Таким образом удается повысить содержание олова в руде до 40-70%. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Затем полученный таким образом оксид SnO2 восстанавливают углем или алюминием (цинком) в электропечах:
Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
Применение: важное применение олова лужение железа и получение белой жести, которая используется в консервной промышленности. Для этих целей расходуется около 33% всего добываемого олова. До 60% производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев. Олово способно прокатываться в тонкую фольгу станиоль, такая фольга находит применение при производстве конденсаторов, органных труб, посуды, художественных изделий. Олово применяют для нанесения защитных покрытий на железо и другие металлы, а также на металлические изделия (лужение). Дисульфид олова SnS2 применяют в составе красок, имитирующих позолоту («сусальное золото»).
Искусственный радионуклид олова 119 Sn источник v -излучения в мессбауэровской спектроскопии.
Физиологическое действие: о роли олова в живых организмах практически ничего не известно. В теле человека содержится примерно (1-2)·10 4 % олова, а его ежедневное поступление с пищей составляет 0,2-3,5 мг. Олово представляет опасность для человека в виде паров и различных аэрозольных частиц, пыли. При воздействии паров или пыли олова может развиться станноз поражение легких. Очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м 3 , ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках 100 мг/кг. Токсическая доза олова для человека 2 г.
Видео:Взаимодействие сахара с концентрированной серной кислотойСкачать

Химические свойства олова
Видео:Изучаем химические свойства концентрированной серной кислоты!Скачать

Сообщение об ошибке
Содержание
Химические свойства олова
Превращение белого олова в серое – явление, которое называют оловянной чумой. Обычно медленно идущее превращение ускоряется при соприкосновении с уже превращенным металлом, при этом резко изменяются свойства олова, оно превращается в порошок.
Чем чище олово и чем большей деформации оно подверглось перед хранением, тем быстрее при низких температурах происходит превращение белого олова в серое. Высокая скорость превращения наблюдается в присутствии примесей Те, Мn, Со, Zn, А1, Ga и As, в меньшей мере Fe и Au; сильно уменьшают скорость превращения Pb, Cd, Sb и Ag, в меньшей мере Ni и Сu; добавка 0,5 % Bi полностью предотвращает оловянную чуму.
Серое олово обладает полупроводниковыми свойствами.
Прочная тонкая поверхностная пленка окислов делает олово устойчивым но отношению к воздуху и воде. Медленное окисление олова на воздухе с образованием SnO и SnO2 наблюдается лишь выше 150 °С. Бидистиллят совершенно не растворяет олово. При высокой температуре олово легко и полностью сгорает, образуя двуокись олова.
С хлором и бромом олово взаимодействует при обычной температуре, с иодом – при слабом нагревании. Реакция с фтором протекает при обычной температуре чрезвычайно медленно, при 100 °С идет очень бурно – с появлением пламени. При нагревании олово энергично реагирует с серой, селеном и теллуром, взаимодействует с фосфором, а с азотом, углеродом, кремнием и водородом непосредственно не взаимодействует, однако косвенным путем можно получить гидриды, нитриды и имиды олова.
Близость нормального потенциала олова и водорода, а также высокое перенапряжение водорода на олове объясняют малую скорость взаимодействия этого металла с разбавленными кислотами (особенно в отсутствие кислорода). В присутствии кислорода скорость растворения существенно возрастает. Устойчиво олово также в атмосфере газообразного сероводорода, насыщенного влагой, и в его насыщенном водном растворе.
Концентрированная соляная кислота легко (особенно при нагревании) растворяет олово с образованием SnCl2 и водорода. Интересно отметить, что реакция β -олова с 37 %-ной НCl при – 17 °С идет с образованием SnCl2 и водорода. В этих условиях α -олово образует SnCl4.
Скорость бесстружкового растворения олова в 5,54N НСl при 17 °С лимитируется скоростью анодно-катодного процесса, в то время как скорость растворения таких металлов, как магний и цинк, значительно больше и лимитируется скоростью диффузии растворителя к поверхности металла.
Сильно разбавленная холодная азотная кислота медленно растворяет олово и образует Sn(NO3)2. При этом не происходит выделения водорода, а идет восстановление азотной кислоты. Концентрированная азотная кислота энергично взаимодействует с оловом и образует нерастворимую β -оловянную кислоту. С концентрированной серной кислотой олово взаимодействует гораздо медленнее.
Олово очень хорошо растворяется в царской водке. Реакция протекает по уравнению
Растворы (1%-ные) уксусной и молочной кислот взаимодействуют с оловом примерно с такой же скоростью, как серная кислота, и приблизительно в 3 раза медленнее, чем соляная кислота.
0,1N раствор лимонной кислоты при 25 °С растворяет олово почти с такой же скоростью, как соляная кислота при тех же условиях. Олово реагирует со стеариновой и олеиновой кислотами при высоких температурах. Наиболее агрессивной из изученных органических кислот по отношению к олову оказалась щавелевая.
Щелочи медленно растворяют олово даже на холоду и при низких концентрациях. Скорость растворения значительно повышается в присутствии воздуха. При этом в растворе образуются гидроксостаннат-ионы [Sn(OH)2] 2- . Растворимость олова в щелочах используют для снятия его со старых консервных банок, после чего металл выделяют из раствора электролитически. Для переведения олова в раствор применяют метод анодного растворения олова в концентрированном растворе NaOH. При этом, однако, возможно пассивирование олова, если плотность тока превышает определенную величину.
Негидролизующиеся соли соляной, серной и других кислот не разрушают окисную пленку на олове; в случае коррозионного процесса либо происходит утолщение окисной пленки и поверх¬ность олова тускнеет, либо появляются черные пятна и коррозия носит точечный характер. Соли, подвергающиеся гидролизу и имеющие в растворах кислую реакцию (FeCl3, АlСl3), в присутствии окислителей вызывают коррозию олова.
В таблице представлена стойкость олова против некоторых реагентов.
📸 Видео
Йодид Олова(4) - SnI4. Реакция Олова и Йода. Реакция Sn и I2.Скачать

Правило разбавления концентрированной серной кислоты водойСкачать

Концентрированная серная кислота и ее особые свойства | Химия ЕГЭ | УмскулСкачать

Взаимодействие цинка с серной кислотойСкачать

Реакция концентрированной серной кислоты с серойСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Реакция Концентрированной Серной Кислоты и Хлората Натрия. Реакция H2SO4 и NaClO3. Выделение ClO2.Скачать

Практическая работа №5. Разбавленная серная кислота и её соли. 9 класс.Скачать

Реакция САХАРА и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Обугливание САХАРА. Домашние опыты по химииСкачать

Взаимодействие серы с конц. серной кислотойСкачать

Взаимодействие серной кислоты с металламиСкачать

Триоксид Марганца(6) - MnO3. Реакция Перманганата Калия и концентрированной Серной Кислоты.Скачать

Реакция БРОМИДА НАТРИЯ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Опыты по химии. Домашние экспериментыСкачать