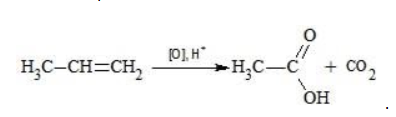
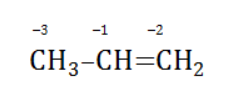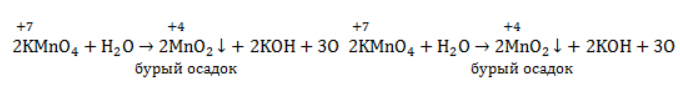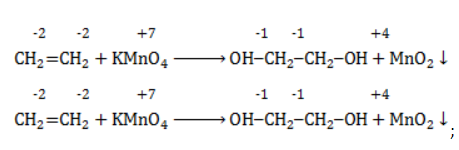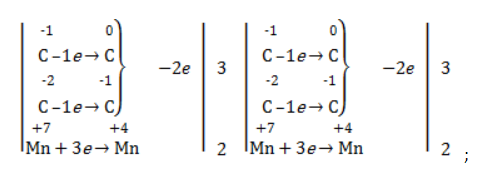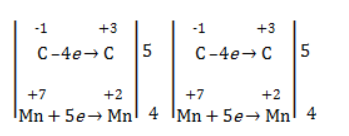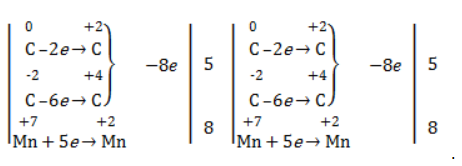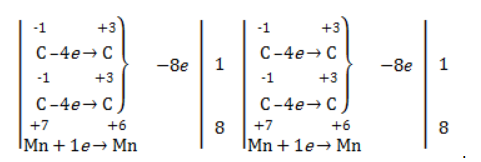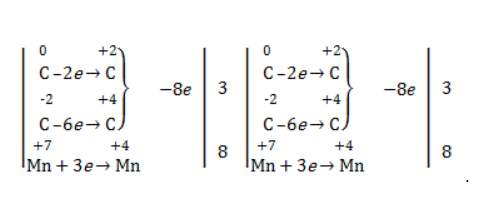В отличие от предельных углеводородов, алкены характеризуются высокой химической активностью, обусловленной особенностями строения молекулы. При обычных условиях алкены охотно вступают в реакции неполного окисления с превращением в органические соединения других классов. Универсальный реагент в процессах окисления алкенов – перманганат калия.
- Понятие о неполном окислении
- Определение степеней окисления
- Влияние среды на окислитель
- Мягкое окисление
- Жесткое окисление
- Окисление перманганатом калия в кислой среде
- Окисление алкенов в щелочной среде
- Окисление в нейтральном растворе
- Заключение
- Жесткое окисление алкенов. Как записать уравнение?
- Жесткое окисление алкенов в кислой среде
- Пропен + KMnO4 +H2SO4
- 2-метилпропен + KMnO4 + H2SO4
- Пропен + K2Cr2O7 + H2SO4
- 2-метилпропен + K2Cr2O7 + H2SO4
- Acetyl
- РАССТАНОВКА КОЭФФИЦИЕНТОВ В УРАВНЕНИЯХ РЕАКЦИЙ ОКИСЛЕНИЯ АЛКЕНОВ ПЕРМАНГАНАТОМ КАЛИЯ, ПРОТЕКАЮЩИХ В КИСЛОЙ СРЕДЕ С РАЗРЫВОМ УГЛЕРОДНОЙ ЦЕПИ материал для подготовки к егэ (гиа) по химии (10 класс) на тему
- Скачать:
- Предварительный просмотр:
- По теме: методические разработки, презентации и конспекты
- 🔥 Видео
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Понятие о неполном окислении
В химии органических соединений под окислением понимается взаимодействие, при котором происходит обеднение реагента водородом или обогащение кислородом, сопровождающееся отдачей электронов молекулой. Обратный процесс называется восстановлением.
Полное окисление происходит при горении углеводородов с разрушением молекулы. Продуктами в этом случае являются углекислый газ и вода. При неполном окислении продуктами становятся различные вещества.
Высокая реакционная способность алкенов обусловливается присутствием в молекуле двойной связи. Один из ее компонентов – слабая 
Определение степеней окисления
Для того чтобы правильно записать уравнение реакции неполного окисления алкена, нужно определить степени окисления атомов до вступления во взаимодействие и после него. Они рассчитываются исходя из электроотрицательности элементов.
Например, при окислении пропена перманганатом калия 


- В составе группы
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
, отнимая у водородных атомов по одному отрицательному заряду. На связи
сдвига электронов нет. Следовательно, атом углерода приобретает степень окисления -2 -2;
- В группе
аналогичный подсчет показывает для углерода степень окисления -1 -1 (для каждого водорода соответственно +1 +1);
- В радикале
углерод оттягивает на себя отрицательные заряды с трех водородных атомов и имеет степень окисления -3 -3.
В общем виде результат можно записать следующим образом:
Расчет степеней окисления в кислородсодержащих соединениях производится аналогично с учетом большей электроотрицательности кислорода.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Влияние среды на окислитель
Состав раствора (наряду с температурой) определяет, до какого соединения окислится восстановитель – алкен. Окислитель в растворах с различным уровнем кислотности (щелочности) также ведет себя неодинаково.
Неорганическая соль 


В нейтральной и слабощелочной среде марганец приобретает степень окисления +4 +4:
Кислород из перманганат-аниона присоединяется к алкену по месту двойной связи.
Под воздействием серной кислоты марганец восстанавливается до степени окисления +2 +2:
При окислении со щелочью (гидроксид лития достаточно высокой концентрации) марганец восстановится до +6 +6:
Видео:Окисление органических соединений перманганатом калияСкачать

Мягкое окисление
Процесс в нейтральной или слабощелочной среде при обычной температуре представляет собой так называемое мягкое окисление перманганатом калия, или гидроксилирование. В алкене разрывается 
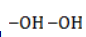
- кислород из перманганат-иона;
- вода.
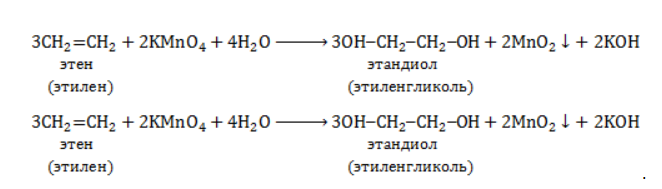
Продукт реакции – диол (двухатомный спирт). Например, окисление этилена перманганатом калия приводит к образованию этиленгликоля:
Для составления полного уравнения нужно:
- определить степени окисления реагентов:
- рассчитать электронный баланс:
- расставить коэффициенты:
- ввести в уравнение недостающие реагенты и продукты, исходя из равенства состава в левой и правой частях уравнения, и определить окончательные коэффициенты:
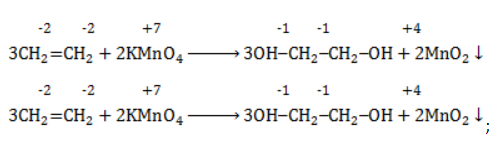
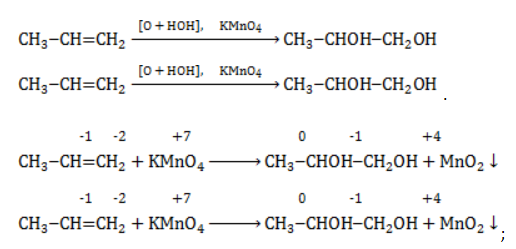
Реакция окисления пропена в нейтральной среде перманганатом калия составляется аналогично:
Дальше мягкое окисление не идет, так как 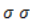
Видео:ОВР с перманганатом калия.Скачать

Жесткое окисление
Жесткими называют процессы окисления, протекающие в нейтральном растворе в условиях повышенной температуры, а также при добавлении кислоты или щелочи. В этих случаях двойная связь в алкене разрушается полностью, а продуктами реакции становятся кетоны, кислоты (с промежуточным окислением до альдегида) либо соли.
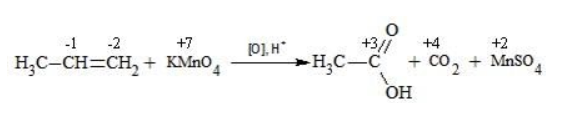
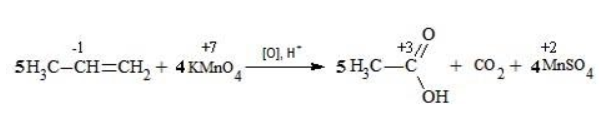
Окисление перманганатом калия в кислой среде
Пропен в содержащем кислоту растворе 

Степени окисления участвующих в реакции углеродных атомов и марганца составят:
Электронный баланс определяется только с учетом углерода, вошедшего в состав кислоты:
Сначала расставляются коэффициенты в окислителе, восстановителе и в продуктах окисления:
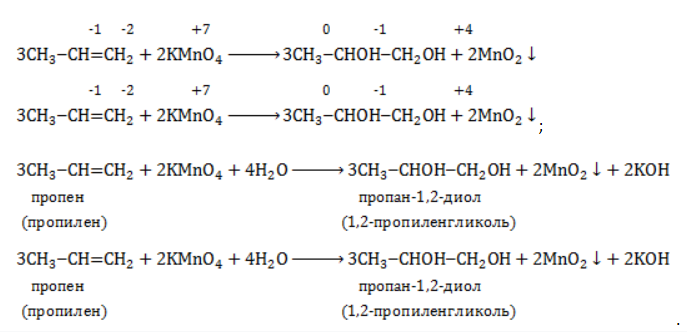
Затем вписываются недостающие вещества и полностью рассчитываются коэффициенты:
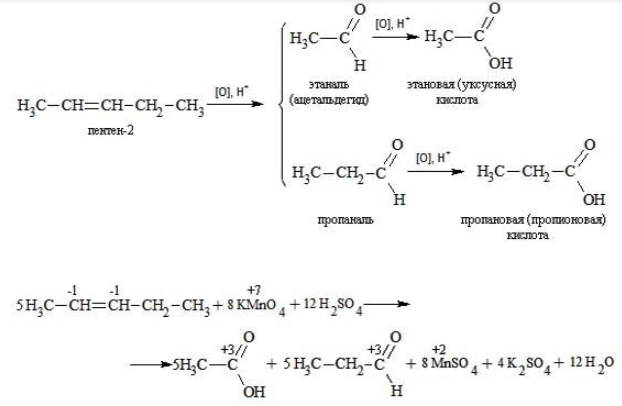
Еще один пример жесткого окисления алкенов перманганатом калия с серной кислотой – реакция с участием пентена-2. Молекула расщепляется по месту двойной связи, и ее фрагменты окисляются через промежуточное образование альдегидов до двух кислот:
Электронный баланс составляется для двух углеродных атомов алкена, поскольку оба они являются восстановителями.
Правило, по которому осуществляется окисление углерода, отражено в таблице:
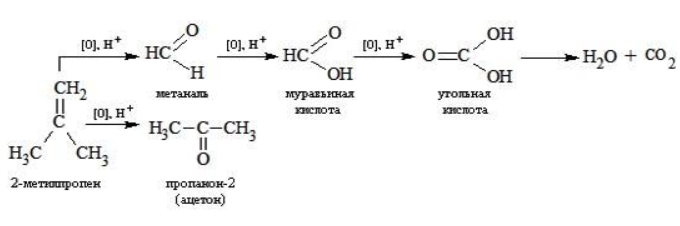
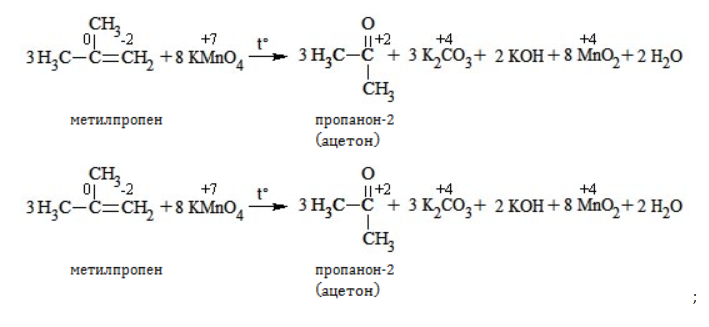
Так, в 2-метилпропене первичный атом окисляется через промежуточные формальдегид (метаналь) и муравьиную кислоту полностью – до углекислого газа, а третичный – только до ацетона:
Окисление алкенов в щелочной среде
При нагревании с концентрированной щелочью алкены окисляются до солей:
Если один из углеродных атомов – первичный, он окисляется до углекислого газа:
Окисление в нейтральном растворе
В условиях высокой температуры образующаяся щелочь вступает в реакцию, в результате которой окисление алкенов продолжается до образования кетонов или солей. Так, при жестком окислении пропена в нейтральной среде получаются те же продукты, что и в присутствии концентрированного гидроксида калия: ацетат 




Кетон – результат окисления третичного углеродного атома, и дальнейшую реакцию они не поддерживают. Например, при окислении метилпропена как конечный продукт образуется ацетон:
Видео:Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать

Заключение
Взаимодействие с раствором перманганата калия в мягких или жестких условиях является показателем высокой реакционной способности алкенов, которая обусловлена присутствием в молекуле легко разрываемой -связи. Реакции мягкого и жесткого окисления относятся к числу характерных химических свойств алкенов как ненасыщенных углеводородов.
Видео:Окисление алкенов с Тасей | Химия ЕГЭСкачать

Жесткое окисление алкенов. Как записать уравнение?
Видео:10 класс (профиль).Ч.2.Окисление алкенов раствором марганцовки в кислой среде.Скачать

Жесткое окисление алкенов в кислой среде
Данный процесс чаще всего осуществляют, действуя на алкены подкисленным раствором перманганата калия, либо дихромата калия. В качестве средообразователя всегда используют серную кислоту. При таком окислении происходит полный разрыв углеродного скелета по двойной связи, и в зависимости от особенностей строения продуктами окисления могут быть различные вещества.
Давайте сначала разберемся с тем, какие углеродсодержащие продукты образуются при жестком окислении алкенов с различным строением. Представим, что у нас стоит задача определить продукты окисления для следующих двух веществ:
Обратите внимание, что углеродные атомы при двойной связи обозначены разными цветами.
Атом углерода, выделенный красным цветом, является первичным, то есть связан только с одним другим атомом углерода.
Атом углерода, выделенный желтым цветом, является вторичным, то есть связан с двумя другими атомами углерода.
Атом углерода, выделенный зеленым цветом, является третичным, то есть связан с тремя другими атомами углерода.
Жесткое окисление подразумевает разрыв углеродного скелета по месту двойной связи:
Следует запомнить, что первичные атомы углерода (красные) при таком окислении переходят в углекислый газ.
Вторичные атомы углерода (желтые) переходят в состав карбоксильной группы (COOH), то есть образуется карбоновая кислота.
Третичные атомы углерода(зеленые) переходят в состав карбонильной группы, то есть образуется кетон.
Теперь осталось разобраться с остальными продуктами реакции. Если в качестве окислителя используется сернокислый раствор перманганата калия, то продуктами будут также MnSO4, K2SO4 и H2O. Если же в качестве окислителя взяли сернокислый раствор дихромата калия, продуктами будут Cr2(SO4)3, K2SO4 и H2O.
Давайте разберем все эти случаи. Начнем с реакции пропена с сернокислым раствором перманганата калия.
Пропен + KMnO4 +H2SO4
Исходя из вышесказанного, запишем схему этой реакции:
Осталось расставить коэффициенты. Определим, какие атомы изменили степени окисления. В случае марганца ничего сложного нет: степень окисления его в перманганате была +7, стала равна +2. Также степени окисления меняют те атомы углерода, у которых изменилось окружение. В схеме эти атомы обозначены желтым и красным цветами. Определим степени окисления этих атомов методом блоков. Изолируем друг от друга фрагменты молекулы по углерод-углеродным связям следующим образом:
Далее, условно примем, что заряд каждого выделенного блока равен нулю (как у нейтральной молекулы). Степень окисления водорода в органических веществах всегда равна +1. Обозначим степени окисления «желтого» атома С как х, «красного» — как y:
Далее, учитывая, что заряд каждого блока мы приняли равным нулю, мы можем составить и решить два уравнения:
Аналогично рассчитаем степень окисления «желтого» атома углерода в уксусной кислоте и «красного» в молекуле углекислого газа, учитывая, что степень окисления кислорода в органических веществах всегда равна -2 (кроме органических пероксидов, изучение которых в не входит в программу ЕГЭ):
Далее, аналогично, составим и решим два уравнения, учитывая, что заряд выделенного блока мы приняли равным нулю, а заряд молекулы углекислого газа, как и у любой другой молекулы, также нейтрален.
Таким образом, «желтый» атом углерода имел степень окисления до реакции, равную -1, а после +3.
«Красный» атом углерода изменил свою степень окисления с -2, на +4.
Учитывая, что марганец изменил свою степень окисления с +7 на +2, еще раз запишем схему реакции и составим электронный баланс. «Желтый» и «красный» атомы углерода, очевидно, всегда будут в соотношении 1 к 1, независимо от коэффициента перед органическим веществом, потому запишем их в одной строчке «полуреакции» окисления.
Перенесем коэффициенты из баланса:
Поскольку в левой части схемы мы видим два атома калия, в правой части схемы перед сульфатом калия коэффициент 1, ставить который не нужно. В правой части уравнения мы видим 3 сульфатных остатка, поэтому ставим перед серной кислотой коэффициент 3:
Осталось поставить коэффициент перед водой в правой части. Это можно сделать по кислороду или водороду на выбор. Поскольку мы уравняли число сульфатных остатков в левой и правой частях, то кислород в них можно не учитывать. Считаем только кислород в остальных соединениях. Слева мы видим 8 атомов кислорода (не считая кислород в серной кислоте). В правой части не считая воду — 4 атома кислорода. Поэтому перед водой коэффициент будет равен 4:
Сравнивая количества всех элементов слева и справа, видим, что все коэффициенты расставлены верно.
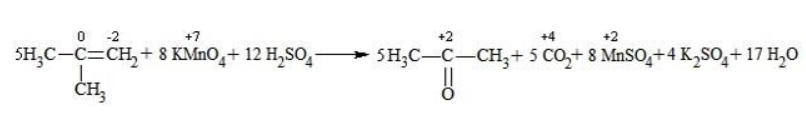
2-метилпропен + KMnO4 + H2SO4
Аналогично предыдущему примеру рассчитаем степени окисления углеродных атомов, которые изменили свою степень окисления:
Учитывая, что заряд каждого выделенного блока мы приняли равным нулю, составим и решим уравнения:
Аналогично поступим с продуктами окисления:
составим и решим уравнения:
Таким образом, «зеленый» атом углерода до реакции имел степень окисления, равную 0, после +2, «красный» изменил свою степень окисления с -2 на +4.
Далее запишем схему окисления и составим электронный баланс:
Перенесем коэффициенты из электронного баланса в схему:
Далее мы видим, что в левой части схемы 8 атомов калия, потому перед сульфатом калия поставим коэффициент 4.
Теперь можно заметить, что в правой части уравнения 12 сульфатных групп (8 в сульфате марганца, 4 в сульфате калия). Поэтому перед серной кислотой в левой части нужно поставить коэффициент 12:
Осталось поставить коэффициент перед водой. Сделаем это по кислороду. Количество сульфатных групп мы уравняли, потому кислород в них можно не учитывать. Слева мы видим 32 атома кислорода (8*4). В правой части уравнения, не считая воды и сульфатных групп, 15 атомов кислорода (5 в молекуле кетона и 10 в 5 молекулах углекислого газа). Таким образом, перед водой необходимо поставить коэффициент 17.
Посчитав водород слева и справа, мы убеждаемся, что коэффициенты расставлены верно.
Пропен + K2Cr2O7 + H2SO4
Состав продуктов будет точно таким же, как и в случае окисления перманганатом, за исключением того, что вместо сульфата марганца (II) образуется сульфат хрома (III). Запишем схему реакции и составим электронный баланс.
Перенесем коэффициенты из баланса в схему:
Далее уравняем калий, поставив коэффициент 5 перед сульфатом калия:
В правой части мы видим 20 сульфатных групп. Следовательно, перед формулой серной кислоты нужно поставить коэффициент 20:
Осталось поставить последний коэффициент перед формулой воды. Сделаем это, как и в двух предыдущих случаях, по кислороду, не считая кислород в сульфатных группах, поскольку их количества уравнены. В левой части мы видим 35 атомов кислорода. В правой части, не считая воды, 12 атомов кислорода (6 в трех молекулах CH3COOH и 6 в трех молекулах CO2). Таким образом, перед формулой воды нужно поставить коэффициент 23:
Посчитав водород слева и справа, мы убеждаемся, что коэффициенты расставлены верно.
2-метилпропен + K2Cr2O7 + H2SO4
Запишем схему реакции и электронный баланс:
Перенесем коэффициенты из баланса в схему:
Перед сульфатом калия поставим коэффициент 4, чтобы уравнять количества атомов калия в левой и правой частях схемы:
Перед серной кислотой поставим коэффициент 16, чтобы уравнять количество сульфатных групп:
Последний коэффициент перед водой поставим по кислороду, игнорируя сульфатные группы, поскольку их количество уравнено. Слева мы видим 28 атомов кислорода. Справа, не считая воды, 9 атомов кислорода. Таким образом, перед водой необходимо поставить коэффициент 19.
Далее, подсчитав водород в обеих частях уравнения, убеждаемся, что коэффициенты расставлены верно.
Видео:ОКИСЛЕНИЕ АЛКЕНОВ ЕГЭ / жёсткое, мягкое окисление в органике с KMnO4Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать  РАССТАНОВКА КОЭФФИЦИЕНТОВ В УРАВНЕНИЯХ РЕАКЦИЙ ОКИСЛЕНИЯ АЛКЕНОВ ПЕРМАНГАНАТОМ КАЛИЯ, ПРОТЕКАЮЩИХ В КИСЛОЙ СРЕДЕ С РАЗРЫВОМ УГЛЕРОДНОЙ ЦЕПИ |
| Вложение | Размер |
|---|---|
| В статье подробно описано, как расставить коэффициенты в уравнениях реакций окисления алкенов перманганатом калия в кислой среде | 284.46 КБ |
Предварительный просмотр:
Чтобы пользоваться предварительным просмотром создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Видео:Алкены.Окисление алкенов с KMnO4 и K2Cr2O7. Все 14 реакций ЕГЭ.Скачать

По теме: методические разработки, презентации и конспекты
Мастер-класс по химии «Расстановка коэффициентов в химических уравнениях»
Данный мастер класс был представлен мной в рамках городского конкурса «Педагог года 2009», на котором в результате я заняла 1 место.
Алгоритм расстановки коэффициентов в химическом уравнении.
Может быть использована как раздаточный материал.
Расстановка коэффициентов в химических уравнениях
Преподаватель, являясь главным действующим лицом в организации познавательной деятельности учащихся, постоянно находится в поиске путей повышения эффективности обучения. Организация эффективного обуче.
урок по химии 8 класс: «Решение расчетных задач по уравнениям реакций протекающих в растворах»
урок по химии для 8 класса разработан на основе программы И.И. Новошинского.
Алгоритм расстановки коэффициентов в химических уравнениях
Алгоритм расстановки коэффициентов в химических уравнениях.
Пров. работа «Расстановка коэффициентов, типы реакций» 8кл.
Раздаточный материал для проверочной работы-пятиминутки (4варианта). К сожалению, при загрузке полностью изменился вид (на А4 помещены 3 карточки, каждая с 4 вариантами А,Б,В,Г).
мастер класс по химии «Расстановка коэффициентов в уравнениях на занимательных опытах»
Химия интересная и увлекательная ! Занимательные опыты повышают интерес к изучаемым предметам и заставляют задуматься над необьяснимыми фактами.
🔥 Видео
окисление алкенов в кислой средеСкачать

Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

Все органические ОВР: жесткое окисления за 2 часа | Химия ЕГЭ 2023 | УмскулСкачать

ЕГЭ ХИМИЯ/Окисление пропена в жестких условиях/органикаСкачать

Окислительно-восстановительные реакции на примере алкенов (ОВР). ЕГЭ по химииСкачать

Жесткое окисление алкенов в кислой средеСкачать

Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

ОВР 5 занятие Окисление алкеновСкачать

Задание 29 ОВР: перманганат калия в разных средах - видимые признаки реакций | Химия ЕГЭ | УМСКУЛСкачать



 углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей