Одним из важнейших соединений азота является аммиак. По физическим свойствам это — бесцветный газ с резким, удушающим запахом (это запах водного раствора гидроксида аммония NH₃·H₂O). Газ хорошо растворяется в воде. В водном растворе аммоний является слабым основанием. Является одним из важнейших продуктов химической промышленности.
NH₃ — хороший редуктор, как в молекуле аммония, азот имеет самую низкую степень окисления -3. Многие характеристики аммиака определяются парой одиночных электронов в атоме азота – реакции присоединения с аммиаком происходят из-за его присутствия (эта пара одиночек расположена на свободной орбите Протона H⁺).
Видео:Аммиак: как образуется и с чем реагирует? #аммиак #химия #видеоурок #егэхимияСкачать

Как получить аммиак

Существуют два основных практических метода получения аммиака: один в лаборатории, другой — в промышленности.
Рассмотрим получение аммиака в промышленности. Взаимодействие молекулярного азота и водорода: N₂ + 2H₂ = 2NH₃ (обратимая реакция). Этот метод получения аммиака называется реакцией Хабера. Для молекулярного азота и водорода, которые должны прореагировать, их необходимо нагреть к 500 ᵒC или 932 ᵒF, давлению MPA 25-30 необходимо создаться. Пористый утюг должен присутствовать как катализатор.
Получение в лаборатории – это реакция между хлоридом аммония и гидроксидом кальция: СА(OH)₂ + 2NH₄Cl = CaCl₂ + 2NH₄OH (как NH₄OH — очень слабое соединение, оно сразу же распадается на газообразный аммиак и воду: NH₄OH = NH₃ + H₂O).
Видео:Лекция 31 «Быстрые гетерогенно каталитические реакции»Скачать

Реакция окисления аммиака
Они протекают с изменением состояния окисления азота. Так как аммиак — хороший редуктор, его можно использовать для уменьшения тяжелых металлов от их окисей.
Уменьшение металлов: 2NH₃ + 3CuO = 3Cu + N₂ + 3H₂O (когда меди (II) оксид нагревают в присутствии аммиака, металлическая медь красного цвета уменьшается).
Окисление аммиака в присутствии сильных окислителей (например, галогенов) происходит по уравнению: 2NH₃ + 3Cl₂ = N₂ + 6HCl (для проведения этой окислительно-восстановительной реакции требуется нагрев). При воздействии перманганата калия на аммиак в щелочной среде наблюдается образование молекулярного азота, марганцовокислого калия и воды: 2NH₃ + 6KMnO₄+ 6KOH = 6K₂MnO₄+ N₂ + 6H₂O.
При интенсивном нагревании (до 1200 ° C или 2192 ᵒF) аммиак может распадаться на простые вещества: 2NH₃ = N₂ + 3H₂. На 1000 oC или 1832 аммиак реагирует с метаном CH4:2CH₄ + 2NH₃ + 3O₂ = 2HCN + 6H₂O (синильной кислоты и воды). Путем оксидации аммиака с гипохлоритом натрия гидразин Н₂Х₄ можно получить: 2NH + NaOCl = N2H4 + NaCl + H2O
Видео:Гетерогенный катализ. Каталитическое окисление аммиакаСкачать

Сжигание аммиака и его каталитическое окисление кислородом
Окисление аммиака кислородом имеет определенные особенности. Существует два различных типа окисления: каталитический (с катализатором), быстрый (горение).
При горении происходит окислительно-восстановительная реакция, продуктами которой являются молекулярный азот и вода: 4NH3 + 2O2 = 2N2 + 6H2O (пламя желто-зеленое, горение начинается при 651 или 103,8 градусов по Фаренгейту, так как это температура самовоспламенения аммиака). Каталитическое окисление кислорода также происходит при нагревании (около 800 ᵒC или 1472 ᵒF), но один из продуктов реакции отличается: 4NH₃ + 5O₂ = 4NO + 6H₂O (в присутствии платины или оксидов железа, марганца, хрома или кобальта в качестве катализатора продуктами окисления являются оксид азота (II) и вода).
Рассмотрим однородное окисление аммиака кислородом. Бесконтрольная однотипная оксидация участка газа аммиака — относительно медленная реакция. О ней не сообщается подробно, но нижний предел воспламеняемости аммиачно-воздушных смесей при 25 оС составляет около 15 % в интервале давлений 1-10 бар и уменьшается по мере повышения начальной температуры газовой смеси.
— это молевая доля NH3 в смеси воздух-аммиак с температурой tmixed (OC), то из данных CNH = 0.15-0 следует, что предел воспламеняемости низкий. Поэтому разумно работать с достаточным запасом прочности ниже нижнего предела воспламеняемости, как правило, данные о смешивании аммиака с воздухом часто далеки от совершенства.
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Химические свойства
Рассмотрим контактное окисление аммиака до оксида азота. Типичные химические реакции с аммиаком без изменения степени окисления азота:
- Реакция с водой: NH₃ + H₂O = NH₄OH = NH₄⁺ + он⁻ (реакция обратима, так как гидроксид аммония NH₄OH — это нестойкое соединение).
- Реакция с кислотами с образованием нормальных и кислых солей: NH₃ + HCl = NH₄Cl (нормальный хлорид аммония соли сформирован);NH₃ + H₂SO₄ = NH₄HSO₄ (в реакции аммиака с холодной концентрированной серной кислотой образуется кислотная соль гидросульфат аммония); 2NH₃ + H₂SO₄ = (NH₄)₂SO₄.
- Реакции с солями тяжелых металлов с образованием комплексов: 2NH₃ + AgCl = [Ag(NH₃)₂]Cl (сложные соединения серебра (I) хлоридные формы диамина).
- Реакция с haloalkanes: NH3 + CH3Cl = [CH3NH3]Cl (формы гидрохлорида метиламмония – это замещенный ион аммония NH4=).
- Реакция со щелочными металлами: 2NH₃ + 2K = 2KNH₂ + H₂ (образуется амид калия KNH₂; азот не изменяет состояние окисления, хотя реакция окислительно-восстановительная). Реакции присоединения происходят в большинстве случаев без изменения состояния окисления (все вышеперечисленные, кроме последней, классифицируются данным типом).
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Заключение
Аммиак — популярное вещество, которое активно используется в промышленности. На сегодняшний день она занимает особое место в нашей жизни, так как большинство продуктов ее деятельности мы используем каждый день. Эта статья будет полезна для прочтения многим, кто захочет узнать о том, что нас окружает.
Видео:Горение аммиака в кислородеСкачать

Катализаторы процесса окисления аммиака
В отсутствие катализатора наиболее быстро протекает реакция (3.3) –окисление аммиака до свободного азота.
Для ускорения реакции (3.1) – окисление аммиака до NO – необходим катализатор. Поскольку при окислении аммиака протекают три реакции (3.1; 3.2; 3.3), а целевой является реакция (3.1), то важнейшим условием является выбор катализатора, отличающегося высокой селективностью.
Катализаторы, избирательно ускоряющие реакцию (3.1) можно разделить на два вида:
- платина и её сплавы с металлами платиновой группы (родием и палладием).
- оксиды железа, никеля и кобальта.
В азотнокислотной промышленности применяют в основном платиновые катализаторы. Окисление аммиака на платиновом катализаторе относится к числу наиболее быстрых каталитических реакций. В производственных условиях практически полное окисление аммиака в NO достигается за время (1–2)·10 –4 секунды (0,0001 – 0,0002 с).
Время контактирования. Можно и нужно ли изменять время пребывания реагентов на контактной массе? Время изменять нецелесообразно, так как при уменьшении длительности контакта часть аммиака «проскакивает», не успевая окислиться, а при увеличении времени контактирования реакционная смесь перегревается, возрастает вклад реакции (3.3) с образованием свободного азота.
В промышленности для окисления аммиака применяют из первой группы платиновые катализаторы. Это сплав платины Pt с палладием Pd (4 %) и родием Rh (3%). (Введение до 7,5% родия Rh повышает механическую прочность катализатора и вследствие этого уменьшаются потери платины за счёт уноса газом).
Платиновые катализаторы выполняются в виде сеток из тонкой проволоки диаметром 0,06 – 0,09 мм, имеющих 1024 отверстий в 1см 2 . Сетки скрепляются в виде пакета, устанавливаемого в контактном аппарате.
На 1м 2 активной поверхности контактной сетки под атмосферным давлением (0,1 МПа) можно окислить до 600 кг аммиака, а при давлении 0,8 МПа – до 3000 кг аммиака в сутки.
Однако при работе под давлением 0,8 МПа и более платиновый катализатор разрушается быстрее.
Разрушению катализатора способствуют также многие контактные яды (соединения серы, фосфин и другие), которые помимо отравления катализатора снижают его механическую прочность. Примеси (пыль, ржавчина, смазочные масла), содержащиеся в газе, также снижают активность и прочность катализатора.
Для восстановления катализатора его промывают разбавленным раствором соляной кислоты.
Всё перечисленное приводит к тому, что в процессе окисления аммиака катализатор становится рыхлым, и мельчайшие частицы его уносятся с потоком газа. Если под атмосферным давлением унос платины на 1т азотной кислоты составляет 0,04 – 0,06 г, то при повышенном он достигает уже 0,15 – 0,20 г на 1т.
Часть платины улавливается и регенерируется, НО и при этом расход платины составляет значительную часть себестоимости азотной кислоты.
С целью экономии платины в промышленности применяют двухстадийное контактирование, при котором аммиак частично окисляется на платиноидных сетках, а затем доокисляется в слое неплатинового зернистого катализатора.
В качестве неплатиновых катализаторов применяют различные композиции оксидов или солей, в том числе оксиды железа или хрома, соли хрома.
Удельная производительность платинового катализатора велика благодаря высокой скорости реакции окисления аммиака. Для платинового катализатора скорость всего процесса окисления определяется диффузионными процессами.
В промышленности применяют разные типы контактных аппаратов для окисления аммиака, но все они имеют одинаковый принцип действия.
При повышенном давлении устанавливают до 18 сеток. Но если применять двухстадийное контактирование число платиноидных сеток может быть уменьшено до 1 – 3.
Механизм действия катализатора.
Механизм гетерогенного окисления аммиака состоит из следующих последовательных стадий:
- диффузия молекул NH3 и O2 из газовой фазы к поверхности катализатора;
- активированная адсорбция молекулO2 на поверхности катализатора с образованием промежуточного соединения;
- хемосорбция молекул NH3 с образованием комплекса;
- разложение комплекса с регенерацией катализатора и образованием молекул NO и H2O (или десорбция продуктов реакции);
- диффузия продуктов реакции с поверхности катализатора в газовую фазу.
Определяющей или лимитирующей стадией всего процесса окисления является диффузия O2 к поверхности катализатора. Следовательно, каталитическое окисление аммиака на платиновом катализаторе протекает преимущественно в диффузной области.
Окисление аммиака на оксидном железном катализаторе идет кинетической области.
Селективность процесса окисления NH3 до NO в присутствии платиновых катализаторов выражается уравнением:
Видео:Волшебство окисления аммиака в присутствии катализатора💥 #shorts #chemical #химияСкачать

ТЕХНОЛОГИЯ АЗОТНОЙ КИСЛОТЫ
Чистая азотная кислота HNO3 при нормальной температуре — бесцветная жидкость, замерзающая при —41°С, кипящая при 86°С. Максимальную температуру кипения 121,9°С имеет раствор, содержащий 68,4% HNO3, представляющий собой азеотропную смесь. Азотная кислота очень сильный окислитель. Многие органические вещества (в том числе животные и растительные ткани) при действии азотной кислоты разрушаются, а некоторые способны воспламеняться. Концентрированная кислота пассивирует такие металлы, как железо, на этом и основано использование стали как конструкционного материала в производстве азотной кислоты. Отечественная промышленность выпускает азотную кислоту двух видов: разбавленную с содержанием 50—60% HNO3 и концентрированную, содержащую 96—98% HNO3. Разбавленная кислота используется в основном для производства азотосодержащих минеральных удобрений. Крепкая азотная кислота потребляется для производства взрывчатых веществ, красителей, пластических масс, нитролаков, кинопленки и других важнейших продуктов. Азотную кислоту производят из аммиака.
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА
Производство разбавленной азотной кислоты из аммиака складывается из следующих стадий:
1) контактное окисление аммиака до оксида азота (II):
4NH3 + 5О2 ® 4NO + 6Н2О, ΔН = – 907 кДж (а)
2) окисление NО до NO2:
3) абсорбция диоксида азота водой с образованием разбавленной азотной кислоты:
Выделяющийся при этом оксид азота (II) окисляется до диоксида
И снова абсорбируется.
Контактное окисление аммиака.При окислении аммиака кроме
основной реакции (а) могут протекать и другие процессы, которые приводят к непроизводительному расходованию аммиака:
4NH3 + 4O2 ® 2N2O + 6H2O ΔН = –1105 кДж (г)
Равновесие реакций окисления аммиака (а), (г), (д) в условиях производства полностью смещено вправо. Следовательно, превращение аммиака в конечные продукты при 750 °С может достигать почти 100%. Общая скорость процесса определяется соотношением скоростей реакций (а) — (е). В отсутствие катализатора наиболее быстрой является реакция окисления до элементного азота. Поэтому, в азотнокислотном производстве процесс окисления производят на катализаторах, обладающих избирательностью действия, т. е. на таких катализаторах, которые резко ускоряют реакцию получения NО по сравнению с прочими реакциями окисления аммиака.
В азотнокислотной промышленности в основном применяют платиновые катализаторы. Процесс окисления аммиака на платиновом катализаторе относится к числу наиболее быстрых каталитических реакций, известных в настоящее время. В производственных условиях практически полное окисление аммиака достигается за 10 –4 с.
Скорость каталитического окисления аммиака.Скорость процесса окисления зависит от технологического режима процесса и конструкции контактного аппарата. На высокоактивных платиноидных катализаторах процесс протекает в диффузионной области. На менее активных (оксидных) катализаторах при пониженных температурах окисление аммиака определяется скоростью каталитических актов, т. е. протекает в кинетической области.
Повышение температуры способствует увеличению не только скорости химической реакции, но и коэффициента диффузии аммиака в смеси. Поэтому повышение температуры — эффективное средство увеличения скорости процесса окисления, протекающего как в кинетической, так и в диффузионной области. Однако повышение температуры катализа выше
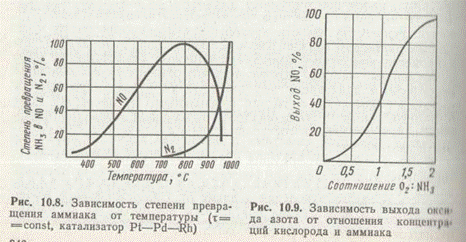
850°С снижает выход NО и повышает выход элементного азота (рис. 1) за счет реакции (д), а также термической диссоциации NH3 и других вредных побочных реакций.
Повышение давления ускоряет процесс окисления NH3, так как увеличиваются концентрации реагирующих компонентов в реакционном объеме, уменьшается объем газовой смеси.
Однако при повышенном давлении существенно возрастает унос мельчайших частичек платины с газами, что удорожает товарную кислоту, поскольку платина имеет высокую стоимость, а процесс улавливания микроскопических частичек платины из нитрозных газов после контактного аппарата весьма сложен и не обеспечивает полного устранения потерь платины. При повышении давления необходимо увеличивать толщину стенок аппаратуры, в результате чего возрастает ее стоимость. Поэтому применяют избыточное давление 0,2—1 МПа.
Состав газовой смеси влияет на температурный режим и общую скорость процесса, особенно если лимитирует не диффузия, а химическая реакция между NH3 и О2. По уравнению реакции (а) на 1 моль NH3 расходуется 1,25 моль О2, однако при таком соотношении компонентов выход оксида азота (II) не превышает 65%, т. е. очень мал (рис. 2). Для увеличения степени окисления аммиака на практике применяют соотношение O2:NH3=1,8—2,0, что соответствует содержанию аммиака в аммиачновоздушной смеси 9,5—10,5 (об. доли в %). Следует учитывать, что при обычной температуре смесь аммиака с воздухом взрывоопасна в интервале 16—27% NH3. При повышении температуры границы взрывоопасности расширяются.
Промышленные катализаторы процесса окисления аммиака.
Эти катализаторы представляют собой сплав платины с 4% Pd и 3% Rh. Платиноидные катализаторы выполняют в виде сеток из тонкой проволоки диаметром 0,06—0,09 мм, имеющих 1024 отверстия в 1 см 2 . Сетки эти для создания определенного времени контактирования скрепляются в виде пакета, устанавливаемого в контактном аппарате.
На 1 м 2 активной поверхности контактной сетки под атмосферным давлением можно окислить до 600 кг, а при давлении 0,8 МПа — до 3000 кг аммиака в сутки. Однако при работе под давлением 0,8 МПа и более платиновый катализатор разрушается быстрее.
Разрушению катализатора способствуют и многие контактные яды (соединения серы, фосфин и др.), которые помимо отравления катализатора снижают его механическую прочность. Примеси (пыль, ржавчина, смазочное масло и т. п.), содержащиеся в газе, также снижают активность и прочность катализатора. Для восстановления активности катализатора его промывают разбавленным раствором соляной кислоты. Все это приводит к тому, что в процессе окисления аммиака катализатор становится рыхлым и мельчайшие частицы его уносятся с потоком газа. Если под атмосферным давлением унос платины на 1 т азотной кислоты составляет 0,04—0,06 г, то при повышенном он достигает уже 0,15—0,20. Часть Pt улавливается и регенерируется, но и при этом расходы платины составляют значительную часть себестоимости азотной кислоты.
С целью экономии платины применяют двухстадийное контактирование, при котором аммиак частично окисляется на платиноидных сетках, а затем доокисляется в слое неплатинового зернистого катализатора. В качестве неплатиновых катализаторов применяют различные композиции оксидов или солей, в том числе оксиды железа или хрома, соли кобальта. Удельная производительность платинового катализатора велика благодаря высокой скорости реакции окисления.
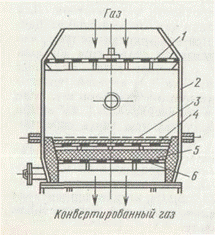
В промышленности применяется несколько типов контактных аппаратов для окисления аммиака. Однако все они имеют приблизительно одинаковый принцип действия.
При повышенном давлении устанавливают до 18 сеток. При двухстадийном контактировании (рис. 3) число платиноидных сеток может быть снижено до 1—3 (при повышенном давлении).
Окисление оксида азота (II) до диоксида. Нитрозные газы, полученные при окислении аммиака, содержат NО и другие оксиды азота, кислород, азот и пары воды. Для получения азотной кислоты оксид азота (II) необходимо окислить до диоксида.
Процесс окисления NО кислородом воздуха описывают следующим суммарным (балансовым) уравнением:
2NO+ О2 D 2NO2, ΔН = –112 кДж (ж)
В соответствии с принципом Ле Шателье равновесие этого процесса сдвигается вправо при повышении давления и снижении температуры. Практически образование диоксида азота начинается при температуре ниже 700°С, а при температуре ниже 100°С равновесие почти полностью сдвинуто вправо.
Константа скорости процесса увеличивается с понижением температуры, что иногда рассматривают как нарушение закона Аррениуса. В действительности это явление можно объяснить тем, что процесс по формуле (ж) протекает в две стадии. Сначала происходит быстрая обратимая экзотермическая реакция димеризации оксида азота
а затем окисление димера по экзотермической практически необратимой (при t o C) реакции
При повышении температуры равновесие реакции (з) смещается влево, концентрация димера N2O2 сильно снижается. Соответственно снижается и скорость реакции (и).
В результате уменьшается и общая скорость процесса. Поэтому для увеличения скорости превращения NO в NO2 реакционную смесь энергично охлаждают. Повышение давления способствует сдвигу равновесия по реакции (з) в сторону димера и увеличению скорости реакции (и). Повышается и степень абсорбции диоксида азота. Поэтому в последние годы в производстве азотной кислоты перешли от установок под атмосферным давлением к повышенному давлению до 1 МПа.
При окислении оксида азота может протекать реакция ассоциации NO2 с образованием димера:
Скорость этой реакции очень велика, а равновесие с повышением давления и уменьшением температуры сдвигается в правую сторону.
Таким образом, в нитрозных газах, поступающих на абсорбцию, содержатся NO2, N2O4, O2, N2O, NO, N2O2, N2, пары воды и др.
Абсорбция диоксида азота и его димера протекает по схемам:
Получающаяся при этом азотистая кислота неустойчива и разлагается:
поэтому суммарно взаимодействие NO2 с водой можно представить уравнением:
В производстве необходимо получать кислоту возможно большей концентрации. При этом увеличивается давление пара оксида азота над раствором кислоты, что снижает движущую силу процесса и, следовательно, общую скорость процесса. Для сдвига равновесия в сторону образования HNO3 необходимо снижать температуру, а также повышать давление. При абсорбции оксидов азота используют принцип противотока, т. е. наиболее концентрированный газ встречается с концентрированной кислотой, а в конце абсорбции остатки NO2 поглощаются наиболее слабой кислотой.
Вследствие экзотермичности процесса абсорбции температура вытекающей продукционной кислоты обычно составляет не менее 50°С, поэтому в установках, работающих под атмосферным давлением, получается кислота, содержащая лишь около 50% HNO3. В установках, работающих под давлением 0,6—0,8 МПа, можно получить 58—60%-ную кислоту. Поднимая давление до 5 МПа, в установках прямого синтеза HNO3 из оксидов азота и кислорода получают кислоту концентрацией 98% HNO3.
ПРОИЗВОДСТВО АЗОТНОЙ КИСЛОТЫ
Для получения разбавленной азотной кислоты из аммиака в промышленности до недавнего времени использовали три системы: 1) под атмосферным давлением; 2) под повышенным давлением и 3) комбинированные, в которых окисление аммиака происходит под атмосферным давлением, а окисление оксида азота и абсорбция NO2 водой — под повышенным.
Несмотря на меньшие расходы платины, системы производства кислоты под атмосферным давлением в настоящее время не применяются из-за малой производительности, громоздкости аппаратуры и соответственно больших капитальных вложений, существенных потерь аммиака и необходимости применения дорогостоящей и не слишком эффективной щелочной очистки отходящих газов от оксидов азота.
Современные установки, работающие под повышенным давлением (от 0,2 до 1 МПа), и комбинированные разработаны по принципу энерготехнологических систем, в которых энергия отходящих газов (связанная с их высокой температурой и давлением) и теплота реакции окисления аммиака используются для сжатия воздуха и нитрозных газов, а также получения технологического пара. Этими же схемами предусмотрено возможно более полное использование низкопотенциальной теплоты.
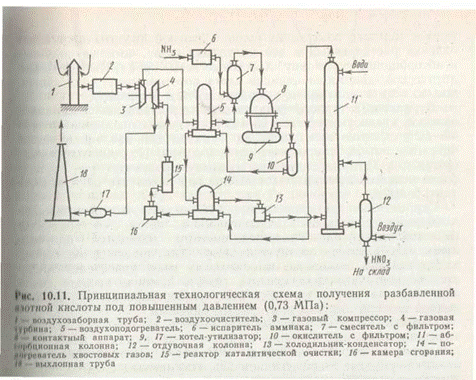
Принципиальная технологическая схема получения разбавленной азотной кислоты под повышенным давлением приведена на рис. 4.
Атмосферный воздух после соответствующей очистки поступает в компрессор 3, приводимый в движение газовой турбиной 4. В компрессоре воздух сжимается до давления 0,73 МПа, нагреваясь при этом до 135°С, и поступает далее в подогреватели воздуха 5, где его температура поднимается до 250°С за счет теплоты выходящих из окислителя 10 нитрозных газов. В смесителе 7 воздух смешивается с газообразным аммиаком, который поступает сюда из испарителя аммиака 6. Образовавшаяся аммиачновоздушная смесь далее поступает в контактный аппарат 8, где при температуре около 900°С на Pt—Rh—Pd-катализаторе происходит окисление аммиака. Нитрозные газы, содержащие 9,0—9,5% NO, поступают в котел-утилизатор 9, в котором происходит охлаждение до необходимой температуры и образование пара. Далее газы поступают в окислитель 10, в котором окисляются до диоксида азота. Охлажденные в подогревателе воздуха 5, подогревателе хвостовых газов 13 и холодильнике-конденсаторе 12 до температуры около 45°С нитрозные газы поступают в абсорбционную колонну 11, орошаемую противоточно водой. Поскольку абсорбция NO2 водой экзотермична, абсорбционные тарелки снабжены змеевиковыми холодильниками, в которых циркулирует охлаждающая вода (на схеме не показано). Полученная азотная кислота самотеком поступает в отдувочную колонну 12, где с помощью горячего воздуха из готовой азотной кислоты происходит отдувка растворенных в ней нитрозных газов, которые подаются в абсорбционную колонну. Хвостовые газы, пройдя систему каталитической очистки от оксидов азота восстановлением их аммиаком до элементного азота, выбрасываются в атмосферу.
В установках такого типа степень превращения аммиака в азотную кислоту достигает 98—99%, а концентрация кислоты — 60—62%. Однако при окислении аммиака под давлением увеличиваются потери платинового катализатора. Поэтому применяют системы, в которых окисление аммиака производят при гораздо более низком давлении (
0,4 МПа), чем окисление оксида азота (до 1,2 МПа).
Современные азотнокислотные ХТС характеризуются большой мощностью отдельной технологической нитки, составляющей 380—400 тыс. т/год. Указанные системы позволяют получить лишь разбавленную азотную кислоту. Для производства взрывчатых веществ, некоторых пластических масс, красителей требуется концентрированная кислота (98%). Азотную кислоту такой концентрации можно получить либо концентрированием разбавленной азотной кислоты или прямым синтезом.
Отгонкой воды из разбавленной азотной кислоты можно получить лишь 68%-ный раствор, поскольку именно такая концентрация отвечает азеотропной смеси HNO3—Н2О. Поэтому концентрирование проводят с применением водоотнимающих средств, таких, например, как 92—94%-ная H2SO4. Концентрированная серная кислота, образующая при этом гидраты, кипит при более высокой температуре, чем 100%-ная HNO3. В качестве водоотнимающего средства может использоваться также нитрат магния.
В настоящее время значительное применение находит прямой синтез концентрированной азотной кислоты, который протекает по уравнению реакции:
В действительности поглощение димера диоксида осуществляется разбавленной азотной кислотой, содержащей около 45% воды, Эта операция осуществляется в автоклаве при 90°С и 5 МПа. В автоклаве получается так называемый нитроолеум HNO3×nNO2, содержащий до 25% NO2. После отдувки диоксида азота и получается 97—98%-ная азотная кислота.
| | | следующая лекция ==> | |
| МЕТОДЫ ФИКСАЦИИ АТМОСФЕРНОГО АЗОТА | | | Производство серной кислоты |
Дата добавления: 2016-01-20 ; просмотров: 4198 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
📹 Видео
Окисление этанола на медном катализатореСкачать

Катализаторы. Ингибиторы.Скачать

12.3. Амины: Химические свойства. ЕГЭ по химииСкачать

Влияние катализаторов на скорость химических реакцийСкачать

Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать

ОГЭ/химические свойства аммиака/химия-9Скачать

Аммиак за 13 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Лекция 8 (вторая часть)Скачать

Аммиак и соли аммония. 11 класс.Скачать

Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

9 класс § 30 "Аммиак. Соли аммония".Скачать

253) Каталитические реакции, катализатор (материаловедение)Скачать

Влияние катализатора на скорость реакцийСкачать