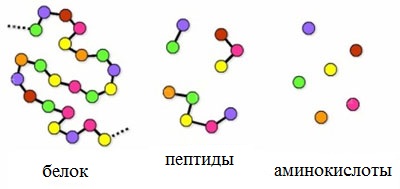
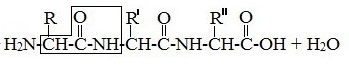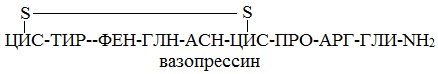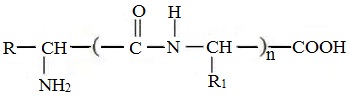Пептиды – семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединенных в цепь пептидными (амидными) связями —С(О)NН- .
Пептиды можно рассматривать как продукты конденсации двух или более молекул аминокислот.
Число пептидов, которые могут быть построены из 20 природных аминокислот, огромно.
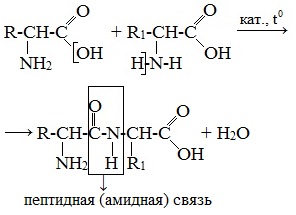
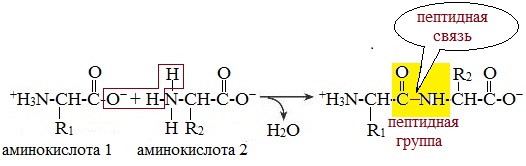
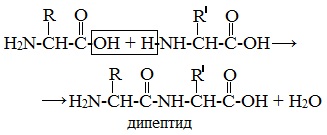
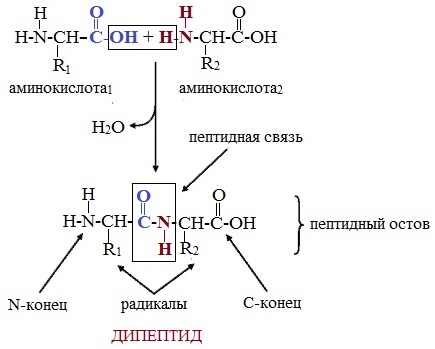
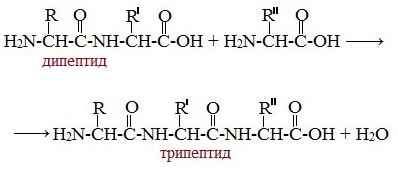
Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью –СО-NH- .
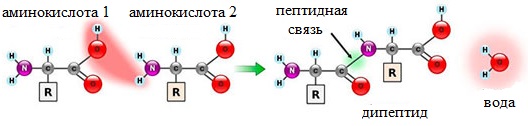
Образование дипептидов
Две аминокислоты образуют дипептид:
Образование трипептидов
Молекула дипептида, подобно аминокислотам, содержит аминогруппу и карбоксильную группу и может реагировать еще с одной молекулой аминокислоты:
Полученное соединение называется трипептидом.
Процесс наращивания пептидной цепи может продолжаться неограниченно и приводит к веществам с очень высокой молекулярной массой (белкам).
Формулы пептидов обычно записываются так, что свободная аминогруппа находится слева, а свободная карбоксильная группа – справа. Основная часть пептидной цепи построена из повторяющихся участков –СН-СО-NН- и боковых групп R, R’ и т.д.
Структуру пептидов, содержащих большое число остатков аминокислот, записывают в сокращенном виде с использованием обозначений.
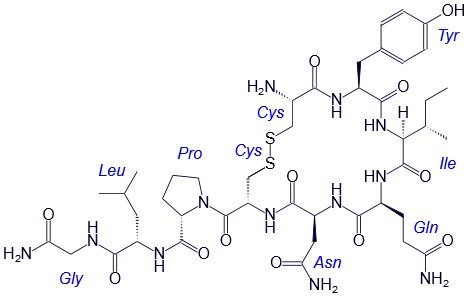
Например, строение молекулы вазопрессина – пептида, построенного из 9 аминокислотных остатков, можно изобразить следующим образом:
Структурная формула вазопрессина
Эту же структуру можно изобразить в сокращенном виде с использованием трехбуквенных и однобуквенных обозначений аминокислот:
В этом пептиде остатки цистеина связаны дисульфидными мостиками. Правый конец цепи содержит амидную группу –СО-NН2 вместо карбоксильной.
Номенклатура
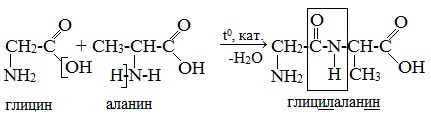
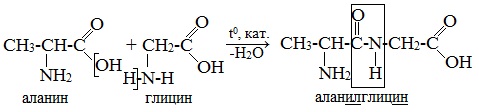
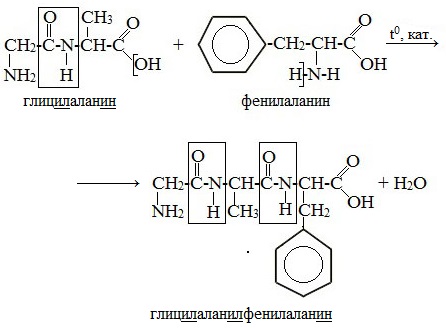
При составлении названия дипептида сначала называют аминокислоту, у которой в образовании дипептида участвует группа –СООН. В тривиальном названии этой кислоты последняя буква «н» заменяется буквой «л». Затем прибавляют без изменений тривиальное название аминокислоты, у которой в образовании дипептида участвует группа –NH2.
Любой дипептид имеет свободные амино- и карбоксильную группы и поэтому может взаимодействовать еще с одной молекулой аминокислоты, образуя трипептид. Таким же путем получают тетрапептиды и т.д.
Биологическое значение
Многие пептиды проявляют биологическую активность. Простейший из них – трипептид глутатион, который относится к классу гормонов – веществ, регулирующих процессы жизнедеятельности. Этот гормон построен из остатков глицина, цистеина и глутаминовой кислоты.
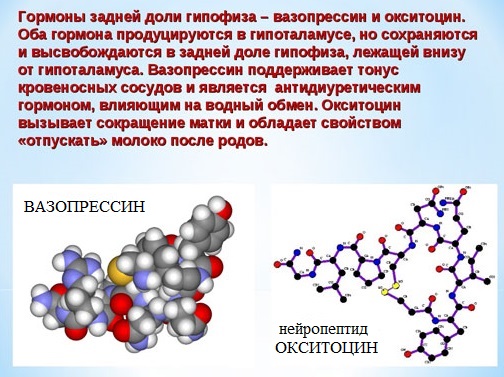
Некоторые пептиды (окситоцин, вазопрессин, инсулин) имеют огромное биологическое значение, являются важными гормонами.
Вазапрессин и окситоцин содержат 9 аминокислотных остатков.
Вазопрессин вырабатывается гипофизом и стимулирует сокращение кровеносных сосудов, повышает кровяное давление, а окситоцин стимулирует выделение молока молочными железами.
Инсулин – биологически важный пептид, который построен из двух цепей, состоящих из 21 и 30 α-аминокислотных остатков, которые связаны между собой дисульфидными мостиками. Вырабатывается поджелудочной железой и снижает содержание сахара в крови.
Химические свойства
Основное свойство пептидов – способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи и образуются более короткие пептиды с меньшей молекулярной массой или α-аминокислоты, составляющие цепь.
Анализ продуктов полного гидролиза позволяет установить аминокислотный состав пептида. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой.
Последовательность аминокислот в цепи может быть установлена путем частичного гидролиза пептида. Для этого необходимо последовательно, одну за другой, отщеплять аминокислоты от одного из концов цепи и устанавливать их структуру.
Гидролиз пептидов может происходить в кислой или щелочной среде, а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот.
Ферментативный гидролиз важен тем, что протекает селективно, т.е. позволяет расщеплять строго определенный участки пептидной цепи. Селективный гидролиз может протекать и под действием неорганических реагентов. Так, бромистый циан (BrCN) расщепляет полипептидную цепь только по пептидной связи, образованной карбоксильной группой метионина.
Видео:Трипептиды как составлять (РязГМУ 2 семестр последний коллок)Скачать

пожалуйста составьте трипиптид из Серина Цистеина и Лизина и как он будет называться?
пожалуйста составьте трипиптид из Серина (CH2-OH) Цистеина (CH2-SH) и Лизина (CH2)4-NH2 и как он будет называться?
из того что в скобках
Что то похожее должно получиться )
Вам из аминокислот, или из того, что в скобках написано?
У вас же прекрасный образец — и составления трипептида, и называния его!
Формулы я здесь не смогу нарисовать, а название трипептида — пожалуйста:
серил-цистеинил-лизин (Сер-Цис-Лиз) . Это для варианта, когда N-концевой аминокислотой будет серин, а С-концевой — лизин
Видео:Пептидная связь. 11 класс.Скачать

Открывает пептидную связь в белке
Тема: Аминокислоты, пептиды, белки.
Вопросы для рассмотрения:
1. Аминокислоты, входящие в состав белков. Строение, номенклатура. Стереоизомерия. Кислотно-основные свойства, биполярная структура. Классификация с учетом различных признаков: по химической природе радикала и содержащихся в нем заместителей (алифатические, ароматические, гетероциклические, содержащие гидроксильную, карбонильную или амидную группу, серусодержащие), по полярности радикалов, по кислотно-основным свойствам, биологическая классификация.
2. Химические свойства α -аминокислот. Образование внутрикомплексных солей. Реакции этерификации, ацилирования, алкилирования, образования иминов, амидов: аспарагина, глутамина (АСН, ГЛН). Взаимодействие с азотистой кислотой и формальдегидом, значение этих реакций для анализа аминокислот.
3. Биологически важные реакции, протекающие в нашем организме.
I.по α-NH2 группе: а) трансаминирование; б) дезаминирование
II. по α-СООН группе декарбоксилирование (образование биогенных аминов);
III. специфические превращения аминокислот (на примере метионина);
4. Понятие о трансаминировании, строение кофактора ПАЛФ и роль витамина В6 в этом процессе). Механизм трансаминирования. Схема реакции на примере АЛТ и АСТ. Биологическая роль процесса трансаминирования.
5. Понятие о дезаминировании. Типы дезаминирования: окислительное, гидролитическое, внутримолекулярное, восстановительное (на примерах ГЛУ, СЕР, ГИС, АЛА). Биологическая роль.
6. Восстановительное аминирование на примере α-кетоглутаровой кислоты
7. Превращение по α-СООН группе — декарбоксилирование α -аминокислот, образование биогенных аминов (коламина, гистамина, триптамина, серотонина, кадаверина, дофамина, ГАМК). Биологическая роль.
8. Понятие о пептидах и белках. Электронное и пространственное строение пептидной (амидной) связи. Кислотный, щелочной и ферментативный гидролиз белков. Установление аминокислотного состава белков с помощью современных физико-химических методов.
9. Понятие о первичной, структуре белка.
10. Понятие о вторичной структуре белка, α — спираль и β — складчатая структура, связи, формирующие вторичную структуру.
11.Понятие о третичной, нативной конформации белка (глобулярные и фибриллярные белки), связи, формирующие третичную структуру.
12. Понятие о четвертичной структуре белка на примере белка Нb (гемоглобина), связи, которые формируют четвертичную структуру.
Выполнить следующие упражнения
1.Напишите проекционные формулы Фишера энантиомеров α- аминокислот, назовите по ИЮПАК и ЗН. Выберите из них незаменимые.
1. АЛА 5. ИЛЕ 9. ЛИЗ 13. ЦИС
2 ВАЛ 6. ТРЕ 10. АРГ 14. МЕТ
3. СЕР 7. АСП 11. ФЕН 15. ГЛИ
4. ЛЕЙ 8. ГЛУ 12. ТИР 16. ГИС
2. Напишите следующие уравнения реакций
1) переаминирования щавелевоуксусной кислоты с аланином.
2) переаминирования α-кетоглутаровой кислоты с АСП, ТИР.
3) окислительного дезаминирования ГЛУ.
4) восстановительное аминирование α-кетоглутаровой кислоты.
5) Образования солей (в ионной форме): ЛЕЙ, ЦИС.
6) Образования хелатного соединения: АЛА, ЛЕЙ.
7) «Защиты» карбоксигруппы: ИЛЕ, ВАЛ.
8) «Защиты» аминогруппы: ТИР, ТРИ.
Обязательная самостоятельная работа
I. Напишите следующие уравнения реакций
Декарбоксилирование 1. ЛИЗ 2. ГИС 3. 5-гидрокси ТРИ 4. ГЛУ 5. 3,4-дигидроксифенилаланина
Дезаминирование. 1. ГЛУ 2. СЕР 3.ГИС 4. АЛА
Образования дипептидов 1. ГЛИ-ГЛУ 2. АЛА-ЦИС
Образования трипептидов. 1. ЛЕЙ-ВАЛ-ФЕН 2. ЛИЗ-ТРИ-ГИС 3. ЦИС-ГЛИ-АСП
Укажите С- и N- концы пептидов, приведите строение внутренней соли. При каком значении рН находится ИЭТ данных пептидов.
II. Ответить на тестовые задания.
1. Моноаминомонокарбоновые кислоты:
а) ЛИЗ; б) ВАЛ; в) АСП; г) ФЕН;
АРГ. ЛЕЙ. ГЛУ. ТИР.
2. Моноаминодикарбоновые кислоты:
а) ЛИЗ; б) ВАЛ; в) АСП; г) ФЕН;
АРГ. ЛЕЙ. ГЛУ. ТИР.
3. Диаминомонокарбоновые кислоты:
а) ЛИЗ; б) ВАЛ; в) АСП; г) ФЕН;
АРГ. ЛЕЙ. ГЛУ. ТИР.
4. Ароматические α — аминокислоты:
а) ЛИЗ; б) ВАЛ; в) АСП; г) ФЕН;
АРГ. ЛЕЙ. ГЛУ. ТИР.
5. Гетероциклические α — аминокислоты:
а) ЦИС; б) ГИС; в) аспарагин; г) треонин
МЕТ. ТРИ. глутамин. серин.
5. Серусодержащие α — аминокислоты:
а) ЦИС; б) ВАЛ; в) АСП; г) ФЕН;
МЕТ. ЛЕЙ. ГЛУ. ТИР.
6. Гидроксисодержащие моноаминомонокарбоновые кислоты:
а) ЛИЗ; б) ВАЛ; в) АСП; г) СЕР;
АРГ. ЛЕЙ. ГЛУ. ТРЕ.
7. Незаменимые α — аминокислоты:
1) ГЛИ; 2) АЛА; 3) ВАЛ; 4) ЛЕЙ; 5) СЕР; 6) ИЛЕ; 7) ЦИС; 8) ТРЕ; 9) АСП; 10) МЕТ; 11) ГЛУ; 12) ФЕН; 13) ТИР; 14) ТРИ; 15) ГИС; 16) ЛИЗ
а) 3,4,6,8,10,12,14,16; б) 1,2,5,7,9,11,13,15.
8. К нейтральным α — аминокислотам (pI=pH=7) относятся:
а) ГИС; б) АСП; в) ВАЛ;
9. К кислым α — аминокислотам (pI
а) ГИС; б) АСП; в) ВАЛ;
10. К основным α — аминокислотам (pI>pH=7) относятся:
а) ГИС; б) АСП; в) ВАЛ;
Лабораторная работа
Опыт 1 Биуретовая реакция (реакция Пиотровского)
Открывает пептидную связь в белке.
Принцип метода:Биуретовая реакция обусловлена образованием биуретового комплекса (хелатного) в результате соединения меди с пептидной группировкой белка. В щелочной среде раствор белка при взаимодействии с ионами меди приобретает сине-фиолетовый цвет, а продукты неполного гидролиза его (пептиды) дают розовое окрашивание.
Материалы: белки (растворы), концентрированный раствор щелочи, раствор сернокислой меди.
Ход работы. А). К 2 мл раствора белка добавляют равный объем концентрированного раствора щелочи, перемешать и затем каплю (не больше!) раствора сернокислой меди. Жидкость окрашивается в ярко-фиолетовый цвет, который заметен даже в окрашенной водной вытяжке из мяса.
Б). Проделать реакцию с водным раствором мяса.
🔥 Видео
Пептидная связь. Образование пептидной связи. Запись структурной формулы пептида.Скачать

АМИНОКИСЛОТЫ. ГОТОВИМСЯ К МИКРОКОНТРОЛЮСкачать

Определение pI (изоэлектрической точки) пептидов. Биохимия.Скачать

Кислотно-основные свойства пептидов. Изоэлектрическая точка.Скачать

Образование пептидов. Запись структурной формулы пептидаСкачать

Биохимия. Определение заряда аминокислот и пептидов в различных средах.Скачать

Биохимический анализ крови. Расшифровка. Что значит результат?Скачать

МОНОСАХАРИДЫ. ГОТОВИМСЯ К МИКРОКОНТРОЛЮСкачать
Задача на определение формулы трипептида. Биохимия.Скачать

Изоэлектрическая точка (ИЭТ или pI) для аминокислот. Учимся вычислять. Биохимия.Скачать

Пептидная связьСкачать

Биохимия. Белки. Строим полипептидную цепь.Скачать

Решение цепочек превращений по химииСкачать

Алгоритм анализа ЭКГ. Характеристика зубцов, сегментов, интервалов.Скачать

Движение пептидов в электрофоретическом поле при разных рН. Биохимия.Скачать

1.2. Формирование заряда у пептидов. ИЭТСкачать

Ионные уравнения реакций. Составляем полные и сокращенные ионные уравнения. Часть 1.Скачать

Опасность передозировки витамином D3!Скачать