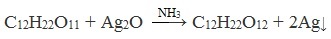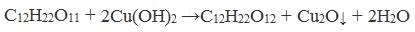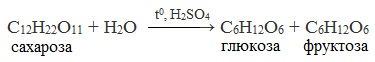- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Уравнение реакции образования сахаратов кальция
- Биологическая роль сахарозы
- Строение сахарозы
- Физические свойства сахарозы и нахождение в природе
- Химические свойства
- Получение сахарозы
- Применение сахарозы
- Способ получения сахарата кальция
- 🎥 Видео
Видео:Опыты по химии. Гидролиз сахарозыСкачать

We are checking your browser. gomolog.ru
Видео:Получение АЦЕТИЛЕНА. Получение КАРБИДА КАЛЬЦИЯ. Реакция КАРБИДА КАЛЬЦИЯ и ВОДЫ. Опыты по химии дома.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Получение ОКСИДА КАЛЬЦИЯ. Разложение КАРБОНАТА КАЛЬЦИЯ ( МЕЛА). Реакция с водой. Опыты по химииСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e31cf7d5ebb992c • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Опыты по химии. Взаимодействие сахарозы с гидроксидом меди (II)Скачать

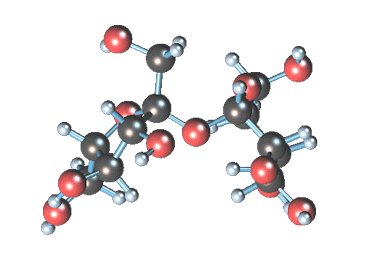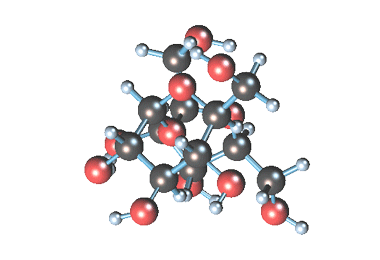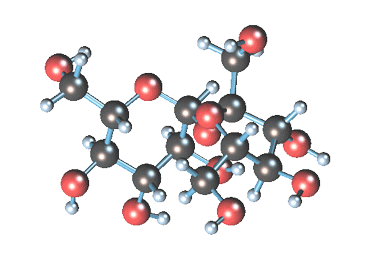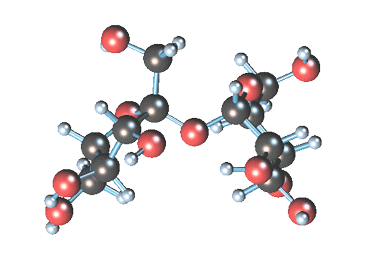
Уравнение реакции образования сахаратов кальция
Примером наиболее распространенных в природе дисахаридов (олигосахаридом) является сахароза (свекловичный или тростниковый сахар).
Биологическая роль сахарозы
Наибольшее значение в питании человека имеет сахароза, которая в значительном количестве поступает в организм с пищей. Подобно глюкозе и фруктозе сахароза после расщепления ее в кишечнике быстро всасывается из желудочно-кишечного тракта в кровь и легко используется как источник энергии.
Важнейший пищевой источник сахарозы — сахар.
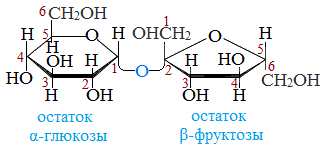
Строение сахарозы
Молекулярная формула сахарозы С12Н22О11 .
Сахароза имеет более сложное строение, чем глюкоза. Молекула сахарозы состоит из остатков молекул глюкозы и фруктозы в их циклической форме. Они соединены друг с другом за счет взаимодействия полуацетальных гидроксилов (1→2) -гликозидной связью, то есть свободный полуацетальный (гликозидный) гидроксил отсутствует:
Физические свойства сахарозы и нахождение в природе
Сахароза (обыкновенный сахар) – белое кристаллическое вещество, более сладкое, чем глюкоза, хорошо растворимое в воде.
Температура плавления сахарозы 160°C. При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
Сахароза является весьма распространённым в природе дисахаридом, она встречается во многих фруктах, плодах и ягодах. Особенно много ее содержится в сахарной свёкле (16-21%) и сахарном тростнике (до 20%), которые и используются для промышленного производства пищевого сахара.
Содержание сахарозы в сахаре 99,5%. Сахар часто называют «носителем пустых калорий», так как сахар – это чистый углевод и не содержит других питательных веществ, таких, как, например, витамины, минеральные соли.
Химические свойства
Для сахарозы характерны реакции по гидроксильным группам.
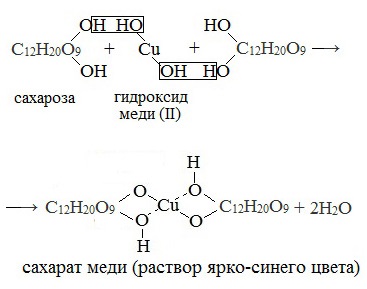
1. Качественная реакция с гидроксидом меди (II)
Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов.
Видеоопыт «Доказательство наличия гидроксильных групп в сахарозе»
Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди (качественная реакция многоатомных спиртов):
2. Реакция окисления
Восстанавливающие дисахариды
Дисахариды, в молекулах которых сохраняется полуацетальный (гликозидный) гидроксил (мальтоза, лактозы), в растворах частично превращаются из циклических форм в открытые альдегидные формы и вступают в реакции, характерные для альдегидов: реагируют с аммиачным раствором оксида серебра и восстанавливают гидроксид меди (II) до оксида меди (I). Такие дисахариды называются восстанавливающими (восстанавливают Cu (OH)2 и Ag2O).
Реакция «серебряного зеркала»
Реакция с гидроксидом меди (II)
Невосстанавливающий дисахарид
Дисахариды, в молекулах которых нет полуацетального (гликозидного) гидроксила (сахароза) и которые не могут переходить в открытые карбонильные формы, называются невосстанавливающими (не восстанавливают Cu (OH)2 и Ag2O).
Сахароза, в отличие от глюкозы, не является альдегидом. Сахароза, находясь в растворе, не вступает в реакцию «серебряного зеркала» и при нагревании с гидроксидом меди (II) не образует красного оксида меди (I), так как не способна превращаться в открытую форму, содержащую альдегидную группу.
Видеоопыт «Отсутствие восстанавливающей способности сахарозы»
3. Реакция гидролиза
Для дисахаридов характерна реакция гидролиза (в кислой среде или под действием ферментов), в результате которой образуются моносахариды.
Сахароза способна подвергаться гидролизу (при нагревании в присутствии ионов водорода). При этом из одной молекулы сахарозы образуется молекула глюкозы и молекула фруктозы:
Видеоопыт «Кислотный гидролиз сахарозы»
Мальтоза и лактоза при гидролизе расщепляются на составляющие их моносахариды за счёт разрыва связей между ними (гликозидных связей):
Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов.
В живых организмах гидролиз дисахаридов происходит при участии ферментов.
Получение сахарозы
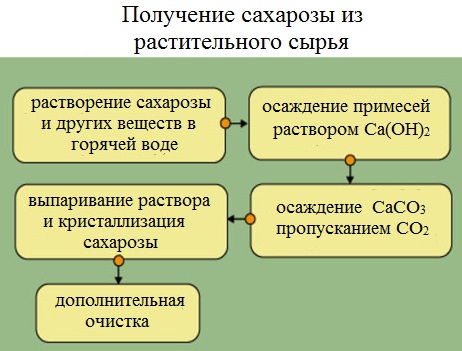
Сахарную свеклу или сахарный тростник превращают в тонкую стружку и помещают в диффузоры (огромные котлы), в которых горячая вода вымывает сахарозу (сахар).
Вместе с сахарозой в водный раствор переходят и другие компоненты (различные органические кислоты, белки, красящие вещества и др.). чтобы отделить эти продукты от сахарозы, раствор обрабатывают известковым молоком (гидроксидом кальция). В результате этого образуются малорастворимые соли, которые выпадают в осадок. Сахароза образует с гидроксидом кальция растворимый сахарат кальция С12Н22О11·CaO·2Н2О.
Для разложения сахарата кальция и нейтрализации избытка гидроксида кальция через раствор пропускают оксид углерода ( IV).
Выпавший в осадок карбонат кальция отфильтровывают, а раствор упаривают в вакуумных аппаратах. По мере образования кристалликов сахара отделяют с помощью центрифуги. Оставшийся раствор – меласса – содержит до 50% сахарозы. Его используют для производства лимонной кислоты.
Выделенную сахарозу очищают и обесцвечивают. Для этого ее растворяют в воде и полученный раствор фильтруют через активированный уголь. Затем раствор снова упаривают и кристаллизуют.
Применение сахарозы
Сахароза в основном используется как самостоятельный продукт питания (сахар), а также при изготовлении кондитерских изделий, алкогольных напитков, соусов. Ее используют в высоких концентрациях в качестве консерванта. Путем гидролиза из нее получают искусственный мёд.
Сахароза находит применение в химической промышленности. С помощью ферментации из нее получают этанол, бутанол, глицерин, левулиновую и лимонную кислоты, декстран.
В медицине сахарозу используют при изготовлении порошков, микстур, сиропов, в том числе для новорожденных детей (для придания сладкого вкуса или консервации).
Видео:Получение искуственного шелка - интересная полимерная реакция!Скачать

Способ получения сахарата кальция
Использование: электролиз водных растворов хлоридов кальция. Сущность изобретения: перед приведением 7 — 10%-ного раствора сахарозы в контакт с гидроксидом кальция раствор сахарозы помещен в катодное пространство мембранного электролизера, в анодное пространство помещают 20-25%-ный раствор хлорида кальция или дистиллярную жидкость содового производства, в качестве материала катода используют сталь, а в качестве материала анода используют платину или платинированный титан.
Изобретение относится к электрохимическому производству, в частности к электролизу водных растворов хлоридов кальция.
Сахарат кальция находит широкое применение как ингибитор коррозии углеродистой стали в рассолах хлорида кальция. Сахарат кальция образует с хлористым кальцием соединение, регулирующее pH среды, и участвует в формировании защитной пленки на металле.
Известен способ получения сахарата кальция при взаимодействии гидроксида кальция и сахарозы, включающий следующие химические реакции: 

Температура обжига известняка составляет 840-900 o C. Кроме того, возникает необходимость утилизации образующего по этой реакции диоксида углерода.
Гидроокись кальция, необходимую для реакции с сахарозой при синтезе сахарата кальция электролизом раствора хлористого кальция или дистиллярной жидкости содового производства, получить невозможно из-за того, что мембрана и катод покрываются твердым осадком, сопротивление системы при этом резко возрастает. Реверсирование тока, механические приспособления, предлагаемые разными авторами, не нашли практического применения из-за больших энергетических затрат.
Сущность изобретения в том, что сахарат кальция образуется при электролизе раствора хлорида кальция или дистиллярной жидкости содового производства. Электролиз проводится в электролизере с катионитовой мембраной, катодная камера которого содержит 7-10% сахароза, анодная 20-25%-ный раствор хлористого кальция. Анод платина, платинированный титан, катод сталь. При электролизе ионы кальция проходят через мембрану и образующийся в катодном пространстве гидроксид кальция по указанным выше уравнениям реакции взаимодействует с сахарозой с образованием сахарата кальция. На катоде при электролизе выделяется газообразный водород, аноде хлор.
Концентрация сахарозы в катодном пространстве определяется растворимостью образующегося сахарата кальция. Выбор концентрации хлористого кальция определяется электропроводностью раствора.
Преимуществами данного способа получения сахарата кальция являются: уменьшение энергетических затрат, возможность утилизации промышленных отходов, содержащих растворы хлористого кальция, экологическая чистота из-за отсутствия диоксида углерода в технологической схеме. Кроме того, на аноде и катоде образуются ценные продукты: газообразные хлор и водород.
Пример. В катодную камеру электролизера из фторопласта, разделенного на катодное и анодное пространства с помощью катионитовой мембраны МК-40, заливают 100 мл 10%-ного раствора сахарозы, анодную 25%-ный раствор хлористого кальция. Анод платина, катод сталь. Напряжение на электролизере 10 В при силе тока 0,5 A. Выход по току сахарата кальция 95%
Способ получения сахарата кальция, включающий приведение 7 10%-ного раствора сахарозы в контакт с гидроксидом кальция, отличающийся тем, что перед приведением в контакт раствор сахарозы помещают в катодное пространство электролизера с катионитовой мембраной, в анодное пространство помещают 20 — 25% -ный раствор хлорида кальция или дистиллярную жидкость содового производства, в качестве материала катода используют сталь, а в качестве материала анода используют платину или платинированный титан.
🎥 Видео
Получение угольной пены - Реакция сахара и серной кислоты!Скачать

Опыты по химии. Взаимодействие кальция с водойСкачать

Опыты по химии. Получение гидроксида меди (II) и изучение его свойствСкачать

65. Что такое реакция гидратации и реакция дегидратацииСкачать

Патологическая кальцификацияСкачать

Получение серебра - реакция серебряного зеркала! (химия)Скачать

Реакция МАГНИЯ и СОЛЯНОЙ КИСЛОТЫ. Получение ХЛОРИДА МАГНИЯ MgCI2. Опыты по химии дома. ЭкспериментыСкачать

Качественная реакция на альдегиды с гидроксидом медиСкачать

Календула- лучшее вредство от тысячи болезней. Хорошая работа всего организма.Скачать

Опыты с гидроксидом кальцияСкачать

Химические реакции в природе и жизнедеятельности живых организмов. 8 класс.Скачать

Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Качественная реакция глюкозы с гидроксидом меди (II)Скачать

25. Схема реакции и химическое уравнениеСкачать

Химия 10 класс (Урок№10 - Углеводы. Глюкоза. Олигосахариды. Сахароза.)Скачать