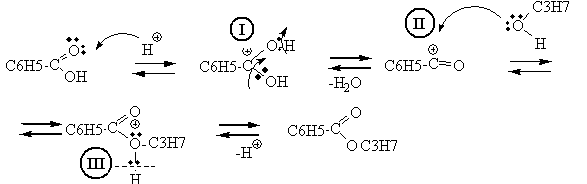
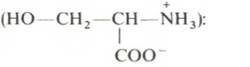36. Напишите схему получения пропилбензоата из кислоты и спирта.
Опишите механизм этой реакции.
Сравните ацилирующую способность бензойной и уксусной кислот.
Укажите роль кислотного катализатора.
Объясните возможность гидролиза пропилбензоата в кислой и щелочной среде.
Подтвердите Ваше предположение соответствующими уравнениями. .
2.Механизм реакции этерификации – нуклеофильное замещение SN : замещение ОН-группы на алкоксигруппу (ОС3Н7).
Роль катализаторов в реакции этерификации играют ионы водорода. Кислород карбоксильной группы, захватывая протон, образует карбониевый ион I. Соединение I присоединяет молекулу спирта за счет неподеленных электронов кислородного атома с образованием промежуточного комплекса II, Этот комплекс способен обратимо распадаться с отщеплением воды и образованием нового карбониевого катиона сложного эфира III, который при диссоциации образует сложный эфир, причем освобождается катализатор – протон.
3. Электронодонорные заместителиуменьшают электрофильность карбонильного атома углерода и, следовательно, понижают реакционную способность оксосоединения. Фенильный радикал С6Н5 в бензойной кислоте обладает более выраженными донорными свойствами, чем метильный радикал в уксусной кислоте. Как следствие, реакция этерификации с участием бензойной кислоты протекает медленнее, чем в случае алифатических. Таким образом, ацилирующая способность бензойной кислоты ниже, чем уксусной.
4. Роль кислотного катализатора – участие в образовании промежуточного карбониевого иона I .
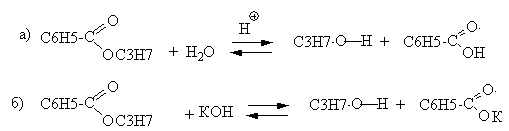
5. Гидролиз пропилбензоата в кислой среде протекает с образованием пропилового спирта и бензойной кислоты (реакция а), в щелочной среде – пропилового спирта и бензоата (реакция б):
37. Напишите схему реакции получения амида валериановой (пентановой) кислоты из ее хлорангидрида.
Опишите механизм этой реакции.
Объясните возможность её протекания без участия катализатора.
Обоснуйте необходимость применения кислотного или щелочного катализатора при гидролизе полученного амида.
2. Механизм этой реакции –нуклеофильное замещение, протекает по бимолекулярному (SN2) механизму
На первом этапе молекула аммиака, имеющая неподеленную электронную пару, атакует атом углерода, связанный с кислородом и хлором. Вследствие разности электроотрицательностей на этом атоме углерода будет недостаток электронной плотности. Образуется промежуточное соединение I. На втором этапе происходит отщепление молекулы хлороводорода с образованием амида.
3. Данная реакция может протекать без участия катализатора, так как галоген в галогенанангидридах обладает большой реакционной способностью
4. В жестких условиях под действием водных растворов кислот или щелочей амиды гидролизуются:
Механизмы реакций аналогичны гидролизу сложных эфиров. Однако, в отличие от гидролиза эфиров, кислотный и щелочной гидролиз амидов протекают необратимо.
38. Напишите уравнение реакции образования фосфатидилэтаноламина (кефалина) в состав которого входят олеиновая и линолевая кислоты.
Изобразите конформационную формулу олеиновой кислоты.
Укажите полярную и неполярную части ее молекулы.
Ответ
2. Конформационная формула олеиновой кислоты
3.
39. Напишите уравнение реакции образования фосфатидилхолина (лецитина), в состав которого входят стеариновая и линолевая кислоты.
Изобразите конформационную формулу линоленовой кислоты.
Укажите полярную и неполярную части ее молекулы.
2. Конформационная формула линолевой кислоты
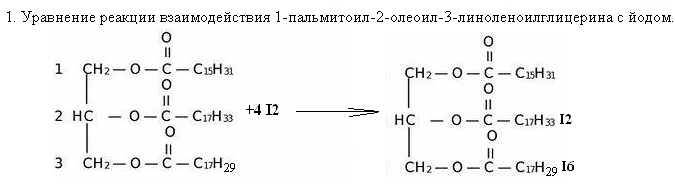
40. Напишите уравнение реакции взаимодействия 1-пальмитоил-2-олеоил-3-линоленоилглицерина с йодом.
Классифицируйте исходный субстрат по химическому составу.
Изобразите конформационную формулу олеиновой кислоты.
Укажите полярную и неполярную части ее молекулы.
Сформулируйте определение понятия “йодное число”.
Объясните назначение этого показателя.
2. Исходный субстрат является сложным эфиром трехатомного спирта глицерина и трех высокомолекулярных карбоновых кислот: пальмитиновой С15Н31СООН (предельная кислота), олеиновой С17Н33СООН (непредельная кислота, содержит одну двойную связь), линоленовой С17Н29СООН (непредельная кислота, содержит три двойных связи). При взаимодействии с иодом к остатку олеиновой кислоты присоединится 1 молекула I2, к остатку линоленовой кислоты – 3 молекулы I2.
3. Конформационная формула олеиновой кислоты
4. “йодное число” -масса иода (в г), присоединяющегося к 100 г органического вещества
5.Назначение показателя: Иодное число, которое характеризует содержание двойных связей в ненасыщенном соединении, определяют при исследовании жиров, а также при анализе жирных кислот и установлении содержания реагирующих с иодом примесей в ароматических углеводородах. Иодное число определяет общую ненасыщенность жиров. Чем выше иодное число, тем больше ненасыщенных кислот содержится в жире, то есть тем больше иода вещество может присоединить.
41. Напишите уравнение реакции гидрогенизации 1-стеароил-2,3-линолеоилглицерина.
Классифицируйте исходный субстрат по химическому составу.
Изобразите конформационную формулу линолевой кислоты.
Укажите полярную и неполярную части ее молекулы.
Назовите практическое применение этой реакции.
Укажите преимущества и недостатки полученного продукта, используемого в пищевых целях.
2. Исходный субстрат является сложным эфиром трехатомного спирта глицерина и двух высокомолекулярных карбоновых кислот: стеариновой С17Н35СООН (предельная кислота), линолевой С17Н31СООН (непредельная кислота, содержит 2 двойных связи). При гидрогенизации к одному остатку линолевой кислоты присоединится 2 молекулы Н2
3. Конформационная формула линолевой кислоты
4. Практическое применение реакции гидрогенизациисложных эфиров глицерина и непредельных карбоновых кислот используется для превращения жидких растительных жиров в твердые (маргарин). При этом повышается энергетическая ценность продуктов. Недостатки: продукт гидрогенизации может содержать побочные продукты и следы катализатора. Помимо этого, в продукте содержатся соединения транс-жирных кислот (ТЖК), являющихся ксенобиотиками.
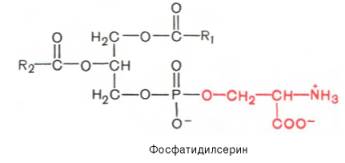
42. Напишите уравнение реакции омыления (щелочного гидролиза) фосфатидилсерина, содержащего пальмитиновую и арахидоновую кислоты.
Изобразите конформационную формулу арахидоновой кислоты.
Укажите полярную и неполярную части ее молекулы.
2. Конформационная формула арахидоновой кислоты
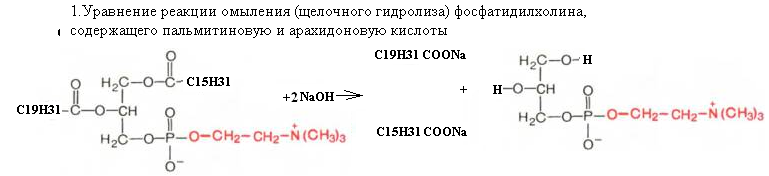
43. Напишите уравнение реакции омыления (щелочного гидролиза) фосфатидилхолина, содержащего пальмитиновую и арахидоновую кислоты.
Изобразите конформационную формулу арахидоновой кислоты.
Укажите полярную и неполярную части ее молекулы.
2. Конформационная формула арахидоновой кислоты
44. Напишите уравнение реакции кислотного гидролиза кефалина, содержащего стеариновую и линолевую кислоты.
Изобразите конформационную формулу линолевой кислоты.
Укажите полярную и неполярную части ее молекулы.
Ответ
2. Конформационная формула линолевой кислоты
Моносахариды
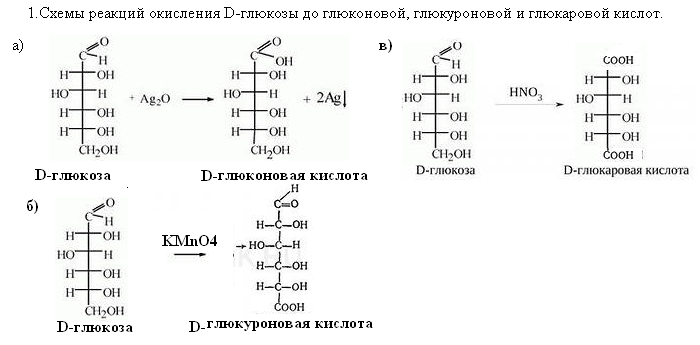
45. Напишите схемы реакций окисления D-глюкозы до глюконовой, глюкуроновой и глюкаровой кислот.
Укажите условия протекания реакций.
Условия проведения: окисления до глюконовой кислоты протекает под воздействием мягкодействующих окислителей:оксида серебра, хлорноватистой или бромноватистой кислоты. Окисление до глюкуроновой кислоты протекает в более жестких условиях, например, под воздействием перманганата калия или дихромата калия в присутствии серной кислоты. Получение глюкаровой кислоты происходит при обработке глюкозы концентрированной азотной кислотой.
46. Напишите уравнения реакций взаимодействия a,D-рибофуранозы с уксусным ангидридом и гидролиза полученного продукта.
Назовите продукты первой реакции.
47. Напишите уравнения реакций образования глюкозо-1-фосфата, глюкозо-6-фосфата, фруктозо-1,6-дифосфата.
Объясните значение полученных продуктов в процессах жизнедеятельности.
1. Уравнения реакций образования глюкозо-1-фосфата, глюкозо-6-фосфата, фруктозо-1,6-дифосфата.
2.Значение полученных продуктов в процессах жизнедеятельности:
А)глюкозо-6-фосфат образуется на первой стадии гликолиза при фосфорилировании молекулы глюкозы. Фосфорилирование глюкозы преследует две цели: во-первых, из-за того что плазматическая мембрана, проницаемая для нейтральной молекулы глюкозы, не пропускает отрицательно заряженные молекулы глюкозо-6-фосфата, фосфорилированная глюкоза оказывается запертой внутри клетки. Во-вторых, при фосфорилировании глюкоза переводится в активную форму, способную участвовать в биохимических реакциях и включаться в метаболические циклы., происходящее при участии тканеспецифичного фермента гексокиназы .
Б) Образование фруктозо-1,6-дифосфата — это вторая ключевая реакция гликолиза, её регуляция определяет интенсивность гликолиза в целом.
В) После изомеризации глюкозо-6-фосфата в глюкозо-1-фосфат протекает дополнительная активация глюкозного фрагмента, что важно для синтеза гликогена в печени.
49.Напишите уравнения реакций взаимодействия D-маннозы с СН3I и СН3ОН и гидролиза полученных продуктов.
Объясните отличие в протекании этих реакций.
Укажите роль среды в реакции гидролиза.
1. Уравнения реакций взаимодействия D-маннозы с СН3I и СН3ОН и гидролиза полученных продуктов.
2. Отличие в протекании этих реакций: при действии на маннозу СН3I и Ag2O можно получить пентаметилманнозу, при действии СН3ОН и HCl реагирует только один гидроксил. Причина этого в том, что полуацетальный гидроксил по своим реакционным свойствам отличается от четырех других. В результате алкилирования манноза теряет свои альдегидные свойства.
Частичный гидролиз пентаметилманнозы в кислой среде приводит к тетраметилманнозе (гидролизуется только эфир, образованный с участием полуацетального гидроксила). Освобождение полуацетального гидроксила способствует восстановлению альдегидных свойств моносахарида. Дальнейший гидролиз приводит к получению маннозы.
Роль среды в реакции гидролиза –поскольку в гидролиз вступают простые эфиры маннозы и метанола, гидролиз идет только в кислой среде.
Дисахариды. Полисахариды
48. Напишите уравнение реакции образования мальтозы.
Приведите её полное название.
Назовите тип гликозидной связи.
Объясните причину восстанавливающей способности мальтозы.
Подтвердите Ваш тезис уравнением реакции с аммиачным раствором Ag2O.
Укажите эффект реакции.
1. Уравнение реакции образования мальтозы.
2.Полное название мальтозы: 4-О-α-D-глюкопиранозил-D-глюкоза
3.Тип гликозидной связи – α-1,4 гликозидная связь
4.Причина восстанавливающей способности мальтозы:
Для образования гликозидной связи использован только один из гликозидных гидроксилов и, следовательно, содержит в скрытой форме альдегидную группу. Альдегидные свойства мальтозы проявляются, в частности, при взаимодействии ее с оксидом серебра в аммиачной среде при нагревании:
Эффект реакции – «серебряное зеркало» (осаждение металлического серебра на стенках пробирки)
49. Напишите уравнение реакции образования лактозы.
Приведите её полное название.
Назовите тип гликозидной связи.
Объясните причину восстанавливающей способности лактозы.
Подтвердите Ваш тезис уравнением реакции с гидроксидом меди (II).
Укажите эффект реакции.
Ответ
1. Уравнение реакции образования лактозы.
4.Полное название лактозы: 4-О-β-D-галактопиранозил-D-глюкоза
3. Тип гликозидной связи — β-1,4 гликозидная связь
4. Причина восстанавливающей способности лактозы: Для образования гликозидной связи использован только один из гликозидных гидроксилов и, следовательно, содержит в скрытой форме альдегидную группу. Альдегидные свойства лактозы проявляются, в частности, при взаимодействии ее с гидроксидом меди (II) при нагревании:
Эффект реакции – выпадение красного осадка закиси меди Сu2O
50. Напишите уравнение реакции образования сахарозы.
Приведите её полное название.
Укажите тип гликозидной связи.
Объясните причину отсутствия у сахарозы восстанавливающей способности.
1. Уравнение реакции образования сахарозы.
2.Полное название сахарозы: α-D-глюкопиранозил-β-D-фруктофуранозид
5.Тип гликозидной связи: α-1,2 — гликозидная связь
6.Причина отсутствия у сахарозы восстанавливающей способности – в образовании гликозидной связи участвуют обе гликозидные гидроксильные группы. Таким образом, отсутствует возможность их раскрытия и превращения в альдегидные
51. Напишите формулы фрагментов молекул амилозы и амилопектина.
Назовите моносахаридные и дисахаридные звенья.
Укажите типы гликозидной связи.
Объясните отсутствие восстановительной способности у крахмала.
Перечислите отличия гликогена от амилопектина, способствующие выполнению его биологической роли.
1.Формулы фрагментов молекул амилозы и амилопектина
2.Моносахаридные звенья и у амилозы, и у амилопектина – α -D-глюкопираноза. Дисахаридным фрагментом амилозы является мальтоза. При гидролизе амилопектина наряду с мальтозой образуется небольшое количество изомальтозы
3.. Типы гликозидной связи: у амилозы – α- 1,4- гликозидная связь, у амилопектина — α- 1,4 и α- 1,6 — гликозидные связи.
4.Отсутствие восстановительной способности у крахмала объясняется тем, что в образовании гликозидной связи участвуют все гликозидные гидроксильные группы. Таким образом, отсутствует возможность их раскрытия и превращения в альдегидные.
5.Отличия гликогена от амилопектина, способствующие выполнению его биологической роли:
А) По строению гликоген подобен амилопектину, но имеет еще большее разветвление цепей. Условно можно сказать, что разветвленность макромолекулы гликогена вдвое больше, чем амилопектина. Сильное разветвление способствует выполнению гликогеном энергетической функции, так как только при множестве концевых остатков можно обеспечить быстрое отщепление нужного количества молекул глюкозы.
Б)Молекулярная масса гликогена больше, чем у амилопектина и достигает 100 млн. Такой размер макромолекул содействует выполнению функции резервного углевода.
52. Напишите формулы дисахаридных фрагментов молекул хондроитинсульфата и гиалуроновой кислоты.
Назовите типы гликозидной связи внутри дисахаридных фрагментов и между ними.
Укажите биологическую роль перечисленных гетерополисахаридов.
1. Формулы дисахаридных фрагментов молекул хондроитинсульфата и гиалуроновой кислоты.
2.Типы гликозидной связи внутри дисахаридных фрагментов – β-1,3 гликозидная связь, между фрагментами — β-1,4 гликозидная связь.
А) Гиалуроновая кислота является главным компонентом синовиальной жидкости, отвечающим за её вязкость. Гиалуроновая кислота — важный компонент суставного хряща, в котором присутствует в виде оболочки каждой клетки (хондроцита). Гиалуроновая кислота входит в состав кожи, где участвует в регенерации ткани. Гиалуроновая кислота играет важную роль в гидродинамике тканей, участвует в процессе развития опухолей.
Б) Хондроитинсульфат стимулирует синтез гиалуроновой кислоты, укрепляя соединительнотканные структуры: хряща, сухожилий, связок, кожи. Оказывает анальгетическое и противовоспалительное действие, является хондропротектором, способствует активной регенерации хряща. Особенностью хондроитина является его способность сохранять воду в толще хряща в виде водных полостей, создающих хорошую амортизацию и поглощающих удары, что в итоге повышает прочность соединительной ткани. Важным действием хондроитина является его способность угнетать действие специфических ферментов, разрушающих соединительную ткань.
Аминокислоты. Пептиды
53. Напишите проекционные формулы Фишера для всех изомеров треонина.
Объясните, почему эта аминокислота существует в виде четырех пространственных изомеров.
Укажите стереоизомер треонина, входящий в состав белков.
Назовите другие аминокислоты, содержащиеся в белках, имеющие два хиральных центра.
1. Проекционные формулы Фишера для всех изомеров треонина
2.Треонин существует в виде четырех пространственных изомеров, так как у него имеется два хиральных центра: атом углерода, связанный с аминогруппой и атом углерода, связанный с гидроксильной группой.
3. В состав белков входит L-треонин.
4. Содержащиеся в белках аминокислоты, имеющие два хиральных центра:
изолейцин, треонин, гидроксипролин, 5-гидроксилизин и цистин
54. Напишите уравнения реакций восстановительного аминирования с участием a-кетоглутаровой кислоты и трансаминирования с участием аспарагиновой и пировиноградной кислот.
Назовите все органические соединения, участвующие в реакции, по ЗН ИЮПАК.
Ответ
Восстановительное аминирование – метод синтеза a -аминокислот из a -оксокислот при участии кофермента НАД Н в качестве восстанавливающего реагента.
Трансаминирование – основной путь биосинтеза аминокислот. При трансаминировании происходит взаимообмен двух функциональных групп – аминной и карбонильной между аминокислотой и кетокилотой. Реакция осуществляется при участии ферментов трансаминаз и кофермента пиридоксальфосфата.
55. Напишите уравнения реакций окислительного дезаминирования глутаминовой кислоты (in vivo) и неокислительного дезаминирования лейцина (in vivo, in vitro).
Назовите все участвующие в реакции вещества по ЗН ИЮПАК.
Укажите биологическое значение реакции дезаминирования.
1. Уравнение реакции окислительного дезаминирования глутаминовой кислоты (in vivo) .
Окислительное дезаминирование происходит при участии ферментов оксидаз и кофермента НАД + , который выступает в качестве окислителя. В результате выделяется аммиак и образуется соответствующая кетокислота.
2. Уравнение реакции неокислительного дезаминирования лейцина (in vivo).
Неокислительное дезаминирование происходит путем отщепления аммиака под действием ферментов с образованием , -непредельных кислот.
3. Уравнение реакции неокислительного дезаминирования лейцина (in vitro).
Аминокислоты содержат первичную аминогруппу и подобно первичным аминам взаимодействуют с азотистой кислотой с выделением азота. При этом происходит замещение аминогруппы на гидроксильную. Реакция используется для количественного определения аминокислот по объему выделившегося азота (метод Ван-Слайка).
4. Биологическое значение реакции дезаминирования: с помощью реакций дезаминирования снижается избыток аминокислот в организме.
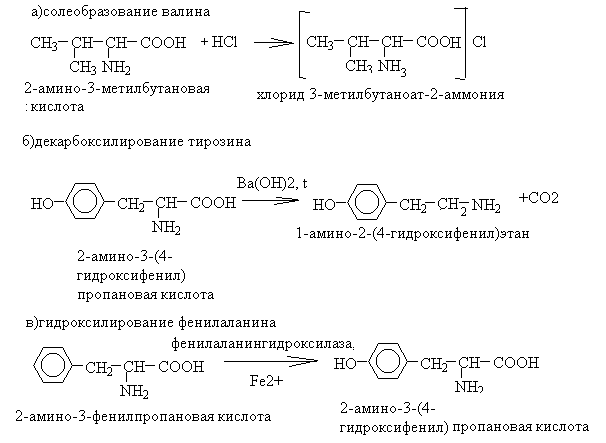
56. Напишите уравнения реакций солеобразования валина, декарбоксилирования тирозина, гидроксилирования фенилаланина.
Назовите все участвующие в реакции вещества по ЗН ИЮПАК.
Укажите значение этих реакции.
Ответ
1. Уравнения реакций
2. Значение реакций: реакции солеобразования используют для защиты аминогруппы при пептидном синтезе, декарбокислирование – один из способов получения биогенных аминов, гидроксилирование фенилаланина – первый этап его метаболизма.
57. Напишите уравнение реакции образования трипептида Три – Сер – Мет.
Выделите пептидные связи.
Назовите незаменимые аминокислоты, входящие в состав трипептида.
Укажите, в какой среде находится ИЭТ трипептида.
Объясните роль серина в формировании пространственной структуры пептидов и белков.
1. Уравнение реакции образования трипептида Три – Сер – Мет
2.В состав трипептида входят незаменимые аминокислоты триптофан и метионин
3.Изоэлектрическая точка пептида находится в среде, близкой к нейтральной, поскольку входящие в него аминокислоты содержат неполярные радикалы (триптофан и метионин) и полярный неионогенный радикал (серин). Предположительно, ИЭТ пептида =5,7-5,8.
4. Роль серина в формировании пространственной структуры пептидов и белков определяется наличием гидроксогруппы, способной образовывать водородные связи. Водородные связи участвуют в формировании вторичной, третичной и четвертичной структур белков.
4. Нуклеиновые кислоты. Нуклеотидные коферменты
58. Напишите строение гуанина, урацила и комплементарных им оснований.
Продемонстрируйте варианты образования водородных связей.
Объясните механизм их возникновения.
1. Строение гуанина, урацила и комплементарных им оснований.
Урацил комплементарен аденину , гуанин –цитозину. На схемах указаны варианты образования водородных связей между основаниями.
2. Механизм возникновения водородных связей: атомы водорода, на которых, вследствие разности электроотрицательностей водорода и азота, формируется частичный положительный заряд, притягиваются к атомам кислорода, входящим в состав карбонильных групп и атомам азота, входящим в состав гетероциклов. На атомах О и N сформирована избыточная электронная плотность. Электростатическое притяжение противоположно заряженных частиц приводит к образованию водородной связи.
59. Напишите схемы полного и неполного гидролиза аденозин-5′-фосфата.
Выделите сложноэфирную и гликозидную связи.
Назовите продукты реакций.
Укажите механизм реакций.
Ответ
Аденозин-5′-фосфат легко гидролизуется под влиянием слабых кислот при нагревании. При этом образуется аденозин, рибоза и фосфорная кислота. При неполном гидролизе могут образовываться различные продукты, в том числе аденозин и ортофосфорная кислота.
60. Напишите схему взаимодействия АТФ с a-аланином (образование аминоациладенилатного комплекса).
Назовите биологическую роль этого процесса.
Ответ
1. Схема взаимодействия АТФ с a-аланином (образование аминоациладенилатного комплекса).
2. Биологическая роль этого процесса –активирование аминокислоты для реакции биосинтеза.
61. Напишите строение антикодона в т-РНК, соответствующего кодону УГУ в и-РНК.
Ответ
Антикодоны тРНК комплементарны кодонам иРНК. Т.о. антикодон будет представлен последовательностью нуклеотидов, комплементарных урацилу, гуанину, урацилу. Таковыми нуклеотидами, соотвественно, являются: аденин (А), цитозин(Ц) и аденин (А). т.о., строение антикодона -АЦА
62. Напишите схему превращения яблочной (гидроксибутандиовой) кислоты в щавелевоуксусную (оксобутандиовую) кислоту с участием кофермента НАД + .
Укажите биологическое значение реакции.
Покажите строение НАД + .
Ответ
1. Схема превращения яблочной (гидроксибутандиовой) кислоты в щавелевоуксусную (оксобутандиовую) кислоту с участием кофермента НАД + .
2. Биологическое значение реакции: данная реакция входит в цикл Кребса, в ходе которого осуществляется биологическое окисление субстратов до воды и углекислого газа.
3. Строение НАД + (окисленная форма никотинамидадени́ндинуклеоти́да)
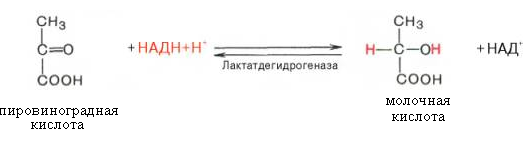
63. Напишите схему реакции превращения пировиноградной кислоты в молочную с участием кофермента НАДН.
Объясните возможность протекания обратного процесса.
Покажите строение НАДН.
1. Схема реакции превращения пировиноградной кислоты в молочную с участием кофермента НАДН.
2. Процесс превращения пировиноградной кислоты в молочную протекает в анаэробных условиях. Возможность протекания обратного процесса обусловлена действием фермента лактатдегидрогеназы.
3. Строение НАДН (восстановленная форма никотинамидадени́ндинуклеоти́да)
Видео:Лецитин- необходим или бесполезен?Скачать

Глицерофосфолипиды
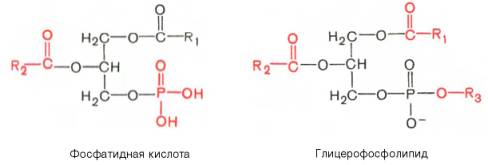
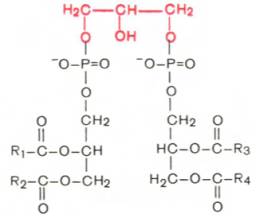
Глицерофосфолипиды являются производными фосфатидной кислоты. В их состав входят глицерин, жирные кислоты, фосфорная кислота и обычно азотсодержащие соединения. Общая формула глицерофосфолипидов выглядит так:
В этих формулах R1и R2– радикалы высших жирных кислот, a R3– чаще радикал азотистого соединения. Для всех глицерофосфолипидов характерно, что одна часть их молекул (радикалы R1и R2) обнаруживает резко выраженную гидрофобность, тогда как другая часть гидрофильна благодаря отрицательному заряду фосфорной кислоты и положительному заряду радикала R3.
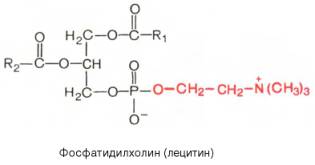
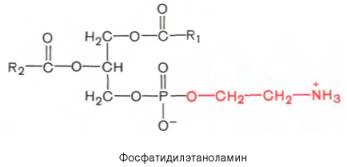
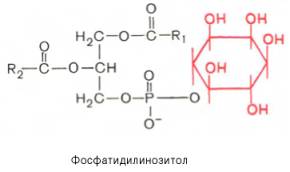
Из всех липидов глицерофосфолипиды обладают наиболее выраженными полярными свойствами. При помещении глицерофосфолипидов в воду в истинный раствор переходит лишь небольшая их часть, основная же масса липидов находится в виде мицелл. Существует несколько групп (подклассов) глицерофосфолипидов. В зависимости от характера азотистого основания, присоединенного к фосфорной кислоте, Глицерофосфо-липиды подразделяют на фосфатидилхолины (лецитины), фосфатидилэта-ноламины (кефалины) и фосфатидилсерины. В состав некоторых глицеро-фосфолипидов вместо азотсодержащих соединений входит не содержащий азота шестиуглеродный циклический спирт инозит, называемый также инозитолом. Эти липиды называются фосфатидилинозитолами.
Из глицерофосфолипидов в организме животных и высших растений в наибольшем количестве встречаются фосфатидилхолины и фосфатидил-этаноламины. Эти 2 группы глицерофосфолипидов метаболически связаны друг с другом и являются главными липидными компонентами мембран клеток.
Фосфатидилсерины распространены гораздо менее широко, чем фос-фатидилхолины и фосфоэтаноламины, и их значение определяется в основном тем, что они участвуют в синтезе фосфатидилэтаноламинов.
Фосфатидилинозитолы. Эти липиды относятся к группе производных фосфатидной кислоты, но не содержат азота. Радикалом (R3) в этом подклассе глицерофосфолипидов является шестиуглеродный циклический спирт инозитол:
Фосфатидилинозитолы довольно широко распространены в природе. Они обнаружены у животных, растений и микроорганизмов. В животном организме найдены в мозге, печени и легких.
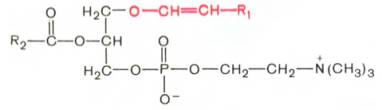
Плазмалогены. От рассмотренных глицеролипидов плазмалогены отличаются тем, что вместо одного остатка высшей жирной кислоты со-
держат остаток α,β-ненасыщенного спирта, который образует простую связь (в отличие от сложноэфирной связи, образуемой остатком жирной кислоты) с гидроксильной группой глицерина в положении С-1:
Основными подклассами плазмалогенов являются фосфатидальхолины, фосфатидальэтаноламины и фосфатидальсерины. В разбавленных кислотах плазмалогены гидролизуются с образованием альдегида соответствующего α,β-ненасыщенного спирта, т.е. при кислотном гидролизе плазмалогенов образуются «жирные» альдегиды, называемые плазмалями, что и легло в основу термина «плазмалоген».
Кардиолипин. Своеобразным представителем глицерофосфолипидов является кардиолипин, впервые выделенный из сердечной мышцы. По своей химической структуре кардиолипин можно рассматривать как соединение, в котором 2 молекулы фосфатидной кислоты связаны с помощью одной молекулы глицерина. В отличие от остальных глицерофосфолипидов кар-диолипин является как бы «двойным» глицерофосфолипидом. Кардио-липин локализован во внутренней мембране митохондрий. Функция его пока неясна, хотя известно, что в отличие от других фосфолипидов кардиолипин обладает иммунными свойствами.
Необходимо отметить, что в природе встречается свободная фосфатид-ная кислота, но в относительно небольших количествах по сравнению с глицерофосфолипидами. Среди жирных кислот, входящих в состав гли-церофосфолипидов, обнаружены как насыщенные, так и ненасыщенные (чаще стеариновая, пальмитиновая, олеиновая и линолевая).
Установлено также, что большинство фосфатидилхолинов и фосфати-дилэтаноламинов содержат одну насыщенную высшую жирную кислоту в положении С-1 и одну ненасыщенную высшую жирную кислоту в положении С-2. Гидролиз фосфатидилхолинов и фосфатидилэтаноламинов при участии особых ферментов (эти ферменты относятся к фосфолипазам А2), содержащихся, например, в яде кобры, приводит к отщеплению ненасыщенной жирной кислоты и образованию лизофосфолипидов – лизофосфатидилхолинов, или лизофосфатидилэтаноламинов, оказывающих сильное гемолитическое действие:
Видео:Биохимия | Синтез жиров и фосфолипидовСкачать

Органическая и биологическая химия (стр. 5 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 |
вую энергии, полученной от солнечного света, высвобождая ее в процессе дыхания. Этот процесс, в сущности, обратен процессу фотосинтеза:
C6H12O6 + 6 O2 ® 6CO2 + 6 H2O + энергия.
Углеводы, содержащиеся в растениях, служат также источником энергии для животных, питающихся растениями.
Название углеводов связано с тем, что большинство этих соединений имеет общую эмпирическую формулу Cn(H2O)m.
Углеводы принято подразделять на моносахариды, олигосахариды и полисахариды.
1. Моносахариды – углеводы, не способные подвергаться гидролизу. Общая формула моносахаридов CnH2nOn, где n= от 3 до 8. В зависимости от числа атомов углерода их делят на триозы (С3), тетрозы (С4), пентозы (С5), гексозы (С6) и т. д. Важным представителем пентоз является рибоза. Их общая формула C5H10O5. Моносахариды с общей формулой С6Н12О6 называются гексозами. К гексозам принадлежат глюкоза, фруктоза.
2. Олигосахариды представлены молекулами, содержащими от 2 до 10 моноз. Из этой группы углеводов наиболее распространены в природе дисахариды. Дисахариды образуются конденсацией двух моносахаридных фрагментов с одновременным отщеплением молекул воды. К дисахаридам принадлежат: лактоза, сахароза, мальтоза и
целлобиоза. Дисахариды, образующиеся из двух гексозных фрагментов, имеют общую формулу С12Н22О11.
Моносахариды и дисахариды представляют собой белые кристаллические вещества, растворимые в воде и имеющие сладкий вкус. Иначе их называют сахарами. Пищевой сахар представляет собой сахарозу.
3. Полисахариды могут рассматриваться как полимеры моносахаридов. Общая формула полисахаридов, образованных из гексозных фрагментов, имеет вид (С6Н10О5)n. Полисахариды могут состоять из одного или нескольких разных моносахаридных мономеров. Некоторые полисахариды содержат сотни или тысячи моносахаридных фрагментов и поэтому имеют высокие значения относительной молекулярной массы.
Двумя наиболее распространенными полисахаридами в природе являются целлюлоза и крахмал. Как правило, полисахариды нерастворимы в воде либо образуют в ней коллоидные растворы.
В первую очередь, необходимо разобраться в строении моноз, уяснить особенности строения ациклических и циклических форм.
Углеводы могут рассматриваться как альдегиды и кетоны, содержащие несколько гидроксильных групп. Моносахариды с альдегидной группой называются альдозы, а моносахариды с кетогруппой – кетозы.
Альдозы и кетозы содержат асимметрические атомы углерода. Для них известно большое число стереоизомеров (2n, где n – число асимметрических атомов). Например, альдогексозы имеют четыре асимметрических атома углерода. Существует восемь различных альдогексоз. Каждая из них имеет два оптических изомера. Таким образом, общее количество изомеров альдогексоз насчитывает 16. Наиболее важными из них являются два оптических изомера глюкозы.
Символы D — и L — указывают конфигурацию гидроксильной группы, присоединенной к атому С5.
Для углеводов характерен еще один вид структурной изомерии: циклоцепная таутомерия.
Циклизация моносахаридов происходит в результате того, что атом водорода гидроксильной группы (С5) присоединяется к кислороду альдегидной группы за счет разрыва p-связи, образуя так называемый полуацетальный (гликозидный) гидроксил.




HO–C–H О Н–С–ОН HO–C–H О






CH2OH H–C– OH CH2OH
b-D-глюкоза D-глюкоза a-D-глюкоза
В результате разрыва p-связи С1 образует связь с кислородом гидроксильной группы С5.
Если гликозидный гидроксил расположен так же, как и гидроксил, определяющий принадлежность к D — или L-ряду, то такая форма называется a-формой, если с противоположной стороны, то b-формой.
При изучении углеводов и их производных обратите внимание, что именно за счет этого гликозидного гидроксила идет образование сложных углеводов, глюкопротеидов, нуклеиновых кислот и других природных соединений.
Более наглядно строение молекулы углевода можно представить, используя так называемые перспективные формулы Хеуорса. атом кислорода расположен в правом верхнем углу. Заместители, которые были слева или справа в проекционных формулах, пишут соответственно сверху или снизу по отношению к плоскости кольца, изменяя положение заместителей у атома углерода за счет которого осуществляется циклизация. Шестичленные циклы называют пиранозами, а пятичленные – фуранозами.


При изучении химических свойств сахаров следует исходить из химических свойств функциональных групп, входящих в молекулу. Так, если молекула углевода содержит свободный гликозидный гидроксил, то в водном растворе она будет находиться в равновесии с открытой формой и давать реакции карбонильной группы, например, окисление. Следует учесть, что именно наличие или отсутствие свободного гликозидного гидроксила определяет дисахарид в группу восстанавливающих или невосстанавливающих сахаров.
К восстанавливающим дисахаридам относятся вещества, образующиеся при отщеплении воды за счет гликозидного гидроксила одной молекулы моносахарида и спиртового гидроксила другой (мальтоза, лактоза, целлобиоза). Такие дисахариды имеют один свободный гликозидный гидроксил, способный к таутомерным превращениям. Для них характерны типичные реакции на карбонильную группу: образование фенилгидразонов и озазонов, присоединение водорода и синильной кислоты, восстановление гидроксида меди и фелинговой жидкости, реакция серебряного зеркала и т. д.
К невосстанавливающим дисахаридам относятся вещества, образующиеся при отщеплении воды за счет полуацетальных гидроксилов обоих моносахаридов (сахароза). Сахароза состоит из остатков глюкозы и фруктозы. В дисахаридах этого типа нет свободного полуацетального гидроксила, они не способны к таутомерным превращениям, не дают характерных реакций на карбонильную группу и не обладают восстанавливающими свойствами. Они способны только к реакциям, обусловленным присутствием гидроксильных групп – образованию простых и сложных эфиров и сахаров.
Изучение полисахаридов надо начинать со знакомства с их строением, с отличительных особенностей структурных формул крахмала и клетчатки, знать особенности a — и b — гликозидных связей, а также биологическое и практическое значение этих полисахаридов. Обратить внимание на строение и свойства гетерополисахаридов: гиалуроновой кислоты, хондроитинсульфата, гепарина.
В процессе изучения сахаров обратите внимание на образование сложных эфиров, ибо они играют важную биохимическую роль (фосфорные эфиры в синтезе и распаде углеводов) и имеют большое народнохозяйственное значение (нитроклетчатка, ацетатное волокно, ацетобутират целлюлозы и т. д.).
Л и т е р а т у р а: [1, с. 360-385].
Вопросы для самопроверки
1. Напишите карбонильные формулы D-глюкозы, D-фруктозы, D-галактозы. Укажите, что есть общего в их строении.
2. Что такое L — и D-, a — и b — формы сахара? Укажите на конкретных примерах моносахаридов.
3. Напишите альдегидные и циклические формы глюкозы.
4. Мутаротация. Объясните это явление на примере глюкозы.
5. Какой гидроксил называется гликозид? Какие реакции свойственны сахарам по этому гидроксилу?
6. Напишите уравнения реакций образования сложных эфиров глюкозы и фруктозы с фосфорной кислотой.
7. Напишите формулы рибозы и дезоксирибозы в карбонильной и циклической формах.
8. Напишите уравнения реакций образования мальтозы и целлобиозы. Чем отличаются структурные формулы этих дисахаридов?
9. Укажите, какие дисахариды относятся к восстанавливающему и невосстанавливающему типу. Приведите примеры восстанавливающих и невосстанавливающих дисахаридов.
10. Гидролиз крахмала и клетчатки. Какие промежуточные и конечные продукты при этом образуются?
11. Строение гликогена и его биологическая роль.
12. Напишите структурные формулы гетерополисахаридов.
1.4. Липиды, их распространение в природе
и биологическая роль
К липидам относятся жиры и жироподобные вещества растительного и животного происхождения. Обычно их подразделяют на две подгруппы: простые липиды – жиры и сложные липиды, к которым часто относят и свободные длинноцепочные кислоты жиров, стеарины, воски.
Природные животные и растительные жиры (масла) представлены,
в основном, сложными эфирами глицерина и высших жирных кислот. В общем случае они называются триацилглицерины. Общая формула триацилглицеринов:
где R, R¢, R¢¢ – углеводородные радикалы высших жирных кислот.
Наиболее часто в состав триацилглицеринов входят кислоты с длинной цепи С10–С18, например, олеиновая, линолевая, линоленовая, стеариновая, пальмитиновая.
Изучая этот раздел, обратите внимание на состав жиров, распространение в природе, классификацию жиров, отличие жидких жиров от твердых и превращение первых во вторые (реакции гидрогенизации), реакции гидролиза.
Сложные липиды дают при гидролизе, кроме глицерина и высших монокарбоновых кислот, фосфорную кислоту и аминоспирты, или
другие сложные спирты. Примерами могут быть лецитины, кефалины, серинфосфатиды, фосфосфингозиды, цереброзиды.
Цереброзиды – это сложные липиды, относящиеся к классу гликозидов. Они содержат сфингозин, жирную кислоту и сахар (D-глюкозу или D-галактозу). Фосфорная кислота в их состав не входит. Обратите внимение на строение и биологическое назначение стероидов на примере всего холестерина.
Л и т е р а т у р а: [1, с. 313-324].
Вопросы для самопроверки
1. Классификация липидов.
2. Перечислите основные высокомолекулярные жирные кислоты, входящие в состав жиров.
3. Напишите уравнение реакции получения тристеарина.
4. Охарактеризуйте и сравните физические свойства природных жиров.
5. Дайте аналитическую характеристику жиров.
6. Мыла, их состав, твердые и жидкие мыла.
7. Строение сложных липидов. Напишите уравнение реакции образования лецитина (фосфатидилхолин) и кефалина (фосфатидилэтаноламин).
8. Напишите формулу холестерина и определите его биологическую роль.
1.5. Аминокислоты. Пептиды. Белки
Аминокислотами называют соединения, содержащие в молекуле одновременно амино — и карбоксильные группы. Они имеют неоценимое значение в жизнедеятельности организмов, так как из их остатков построены белки. Аминокислоты, входящие в состав белков, являются a-аминокислотами и относятся к L-ряду.
Различаются природные аминокислоты по характеру углеводородного радикала, содержащего разные углеводородные остатки и функциональные группы (–ОН, –SH, –S–CH3 и т. д.).
Для природных аминокислот используют в основном тривиальные названия.
CH2–COOH; CH3–CH–COOH; HO–CH2–CH–COOH.
глицин аланин серин
(аминоуксусная (2-аминопропановая (3-окси-2-аминопропановая
кислота) кислота) кислота)
Среди аминокислот, входящих в состав белков, выделяют заменимые и незаменимые (не синтезируются в организме животных и человека).
При изучении свойств аминокислот следует помнить, что наличие в их молекуле кислотных и основных групп определяет амфотерный характер этих соединений. Они могут давать соли как с кислотами, так и с основаниями, проявляя при этом и другие свойства аминов и кислот.
Аминокислоты имеют солеобразное строение, образуя внутренние соли.
R–CH–COOH

Это в значительной мере определяет их физические свойства: кристаллическая структура, высокие температуры плавления, хорошая растворимость в воде.
Как бифункциональные соединения, аминокислоты способны вступать в реакцию конденсации:



В результате образуются ди-, три — и полипептиды, связанные между собой пептидной связью (–C–N–).
Пептиды – это основа белков. Короткоцепочные полипептиды называют по тем аминокислотам, которые его образуют, только у названия аминокислоты, карбоксильная группа которой участвует в образовании пептидной связи, суффикс –ин меняется на –ил.
Разберитесь в строении природных полипептидов (глутатион, карнозин, ансерин и др.).
Белки входят в состав всех живых организмов и представляют собой биополимеры a-аминокислот. Необходимо разобраться в строении
белков, классификации (простые и сложные) и в физических и химических свойствах белков. Знать основные качественные реакции на белки (биуретовая, ксантопротеиновая, нингидриновая и т. д.).
Л и т е р а т у р а: [1, с. 385-411].
Вопросы для самопроверки
1. Как подразделяются аминокислоты в зависимости от углеродного радикала, количества карбоксильных и аминных групп, входящих в молекулы аминокислот?
2. Напишите реакции диссоциации аминокислот. Объясните, почему они обладают амфотерными свойствами.
3. Напишите, какие аминокислоты имеют нейтральную, кислую и основную среду, чем объясняется характер среды.
4. Напишите уравнение реакции взаимодействия аспарагиновой кислоты с NaOH и HCl.
5. Какие соединения называются полипептидами?
6. Номенклатура полипептидов.
7. Напишите уравнение реакции получения трипептида из метионина, валина и серина.
8. Строение глутатиона и его биологическая роль.
9. Классификация белков. Какие белки называются простыми и сложными?
10. Строение белковой молекулы: первичная, вторичная, третичная, четвертичная структуры белков.
11. Назовите основные качественные реакции на белки.
1.6. Нуклеиновые кислоты
Нуклеиновые кислоты входят в состав растительных и животных клеток, принимают участие в передаче наследственных признаков и синтезе белка.
В основе молекулы нуклеиновой кислоты лежат длинные цепи пентоз: b-D-рибофуранозы и 2-дезокси-b-D-рибофуранозы и молекул фосфорной кислоты, соединенных посредством эфирных связей:
гетероцикл гетероцикл гетероцикл


сахар ОН сахар ОН сахар
Необходимо разобраться в классификации нуклеиновых кислот. Уясните, чем отличаются по строению ДНК и РНК, нуклеозиды и нуклеотиды.
Нуклеозиды представляют собой N-гликозиды, где неуглеводная часть (агликон) представлена остатками гетероциклов (аденин, гуанин, тимин, цитозин, урацил).








 |


Нуклеотиды образуются за счет присоединения фосфорной кислоты к нуклеозиду через гидроксил у пятого углеродного атома пентозы:


 |

нуклеотид 5-гуанозилмонофосфат (ГМФ)
Кроме того, что нуклеотиды являются основным строительным блоком НК, они в живой клетке выполняют ряд других функций и имеют свои особенности строения.
Л и т е р а т у р а: [1, с. 438-447].
Вопросы для самопроверки
1. Напишите гетероциклические основания, входящие в состав ДНК, РНК.
2. Нуклеозиды, их химическое строение, номенклатура.
3. Нуклеотиды, химическое строение, номенклатура.
4. ДНК, первичная, вторичная и третичная структуры. Понятие о кодонах и генах.
5. РНК, особенности химического строения. Виды РНК.
6. В чем особенности строения и роль свободных нуклеотидов в живой клетке (АТФ, АМФ и т. д.)?
2. СТАТИЧЕСКАЯ БИОХИМИЯ
Ферменты или энзимы – это специфические белки, вырабатываемые всеми живыми клетками и выполняющие роль биокатализаторов.
Вещества, которые в клетке подвергаются превращению при участии ферментов, называют субстратом данного фермента.
По химической природе ферменты являются белками и, как обыч-
ные белки, подразделяются на простые (протеины) или однокомпонентные и сложные (протеиды) или двухкомпонентные. Однокомпонентные ферменты построены только из остатков аминокислот. Двухкопонентные, кроме белковой части (апофермент), содержат небелковую часть (кофактор). Объединяясь, апофермент и кофактор образуют активную молекулу двухкомпонентного фермента, названную холофермент. В качестве кофактора могут выступать вещества неорганической природы – ионы металлов (Zn2+, Mg2+, Fe2+, Cu2+ и другие) и органической природы. В составе последних чаще выступают остатки водорастворимых витаминов. Например, кофермент ацилирования содержит остаток витамина В3, тиаминпирофосфат и пиридоксальфосфат – это фосфорные эфиры соответственно витаминов В1 и В6. Нуклеотиды НАД и ФАД содержат остатки витаминов В5 и В2 . Помимо витаминов, кофакторами могут выступать органические кислоты (липоевая кислота), фосфорные эфиры сахаров, свободные нуклеотиды и т. д.
📹 Видео
ЛЕЦИТИН - почему его нужно принимать всем? ДОЗИРОВКИ. ПОЛЕЗНЫЕ СВОЙСТВА. Комментирует нутрициологСкачать

Лецитин Как Принимать и Какой Лучше ВыбратьСкачать

100 фактов о ЛЕЦИТИНЕ или о чем МОЛЧАТ ВРАЧИ !!!Скачать

Преимущества Лецитина в борьбе с хроническими заболеваниями и тканевым разрушениемСкачать

Лекция 9.5. Синтез ТАГ и фосфолипидов Липотропные факторыСкачать

Лецитин польза • Iherb Айхерб • лучшее с iherb • лучшие витамины и препараты с АйхербСкачать

Биохимия. Лекция 58. Липиды. Обмен триацилглицеролов и фосфолипидов. Кетоновые тела. Жирные кислотыСкачать

Академик Бутакова Ольга о роли ЛецитинаСкачать

о Лецитине. доктор медицины, профессор Владимир Подхомутников и кмн Ольгя ПодхомутниковаСкачать

Биохимия. Лекция 57. Липиды. Обмен триацилглицеролов и фосфолипидов. Окисление жирных кислотСкачать

Лецитин. Самая умная и универсальная добавка! Must have, как говорят...Скачать

Лекция 3 ВЖК Липиды ФосфолипидыСкачать

Польза лецитина / Как я похудела на 94 кг и улучшила моё здоровьеСкачать

КОРОТКО О ПОЛЬЗЕ ЛЕЦИТИНА!Скачать

Продукция NSP. Лецитин (Lecithin) - что это такое, кому и зачем нужен? Смирнова НинаСкачать

Реакция Фоля на цистеин и цистинСкачать

Лецитин-инструкция. Как принимать лецитин при жировом гепатозе и для поддержки нервной системыСкачать

ЛецитинСкачать