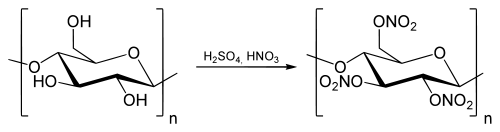
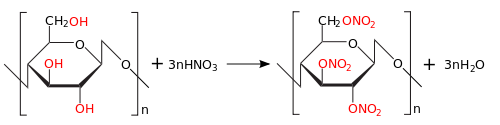Целлюлоза с азотной кислотой образует азотнокислые эфиры. Целлюлоза в нашем опыте — хлопковая вата.
Приготовим такую смесь и опустим в нее кусочек ваты. Через 15 минут
процесс нитрования целлюлозы заканчивается. Промоем полученную нитроцеллюлозу
водой. Высушим. Нитроцеллюлоза при поджигании быстро сгорает. Нитроцеллюлоза
используется для приготовления бездымного пороха.
Вам понадобится: азотная и серная кислота. Их можно купить в химическом магазине.
Нитроцеллюлоза — волокнистая рыхлая масса белого цвета, по внешнему
виду похожа на целлюлозу. Одна из важнейших характеристик — степень
замещения гидроксильных групп на нитрогруппы.
Лучшим сырьём для производства нитроцеллюлозы считаются длинноволокнистые сорта хлопка
ручной сборки. Хлопок машинной сборки и древесная целлюлоза содержат
значительно количество примесей, усложняющих подготовку и снижающих
качество продукции. Нитроцеллюлозу получают действием на очищенную,
разрыхленную и высушенную целлюлозу смесью серной и азотной кислот,
называемой нитрующей смесью. Концентрация применяемой азотной кислоты
обычно выше 77 %, а соотношение кислот и целлюлозы может быть от 30:1
до 100:1.Полученный после нитрования продукт подвергается
многоступенчатой промывке, обработке слабокислыми и слабощелочными
растворами, измельчению для повышения чистоты и стойкости при хранении.
Сушка нитроцеллюлозы — сложный процесс, иногда совместно с сушкой
применяется обезвоживание . Практически вся нитроцеллюлоза после получения используется в
производстве различных продуктов. В случае необходимости хранится во
влажном состоянии с содержанием воды или спирта не ниже 20 %.
Серная Кислота (H2SO4) 98% концетрации
Азотная Кислота(HNO3) 68% концетрации
Вата
Смешивал их в пропорции 7:3(70% Серной и 30% Азотной)
Я рассчитывал на 300мл, поэтому взял 90мл 68% Азотной:
И добавил туда 210 мл 98% Серной:
Все это дело немного разогрелось и я, закрыв крышкой, поставил это в морозилку.
На
следующий день я приготовил на столе обычную вату (целлюлозу) и стакан
на 500мл + две чашки Петри, одна как подставка для стакана, а вторая в
дальнейшем сыграет роль крышки
После того как содержимое бутылки я перелил в стакан, я начал туда кидать маленькими кусочками вату.
Кидал
до того момента, пока вся вата не заполнила стакан. Смысл в том, чтоб
вся вата была пропитана нитровальной смесью(Азотка и серка):
Ну
а дальше поставил в шкаф ( темное и прохладное место ). Все это дело
должно храниться минимум 5-6 часов, но можно и день, и два ( испытано, хуже не становится). Один раз у меня это все неделю лежало в шкафу, так
как не было времени достать и промыть, и ни чего не испортилось.
Ну
а дальше все промываем. Разумеется, надеваем перчатки на руку и
какую-нибудь тряпку на лицо + Защитные очки! Достаем из стакана
вату ( по кусочкам ) и быстро промываем под холодной водой! Очень важно
сделать все быстро, так как при попадании на ватку воды кислота в ней
нагревается и может привести к потере продукта и его качеству. Вата
начинает желтеть или ещё хуже, просто «сгорает» в горячей кислоте!
Поэтому важно промывать именно маленькие порции, чтоб избежать большого
количества кислоты, так как маленькое количество смыть намного проще,
чем большое. Ну и после промывки рекомендуется промыть вату раствором
пищевой соды, но и, разумеется, промыть опять (от соды)
После всех этих промывок от кислоты, вату хорошенько выжимаем и вываливаем на листок бумаги:
Потом
самая важная деталь — чтоб вата получилась как надо, её надо хорошенько
разжать, чтоб она была такая воздушная, как и с самого начала:
На
этой фотке вата ещё мокрая, но уже приняла свой объем, после того как
она высохнет её уже будет очень сложно отличить от обычной ваты, но она
горит намного лучше, чем обычная вата.
На фото сжигание ваты на ладони
Из-за очень высокой скорости горения она не успевает обжечь руку( тоже самое, что провести над зажигалкой палец )
Разумеется,
сначала она испытывается на железной пластине(а то мало ли что) и
только когда вы видите, что кусочек этой ваты сгорает моментально с
легким хлопком, можете смело сжигать её на ладони!
Авторы фото инструкции: Serega & Trip.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Нитроцеллюлоза
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

История открытия
Нитроцеллюлоза — один из первых искусственных полимеров.
- 1832 — французский химик Анри Браконно обнаружил, что при обработке крахмала и древесных волокон азотной кислотой образуется нестойкий горючий и взрывоопасный материал, который он назвал ксилоидин (Xyloїdine)
- 1838 — другой французский химик, Теофиль-Жюль Пелуз, обработал подобным образом бумагу и картон и получил похожий материал, названный им Нитрамидин (Nitramidine). Низкая стабильность полученной нитроцеллюлозы не позволяла использовать её в технических целях.
- 1846 — швейцарский химик Кристиан Фридрих Шёнбейн случайно обнаружил более практичный способ получения нитроцеллюлозы. Во время работы в кухне он пролил концентрированную азотную кислоту на стол. Для удаления кислоты химик воспользовался хлопковой тряпкой, а затем повесил её сушиться на печь. После высыхания ткань сгорела со взрывом. Шёнбейн разработал первый приемлемый способ получения нитроцеллюлозы — обработкой одной части хлопковых волокон в пятнадцати частях смеси серной и азотной кислот в соотношении 50:50. Азотная кислота реагировала с целлюлозой с образованием воды и серная кислота была необходима для предотвращения разбавления. После нескольких минут обработки хлопок удалялся из кислоты, промывался в холодной воде до удаления кислот и высушивался.
Полученный новый материал незамедлительно был применён в производстве пороха под названием ружейного хлопка (Guncotton). Нитроцеллюлоза давала в 6 раз больший объём продуктов горения, чем дымный порох, намного меньше дыма и меньше нагревала оружие. Однако производство её было крайне опасным и сопровождалось многочисленными взрывами на производствах. Дальнейшие исследования показали, что ключевую роль в опасности производства играет чистота сырья — если хлопок не был тщательно очищен и высушен, происходили внезапные взрывы.
1869 — в Англии под руководством Фредерика Августа Абеля была разработана технология с измельчением нитроцеллюлозы в специальных аппаратах- голландерах и многократными (до 8 раз) длительными промывками и сушками, каждая из которых длилась до 2 суток. Голландер представляет собой овальную в сечении ванну с закрепленными в ней поперечными ножами. Сбоку от ножей проходит вал с волнистыми дисковыми ножами. При вращении вала ножи вала проходят в промежутках между неподвижными ножами и режут волокно нитроцеллюлозы. Соотношение серной и азотной кислот в смеси было изменено до 2:1. По такой технологии удавалось получать достаточно стабильный при хранении и применении продукт.
Спустя десять лет после патентования этой технологии во всем мире начали принимать на вооружение пироксилин, сначала в качестве начинки снарядов и морских мин. Другое применение, которое коллоксилин нашел практически сразу — производство клея для заклеивания небольших ранок. За неимением пластыря (в нашем сегодняшнем понимании), этот клей достаточно быстро обрел популярность. Фактически, это была разновидность густого нитролака.
Последовавшая в течение нескольких лет после этого серия взрывов на предприятиях и складах, занятых процессами с участием пироксилина, заставили пристальнее взглянуть на проблему стабилизации этого продукта. Несмотря на все сложности, с 1879 года и по сей день нитраты целлюлозы находят широкое применение в технологии энергонасыщенных соединений и многих других областях промышленности.
Видео:Получение НИТРОЦЕЛЛЮЛОЗЫ. Реакция целлюлозы (ваты) азотной и серной кислот. Опыты по химии.Скачать

Производство
Guncotton
В целом хлопок использовался в качестве основы целлюлозы и добавлен к сконцентрированной серной кислотной и 70%-й азотной кислоте, охлажденной к 0°C, чтобы дать целлюлозу trinitrate (или ‘guncotton’). В то время как guncotton опасен для магазина, его риск может быть снижен, храня заглушенный со множеством жидкостей. Поэтому счета guncotton использования, датирующегося с начала 20-го века, относятся к «влажному guncotton».
Фильм нитрата
Целлюлозу рассматривают с серным нитратом кислоты и калия, чтобы дать мононитрат целлюлозы. Это использовалось коммерчески в качестве ‘целлулоида’, очень легковоспламеняющаяся пластмасса, используемая в первой половине 20-го века для лаков и фотопленки.
Видео:25. Схема реакции и химическое уравнениеСкачать

Нитрование — целлюлоза
При нитровании целлюлозы особенное значение имеет содержание воды в применяемой для нитрования кислоте.
При нитровании целлюлозы азотной кислотой или нитрующими смесями наряду с основным процессом этерификации происходят побочные процессы окисления и гидролиза целлюлозы. Эти процессы протекают тем интенсивнее, чем больше содержание воды и серной кислоты в нитрующей смеси, чем выше температура реакции и чем ниже впитывающая способность целлюлозного материала по отношению к нитрующей смеси.
При нитровании целлюлозы в особых условиях могут быть получены нитраты целлюлозы более высокой степени этерификации ( содержание азота 12 5 — 12 7 %), полностью растворимые в спир-то-эфирной смеси. Такие нитраты были получены Д. И. Менделеевым и названы им пироколлодием.
Когда для нитрования целлюлозы применяется не азотная кислота, а ее ангидрид, реакция не сопровождается выделением воды и поэтому необратима.
Когда для нитрования целлюлозы применяется не азотная кислота, а ее ангидрид, реакция не сопровождается выделением воды и поэтому необратима.
Смесь продуктов нитрования целлюлозы с большим процентным содержанием азота ( 13 — 13 6 %) называется пироксилином. Спрессованный в шашки пироксилин применяется как взрывчатое вещество для взрывных работ. Для стрельбы из огнестрельных орудий чистый пироксилин непригоден, так как взрывается слишком быстро. Для замедления быстроты взрыва пироксилин обрабатывают спиртом, эфиром и другими веществами, и из полученной пластичной массы изготовляют ленты и трубки так называемого бездымного пороха.
Смесь продуктов нитрования целлюлозы с большим содержание ( в %) азота ( 13 %), называемая пироксилином, очень взрывчата. Спресс ванный в шашки пироксилин применяется как взрывчатое вещество дл горных работ.
Смесь продуктов нитрования целлюлозы с большим процентным содержанием азота ( 13 — 13 6 %) называется пироксилином. Спрессованный в шашки пироксилин применяется как взрывчатое вещество для взрывных работ. Для стрельбы из огнестрельных орудий чистый пироксилин непригоден, так как взрывается слишком быстро. Для замедления быстроты взрыва пироксилин обрабатывают спиртом, эфиром и другими веществами, и из полученной пластичной массы изготовляют ленты и трубки так называемого бездымного пороха.
В продуктах нитрования целлюлозы МО2 — группа связана с атомом углерода через атом кислорода, это сложные эфиры целлюлозы — нитраты.
Механизм реакции нитрования целлюлозы исследован до настоящего времени недостаточно.
Поэтому процесс нитрования целлюлозы азотной кислотой обратим.
Механизм реакции нитрования целлюлозы исследован до настоящего времени недостаточно.
Поэтому процесс нитрования целлюлозы азотной кислотой обратим.
Основная операция нитрования целлюлозы проводится в специальных аппаратах — нитраторах
Так как эта реакция является гетерогенной и экзотермической ( к тому же образующиеся продукты способны легко воспламеняться и взрываться), то необходимо особое внимание уделять дозировке компонентов, температуре, скорости перемешивания, технике безопасности и пр.
. Обычно при нитровании целлюлозы образуется смесь полных и неполных азотнокислых эфиров
Смесь, содержащая около 13 % азота, называется пироксилином.
Обычно при нитровании целлюлозы образуется смесь полных и неполных азотнокислых эфиров. Смесь, содержащая около 13 % азота, называется пироксилином.
Видео:Какие продукты образуются при нитровании целлюлозы? 1) мононитроцеллюлоза; 2) динитроцеллюлоза;Скачать

Тринитроцеллюлоза
Тринитроцеллюлоза содержит по три ни-тратогруппы — О — N08 на каждый остаток глюкозы; ее называют также пироксилином, применяют для приготовления бездымного пороха. Динитро-целлюлоза содержит по две нитратогруппы на каждый остаток глюкозы, иначе называется коллоксилином, применяют для производства целлулоида, нитролаков, пороха, динамита и других взрывчатых веществ.
Тринитроцеллюлоза , в которой на каждую молекулу глюкозы приходится три остатка азотной кислоты, содержит достаточно азота, чтобы быть взрывчатой в такой же мере, как Тринитроглицерин; она известна под названием пироксилинового, пли бездымного, пороха.
Тринитроцеллюлоза представляет собой взрывчатое вещество — пироксилин. Пироксилин плохо растворяется в органических растворителях.
Дифракция электронов тринитроцеллюлозой ( совместно с В.
Тринитрат целлюлозы ( тринитроклетчатка, тринитроцеллюлоза )
| График функции — /, входящей.| График функции ср, входящей в соотношение. |
На примере дезо-ксирибонуклеиновой кислоты и тринитроцеллюлозы в показано, что такая процедура дает значения R2, находящиеся в удовлетворительном согласии с полученными методом светорассеяния.
| Межплоскостные расстояния для тринитроцеллюлозы ( А. |
Путем сравнения рентгенограмм и электронограмм тринитроцеллюлозы Каргиным, Карповым и Пинскером было найдено, что ширина интерференции не зависит от длины волны и что, следовательно, данное вещество является аморфным. То обстоятельство, что при этом сравнивались те же интерференции, подтверждается таблицей 1, характеризующей значения межплоскостных расстояний для одного и того же препарата тринитроцеллюлозы ( 13 65 % азота) в виде волокнистого вещества, высаженного из раствора.
Вычислите массу раствора 62 % — ной азотной кислоты, которая необходима для получения 118 8 г тринитроцеллюлозы .
При обработке смесью азотной и серной кислот происходит нитрация целлюлозы — получаются азотнокислые эфиры мо-но -, ди — и тринитроцеллюлоза .
| Рассеяние электронов гидратцеллюлозой. |
Основываясь на данных, полученных в работе Каргина, Карпова и Пин-скер , Какиноки провел исследование дифракции быстрых электронов в тонких пленках тринитроцеллюлозы .
Обычно получают смеси азотнокислых эфиров целлюлозы, состав которых характеризуется содержанием азота. Теоретически тринитроцеллюлоза в соответствии с указанной формулой должна содержать 14 14 % азота. Однако в практике не достигается этери-фикация всех групп ОН в целлюлозе.
Обычно получаются смеси азотнокислых эфиров целлюлозы, состав которых характеризуется содержанием азота. Теоретически тринитроцеллюлоза в соответствии с указанной формулой должна содержать 14 14 % азота. Однако в практике не достигается этери-фикация всех групп ОН в целлюлозе. Нитроцеллюлоза с наибольшим содержанием азота ( около 13 — 13 5 %), по составу близкая к тринитроэфиру, представляет собой огнеопасное, сильно взрывчатое вещество ( пироксилин) и применяется для изготовления бездымного пороха.
Видео:17.1 Древесина и целлюлоза | Химия вокруг насСкачать

Применение
Нитроцеллюлоза производится в больших количествах во многих странах мира и находит много различных применений:
- Бездымный порох, обычно пироксилин. За более чем 100-летнюю историю развития химии и технологии предложены тысячи разнообразных составов, многие из которых производились десятками и сотнями тысяч тонн (баллистит, кордит).
- Взрывчатые вещества. Нитроцеллюлоза в чистом виде из-за низкой термической стойкости не применяется, но существует неисчислимое множество реальных и фантастических взрывчатых составов с её применением. В 1885 году была впервые получена смесь нитроцеллюлозы с нитроглицерином, названная «гремучим студнем».
- Ранее использовалась как подложка . В связи с горючестью была вытеснена ацетилцеллюлозой и полиэтилентерефталатом (лавсаном).
- Целлулоид. До сих пор лучшие шарики для настольного тенниса производятся из нитроцеллюлозы.
- Нитроцеллюлозные мембраны для иммобилизации белков.
- В индустрии развлечений для производства быстросгорающих предметов в реквизите артистов иллюзионного жанра.
- Нитроцеллюлозные мембраны используют для гибридизации нуклеиновых кислот, например, при Саузерн-блоттинге.
- Плёнкообразующая основа нитроцеллюлозных лаков, красок, эмалей.
Видео:Как написать уравнения реакции полимеризации?Скачать

Тринитрат — целлюлоза
Тринитрат целлюлозы — сильное взрывчатое вещество, применяется для приготовления порохов.
Тринитрат целлюлозы ( тринитроклетчатка, тринитроцеллюлоза)
Тринитрат целлюлозы для исследовательских целей ( содержание N равно 14 14 %) получают путем нитрации смесями азотной, уксусной либо фосфорной кислот и уксусного либо фосфорного ангидрида. Нитрацию проводят при низких температурах, в условиях наименьшей деструкции целлюлозы. Это позволяет определить среднюю степень полимеризации целлюлозы, исходя из вязкости растворов ее нитратов, а также проводить фракционирование по степени полимеризации.
Получающийся тринитрат целлюлозы — пироксилин — является важным взрывчатым веществом. Коллоксилин не обладает свойствами взрывчатого вещества.
| Зависимость характеристической вязкости и радиуса инерции от. |
Свойства тринитрата целлюлозы кратко описаны в , стр.
Нитроклетчатка, или тринитрат целлюлозы , выглядит как обычная вата, но обладает взрывчатыми свойствами. Нитроклетчатку применяют для изготовления взрывчатых веществ и порохов, смешивая ее в различных отношениях с нитроглицерином.
Хотя данные для тринитрата целлюлозы охватывают приблизительно два порядка значений молекулярного веса, тем не менее, в пределах ошибки опыта, в каждом случае все точки ложатся на одну прямую. Наклон кривой свидетельствует о значительном отклонении конфор-мации макромолекулы от статистического распределения сегментов в клубке. Можно ожидать, что в растворах тринитратов целлюлозы более высоких молекулярных весов, когда конформация цепи приближается к модели статистического клубка, показатель а будет иметь более низкие значения. Этот вопрос кратко рассматривается ниже.
Продукт полной этерификации — тринитрат целлюлозы — должен содержать в соответствии с формулой 14 1 % азота. На практике получают продукт с несколько меньшим содержанием азота ( 12 5 — 13 5 %), известный в технике под названием пироксилин.
Продукт полной этерификации — тринитрат целлюлозы ( трини-троклетчатка) — должен содержать в соответствии с формулой 14 1 % азота. На практике получают продукт с несколько меньшим содержанием азота ( 12 5 — 13 5 %), известный в технике под названием пироксилин. При обработке эфиром пироксилин желатинируется, а после испарения растворителя остается компактная масса. Мелко нарезанные кусочки этой массы и есть бездымный порох.
Продукт полной этерификации — тринитрат целлюлозы ( трини-троклетчатка) — должен содержать в соответствии с формулой 14 1 % азота. На практике получают продукт с несколько меньшим содержанием азота ( 12 5 — 13 5 %), известный в технике под названием пироксилин. При обработке эфиром пироксилин желатинируется, а после испарения растворителя остается компактная масса. Мелко нарезанные кусочки этой массы и есть бездымный порох.
Продукт полной этерификации — тринитрат целлюлозы ( трини-троклетчатка) — должен содержать в соответствии с формулой 14 1 % азота. На практике получают продукт с несколько меньшим содержанием азота ( 12 5 — 13 5 %), известный в технике под названием пироксилин. При обработке эфиром пироксилин желатинируется, а после испарения растворителя остается компактная масса.
Для оценки молекулярной массы тринитрата целлюлозы в тетрагидрофуране были найдены вискозиметрические константы.
Полная степень превращения целлюлозы в тринитрат целлюлозы требует особых условий.
| Области применения различных марок коллоксилина. |
Видео:Реакция полимеризации. 9 класс.Скачать

Получение
Лучшим сырьём для производства нитроцеллюлозы считаются длинноволокнистые сорта хлопка ручной сборки. Хлопок машинной сборки и древесная целлюлоза содержат значительное количество примесей, усложняющих подготовку и снижающих качество продукции. Нитроцеллюлозу получают действием на очищенную, разрыхлённую и высушенную целлюлозу смесью серной и азотной кислот, называемой нитрующей смесью, или «меланжем»:
Ниже приведена реакция получения тринитроцеллюлозы в лабораторных условиях:
Концентрация применяемой азотной кислоты обычно выше 77 %, а соотношение кислот и целлюлозы может быть от 30:1 до 100:1. Полученный после нитрования продукт подвергается многоступенчатой промывке, обработке слабокислыми и слабощелочными растворами, измельчению для повышения чистоты и стойкости при хранении. Сушка нитроцеллюлозы — сложный процесс, иногда совместно с сушкой применяется обезвоживание (этанолом, спирто-эфирными смесями). Практически вся нитроцеллюлоза после получения используется в производстве различных продуктов. В случае необходимости хранится во влажном состоянии с содержанием воды или спирта не ниже 20 %.
Видео:Крахмал. Целлюлоза. 11 класс.Скачать

Общие сведения
Нитроцеллюлоза — волокнистая рыхлая масса белого цвета, по внешнему виду похожа на целлюлозу. Одна из важнейших характеристик — степень замещения гидроксильных групп на нитрогруппы. В практике чаще всего применяется не прямое обозначение степени замещения, а содержание азота, выраженное в процентах по массе. В зависимости от содержания азота различают[источник не указан 1670 дней]
- коллоксилин (10,7 — 12,2 % азота)
- пироксилин № 2 (12,05 — 12,4 % азота)
- пироколлодий (12,6 % азота) — особый вид нитроцеллюлозы, впервые полученный Д. И. Менделеевым, нерастворим в спирте, растворяется в смеси спирта с эфиром.
- пироксилин № 1 (13,0 — 13,5 % азота)
Соратник Менделеева И. М. Чельцов в своей статье для ЭСБЕ перечисляет следующие азотные эфиры целлюлозы:
| Тривиальное название | Химическая формула | Содержание азота | Содержание N, измеренное экспериментально |
|---|---|---|---|
| 12-азотная клетчатка | С24Н28О8(NO3)12 | 14,14% | 13,91% |
| 11-азотная клетчатка | С24Н29О9(NO3)11 | 13,47% | 13,3% |
| 10-азотная клетчатка | С24Н30О10(NO3)10 | 12,75% | 12,5%—12,7% |
| 9-азотная клетчатка | С24Н31О11(NO3)9 | 11,96% | |
| 8-азотная клетчатка | С24Н32О12(NO3)8 | 11,11% | |
| … | и так далее | … | |
| 4-азотная клетчатка | С24Н36О16(NO3)4 | 6,76% |
Плотность 1,58 — 1,65 г/см³. Степень полимеризации коллоксилина 150—600 (молекулярная масса 37500 — 150000 а. е. м.), пироксилинов 1000—2000 (молекулярная масса 250000-500000 а. е. м.). Универсальный растворитель для всех видов нитроцеллюлозы — ацетон. В воде и неполярных растворителях (бензол, четырёххлористый углерод) нитроцеллюлоза не растворяется. Растворимость нитроклетчатки в полярных растворителях зависит от содержания азота. В кислых и щелочных средах она имеет низкую химическую стойкость.
Температура начала разложения сухой нитроцеллюлозы 40 — 60 °C, при быстром нагреве может произойти вспышка и взрыв. Самовозгорание сухой нитроцеллюлозы стало причиной многих техногенных катастроф, от взрывов пороховых заводов в XIX веке до взрывов в Тяньцзине в 2015 году.
Видео:78. Что такое реакции полимеризацииСкачать

Нитраты целлюлозы
Министерство образования Российской Федерации
Алтайский государственный технический университет
Видео:Химия. 11 класс. Целлюлоза /12.03.2021/Скачать

Бийский технологический институт
Видео:Химия, 12-й класс, ЦеллюлозаСкачать

НИТРАТЫ ЦЕЛЛЮЛОЗЫ
Практикум для студентов специальности 251200
по курсу “Физика и химия полимеров. Технология эфиров
Дементьева целлюлозы: Практикум для студентов специальности 251200 по курсу “Физика и химия полимеров. Техноло-гия эфиров целлюлозы”.
Алт. гос. техн. ун-т, БТИ. — Бийск.
Изд-во Алт. гос. техн. ун-та, 2001.- 27c.
В учебно-практическом издании изложены общие сведения о нитратах целлюлозы, современная теория нитрования целлюлозы, факторы, влияющие на процесс нитрования, технология получения нитратов целлюлозы, методики проведения лабораторных работ и правила по технике безопасности при проведении работ.
Учебно-практическое издание может быть использовано для самостоятельной работы студентов.
Рассмотрен и одобрен
на заседании кафедры ХТ ВМС
Протокол № 000 от 01.01.2001.
Рецензент: профессор БТИ АлтГТУ, к. т.н.
Ó БТИ АлтГТУ, 2001
Видео:52. Сахароза. Крахмал. Целлюлоза (часть 3)Скачать

ВВЕДЕНИЕ
Нитраты целлюлозы (НЦ) являются синтетическими высокомолекулярными соединениями, степень полимеризации которых может колебаться от 200 до 2000 элементарных звеньев. Получают их путем обработки целлюлозы преимущественно азотно-серными кислотными смесями, содержащими определенное количество воды.
Реакция химического взаимодействия между целлюлозой и азотной кислотой протекает по схеме:
[С6Н7О2(ОН)3]m + mnHNO3 ® [C6H7 O 2( ONO 2) n ( OH )3- n ] m + mn H 2 O .
В элементарном звене нитрата целлюлозы коэффициент “m” отражает степень полимеризации, а “n” – степень замещения гидроксильных групп на нитратные.
В технике степень замещения обычно выражают либо в процентах содержания азота (N%), либо в объеме окиси азота, полученного из 1г НЦ, то есть мл NO/г.
Степень замещения в элементарном звене изменяется от 1 до 3. При n = 1 содержание азота в нитрате целлюлозы равно 6,76%; при n = 2 – N = 11,11%; при n = 3 – N = 14,14%.
Нитраты целлюлозы являются основным сырьем для получения всех видов нитратцеллюлозных порохов: пироксилиновых, кордитных, сферических, баллиститных и ТРТ баллиститного типа.
Нитраты целлюлозы широко применяются в мирной промышленности. На их основе получают лаки и краски, а также некоторые виды кинопленок.
1 ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА НИТРАТОВ ЦЕЛЛЮЛОЗЫ
По внешнему виду НЦ существенно не отличаются от целлюлозы, но имеют более высокую удельную массу (1660кг/м3), худшую электропроводность, способны сорбировать из воздуха пары воды, кислот, органических окислителей, а из растворов – кислоты, соли, красители.
В отличие от целлюлозы НЦ растворяются во многих органических растворителях (ацетон, этилацетат, нитрометан и т. д.), а еще лучше – в смесях растворителей.
НЦ очень чувствительны к действию щелочей, что необходимо учитывать при стабилизации содовым раствором.
Слабые растворы щелочей (1…2%) при низкой температуре медленно разлагают НЦ. При повышении температуры до 60…100оС щелочи вызывают деполимеризацию и денитрацию НЦ, что проявляется в снижении вязкости и уменьшении содержания азота в них. Концентрированные растворы щелочей (10…20%) омыляют НЦ, что сопровождается внутренним окислением и распадом на низкомолекулярные продукты.
К действию разбавленных кислот НЦ менее чувствительны, чем к действию щелочей.
Разбавленные кислоты концентрацией 0,5…1% практически никаких изменений в нитратах целлюлозы не вызывают даже при повышенных температурах.
При действии растворов кислот 30…50% концентрации происходит деполимеризация и денитрация макромолекул НЦ.
Концентрированная серная кислота (70…90%) растворяет нитраты целлюлозы.
Окислители, даже такие сильные, как перманганат калия и хлорноватистая кислота, практически не действуют на НЦ, поэтому их применяют для отбелки коллоксилинов.
Восстановители SnCl2 и FeCl2 денитруют НЦ с выделением азотной кислоты, окиси азота или аммиака и оксицеллюлозы.
Нитраты целлюлозы относятся к бризантным взрывчатым веществам и способны к двум видам взрывчатого превращения – горению и детонации.
Сухой нитрат целлюлозы быстро сгорает при соприкосновении с пламенем или раскаленной проволокой.
Детонация НЦ может быть вызвана ударом или инициирована при помощи капсюля-детонатора. Присутствие влаги в НЦ более 10% затрудняет их детонацию, а при влажности 20% НЦ не детонируют.
2 ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА
Реакция образования азотнокислых эфиров целлюлозы является обратимой, гетерогенной и экзотермической.
В результате прямой реакции образуется нитрат целлюлозы. Обратная реакция называется реакцией денитрации, конечными продуктами которой являются оксицеллюлоза и азотная кислота.
Процесс этерификации является гетерогенным, так как реагирующие компоненты – целлюлоза и кислотная смесь – находятся в разных фазах, а реакция химического взаимодействия между ними протекает на границе раздела фаз. В силу этого процесс этерификации может протекать только при условии непрерывной диффузии кислоты из объема к поверхности волокон, а затем внутрь целлюлозного волокна.
Скорость нитрования определяется скоростью диффузии и скоростью собственно этерификации. Если скорость диффузии меньше скорости этерификации, то процесс в целом определяется только скоростью диффузии. В этих условиях нитрат целлюлозы получается неоднородным по степени замещения. И наоборот, если скорость диффузии больше скорости этерификации, то скорость реакции в целом определяется скоростью реакции этерификации, и нитрат целлюлозы получается однородным.
Реакция этерификации является экзотермической, так как протекает с выделением тепла.
Общее количество выделяющегося тепла складывается из:
— теплоты адсорбции кислотной смеси целлюлозой;
— теплоты за счет изменения состава кислотной смеси (теплоты гидратации);
— теплоты за счет самой химической реакции.
Все эти особенности процесса этерификации целлюлозы требуют большого избытка нитрующей смеси по сравнению с теоретически необходимым.
При этерификации целлюлозы протекают конкурирующие между собой процессы: собственно этерификация целлюлозы азотной кислотой, окисление и гидролиз. В отличие от целлюлозы НЦ по своим физико-химическим свойствам меньше подвержены гидролизу и окислению. Поэтому, если скорость этерификации больше скоростей гидролиза и окисления, то прореагировавшая целлюлоза, в известной мере, защищена от гидролизующего и окисляющего действия кислотной смеси. Это необходимое условие более благоприятного протекания этерификации.
3 СОВРЕМЕННАЯ ТЕОРИЯ НИТРОВАНИЯ ЦЕЛЛЮЛОЗЫ
Согласно современной теории нитрующих кислотных смесей нитрующим агентом является катион нитрония (NO2+) и реакция протекает по схеме:
ROH + NO2+ ® RONO2 + H+.
Образование катиона нитрония можно представить следующим уравнением:
HNO3 + 2 H2SO4 = NO2+ + 2HSO4 + H3O+.
Согласно этой теории роль серной кислоты в кислотной смеси следующая:
— ионизирует азотную кислоту с образованием катиона нитрония;
— связывает воду, выделяющуюся во время реакции;
— вызывает набухание целлюлозы, что облегчает протекание реакции.
Процесс этерификации целлюлозы азотно-серной кислотной смесью представляет сумму трех накладывающихся во времени процессов:
— капиллярная и межмолекулярная пропитка нитрующей смесью;
— диффузионное выравнивание концентрации нитросмеси внутри волокна.
На скорость первого процесса решающее влияние оказывают смачиваемость и капиллярность, которые обусловливаются как смачивающими свойствами нитросмеси, так и впитывающими свойствами целлюлозы.
Смачивание зависит от степени очистки целлюлозного материала от нецеллюлозных примесей и физической формы нитруемого материала.
Разные образцы целлюлозы, различающиеся по степени очистки, а следовательно, и по характеру поверхности, имеют различную реакционную способность и впитывают разное количество нитросмеси.
Установлено, что скорость реакции нитрования, выход и качество образующегося НЦ определяются в основном количеством нитросмеси, впитанным целлюлозой в начале нитрации, которое обусловлено смачиваемостью и капиллярностью. Чем больше нитросмеси впитала целлюлоза в начальный момент нитрации, тем меньше скорость гидролиза и окисления, больше скорость нитрации, лучше качество НЦ.
Процесс собственно этерификации значительно предопределен первым этапом. В первую очередь взаимодействуют гидроксильные группы, расположенные на поверхности агрегатов целлюлозных молекул. Замещение гидроксильных групп вызывает изменение свойств поверхности реагирующего вещества, которая становится гидрофобной.
Капиллярное и межмолекулярное впитывание нитросмеси волокном и диффузионное выравнивание концентрации нитросмеси в системе во времени накладываются друг на друга.
Начало первого процесса вызывает начало второго, и, по мере глубокой пропитки волокна нитросмесью, они протекают параллельно. От скорости обоих процессов зависит скорость нитрации и качество НЦ.
Процесс нитрования протекает следующим образом: сначала волокно быстро смачивается кислотной смесью по поверхности и заполняются пустоты за счет капиллярного и межмолекулярного впитывания. Процесс межмолекулярного набухания сопровождается разрывом межмолекулярных связей. Затем начинается диффузионное выравнивание концентрации нитросмеси во внутренних зонах волокна за счет нитросмеси, окружающей волокно. Процесс сопровождается донитровыванием и денитрацией макромолекул целлюлозы и НЦ на различных участках волокна, а также реакциями гидролиза и окисления.
Решающим фактором, обусловливающим скорость нитрации, выход и качество НЦ, является концентрация нитросмеси внутри волокна в начале нитрации. Чем меньше разница концентраций нитросмеси внутри волокна и в объме, тем благоприятнее протекает процесс.
4 ВЛИЯНИЕ НЕКОТОРЫХ ФАКТОРОВ НА ПРОЦЕСС НИТРОВАНИЯ
4.1 Влияние содержания азотной кислоты
С увеличением в нитросмеси содержания азотной кислоты скорость нитрации увеличивается, так как улучшается ее смачивающая способность и возрастает скорость проникновения во внутренние зоны волокна. Это объясняется меньшим поверхностным натяженим азотной кислоты по сравнению с серной. Содержание азотной кислоты в кислотной смеси обычно колеблется от 22 до 35%, дальнейшее увеличение экономически невыгодно.
4.2 Влияние серной кислоты
Серная кислота ионизирует азотную кислоту, связывает реакционную воду и вызывает набухание целлюлозы. Так как серная кислота дешевая, выгодно необходимый модуль ванны создавать за счет серной кислоты. Однако серная кислота при большом избытке оказывает отрицательное влияние на процесс нитрации, вызывает гидролиз целлюлозы и сульфирует ее. В заводской практике обычно берется отношение серной кислоты к азотной от 2 до 3.
4.3 Влияние воды
Содержание воды в кислотных смесях является основным показателем, определяющим степень этерификации целлюлозы. С увеличением содержания воды в кислотных смесях от 8 до 15% содержание азота в получаемых нитратах целлюлозы уменьшается.
Безводные кислотные смеси обладают меньшей реакционной активностью. Это объясняется худшей смачивающей способностью таких смесей. В результате скорость реакции превышает скорость пропитки, и на поверхности волокна образуется гидрофобный слой высоконитрованной целлюлозы, мешающий проникновению нитросмеси в глубь волокна, что и замедляет нитрацию. В производственных условиях содержание воды находится в пределах от 4 до 20%, при этом получаются нитраты целлюлоз с содержанием азота от 11 до 13,7%.
Кислотные смеси с содержанием воды больше 20% дают низкоазотные, неоднородные НЦ, так как при большом содержании воды скорость реакций гидролиза и окисления увеличивается.
4.4 Влияние содержания окислов азота
Для нитрации применяется большое количество нитрующей смеси, и отработанная кислота снова направляется в производство. По мере многократного оборота в них накапливаются продукты окисления, окислы азота. При содержании в смеси 1…2% окислы азота не оказывают заметного влияния на процесс нитрования, качество и выход НЦ. Если окислов азота более 5%, то такая смесь наряду с нитрующим действием окисляет целлюлозу.
Наличие в кислотной смеси N2O3 – ангидрида азотной кислоты усиливает ее окислительное действие. При этом образуется низконитрованная НЦ, нитрооксицеллюлоза, выход НЦ снижается, так как часть целлюлозы разрушается и при стабилизации удаляется.
4.5 Влияние модуля нитрации
При получении НЦ в заводских условиях применяют большой избыток кислотной смеси, который необходим по следующим причинам:
— малая величина насыпного веса целлюлозы;
— гетерогенный характер реакции этерификации;
— разбавление кислотной смеси реакционной водой;
— экзотермичность реакции этерификации.
При небольших модулях происходит неполное смачивание целлюлозы кислотной смесью, резкое изменение состава кислотной смеси, местные перегревы.
В этих условиях НЦ получаются неоднородными по содержанию азота, вязкости, с плохой растворимостью в органических растворителях.
Величина модуля ванны в заводских условиях составляет для целлюлозы РБ – 1:25, 1:28; для ХЦ – 1:40, 1:42; для ЦА – 1:30, 1:32.
4.6 Влияние температуры
Общая скорость процесса нитрации определяется не скоростью химической реакции, а скоростью диффузии кислотной смеси, поэтому увеличение температуры не оказывает существенного влияния на скорость процесса.
Если для гомогенной реакции при увеличении температуры на 10оС скорость реакции увеличивается в 2…3 раза, то за 30 минут нитрации при 10 ° С получают нитраты целлюлозы с содержанием азота 10,7%, а при 40оС – 13,1%.
В производственных условиях температура нитрации колеблется от 20 до 40оС, и выбор температуры определяется не столько содержанием азота в получаемых НЦ, а сколько необходимостью снижения степени полимеризации.
4.7 Влияние продолжительности нитрации
Продолжительность нитрации, то есть достижение равновесия реакции зависит от состава кислотной смеси, модуля и температуры нитрации, физико-химических свойств целлюлозы и условий перемешивания.
В производственных условиях продолжительность нитрации составляет 30…60 минут.
4.8 Влияние свойств исходной целлюлозы
Наличие примесей – жиров, смол, лигнина, пектиновых веществ — ухудшает смачиваемость целлюлозы, замедляет скорость диффузии кислот внутрь волокна, затрудняет отжим отработанных кислот от НЦ. Эти примеси снижают выход НЦ и содержание азота в них. Хлопковая целлюлоза (ХЦ) содержит меньше примесей, чем древесная целлюлоза (ДЦ), поэтому выход НЦ на ХЦ выше, чем на ДЦ.
ХЦ имеет более развитую капиллярно-пористую систему, чем ДЦ, то есть более реакционноспособна. Поэтому для ее нитрации используются кислотные смеси с меньшим содержанием азотной кислоты и с большим содержанием воды, но из-за малого насыпного веса требуются большие модули ванн.
Для РБ используются кислотные смеси с большим содержанием азотной кислоты, но и с меньшим модулем ванн, так как для ее полного смачивания требуется меньше кислотной смеси.
5 ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ НИТРАТОВ ЦЕЛЛЮЛОЗЫ
Производство нитратов целлюлозы может осуществляться по периодической, полунепрерывной и непрерывной технологиям.
Технологический процесс складывается из следующих фаз:
— подготовка рабочей кислотной смеси (РКС);
— нитрация целлюлозы и рекуперация отработанных кислот;
— стабилизация нитратов целлюлозы;
5.1 Подготовка целлюлозы
Цель фазы заключается в придании целлюлозному сырью удобной для нитрации формы и удалении избыточной влаги.
Для этого ХЦ и ЦА разрыхляют на кипорыхлителях, а рулонную бумагу (РБ) режут на станках резательных целлюлозы Кузьмина (СРЦ К). Затем целлюлозу подсушивают до влажности 3…5% на пневмосушилках.
5.2 Подготовка рабочей кислотной смеси
Цель фазы – получение гомогенной по составу кислотной смеси с определенной температурой.
Подготовка кислотной смеси включает следующие операции:
— анализ свежих, отработанных и вытесненных кислот;
— термостатирование РКС в теплообменниках.
5.3 Нитрация целлюлозы и удаление отработанных кислот
Цель фазы – получение НЦ с необходимым содержанием азота и удаление избытка отработанных и адсорбированных кислот.
Нитрацию целлюлозы осуществляют в нитраторах, отжим отработанных кислот — в центрифугах, а вытеснение адсорбированных кислот – в вытеснителях, либо удаление отработанных и адсорбированных кислот проводят в одном аппарате — НУОК (непрерывное удаление отработанных кислот).
5.4 Стабилизация нитратов целлюлозы
Цель фазы – получение химически стойкого нитрата целлюлозы с определенной вязкостью и растворимостью.
При нитрации целлюлозы протекают побочные реакции: сульфирование целлюлозы и частично нитратов целлюлозы, гидролиз целлюлозы и нитратов целлюлозы, окисление целлюлозы, нитрация продуктов окисления и гидролиза, а также нитрация примесей, содержащихся в целлюлозе. В результате этих реакций образуются нестойкие примеси: сульфо — и нитросульфоэфиры, нитропентазаны, нитрогексазаны, нитролигнин, нитрооксицеллюлоза. Кроме того, во внутренних капиллярах целлюлозы капсулируется серная кислота. Все эти примеси снижают химическую стойкость нитратов целлюлозы, и их необходимо удалить.
Стабилизация НЦ включает следующие операции:
— варка в кислом и содовом растворах;
— измельчение в голландерах или мельницах;
— окончательная промывка в лаверах в кислой или нейтральной среде.
5.5 Окончательная обработка
Цель фазы – получение большой по массе (40 т) общей партии с однородными физико-химическими показателями, и заключается в смешении частных партий в общие, очистке общих партий от грубоизмельченных волокон, песка, металлический включений и окалины путем пропускания нитромассы через сита, пескоуловители и магниты с последующим отжимом от воды.
6 ЛАБОРАТОРНЫЕ РАБОТЫ
6.1 Работа 1. Приготовление кислотных смесей
Цель этой операции – получение гомогенной по составу рабочей кислотной смеси.
Состав кислотных смесей, идущих на нитрацию целлюлозы, зависит от марки получаемого НЦ и применяемого целлюлозного сырья (ХЦ, ЦА или РБ).
Задание: приготовить Рг РКС, в состав которой входит азотная кислота с содержанием моногидрата N, серная кислота с содержанием моногидрата S и вода.
Процентное содержание азотной кислоты в РКС — n, процентное содержание серной кислоты — s.
Необходимо рассчитать количество азотной, серной кислот и воды в граммах, необходимое для приготовления Рг кислотной смеси.
Расчет проводим по формулам:
Х = P ∙ s / S; Y = P ∙ n / N; W = Р — Х — У,
где X, Y, W – количество серной, азотной кислот и воды в граммах.
6.1.1 Посуда, приборы, спецодежда
1. Стакан емкостью 200…250 мл из кислотоупорной стали, из фарфора либо стекла “перекс” для смешения кислот.
2. Мерные цилиндры емкостью 25, 50, 100 мл.
3. Стеклянная банка с притертой пробкой для готовой кислотной смеси.
4. Сосуд с холодной водой или снегом для охлаждения кислот.
5. Защитные очки, резиновые перчатки и фартук.
6. Нейтрализующие средства: 0,5% раствор соды от ожога глаз кислотой.
6.1.2 Проведение работы
Вначале отмеряем необходимое количество воды и переливаем в стакан для смешения кислотных смесей. Затем отмеряем кислоты и небольшими порциями при перемешивании приливаем к воде сначала серную кислоту, а затем, после охлаждения двойной смеси до 45оС, приливаем азотную кислоту. После охлаждения кислотную смесь переливаем в банку с притертой пробкой и приклеиваем этикетку, на которой указываем группу и фамилии студентов.
6.1.3 Правила техники безопасности
1. Перед тем как приступить к смешению кислот, студент должен узнать местонахождение нейтрализующих средств.
2. Все операции с кислотами проводить в вытяжном шкафу при включенной вентиляции.
3. При работе с кислотами надевать защитные очки, резиновые перчатки и резиновый фартук.
4. Категорически запрещается при смешении кислот приливать воду к кислотам.
6.2 Работа 2. Анализ кислотных смесей
Целью данного анализа является проверка соответствия состава приготовленной кислотной смеси расчетному, то есть необходимому составу, поскольку именно содержание компонентов кислотной смеси, особенно азотной кислоты и воды, определяет степень замещения НЦ.
Анализ кислотных смесей основан на определении общей кислотности методом обратного титрования, количество серной кислоты определяем формальдегидным методом и расчетным путем – количество азотной кислоты и воды.
Для свежеприготовленных кислотных смесей определение количества окислов азота не производится, так как они практически отсутствуют.
6.2.1 Определение общей кислотности
Общая кислотность – это суммарное процентное содержание азотной и серной кислот в кислотной смеси, пересчитанная, как правило, на серную кислоту и выраженная в процентах.
Прямым титрованием общая кислотность не определяется, так как красящее вещество индикатора разрушается под действием следов азотной кислоты, присутствующей в кислотной смеси.
Определяют общую кислотность нейтрализацией кислот раствором едкого натра с последующим оттитровыванием его избытка серной кислотой.
6.2.1.1 Реактивы и посуда
1. Едкий натр – 0,5 н раствор.
2. Серная кислота – 0,5 н раствор.
3. Дистиллированная вода.
5. Коническая колба емкостью 250 мл.
6. Аналитические весы и разновесы.
7. Пипетка Лунге-Рея для взятия навесок кислотной смеси.
6.2.1.2 Проведение анализа
В коническую колбу емкостью 250 мл, содержащую 50 мл дистиллированной воды, бюреткой отмеривают 50 мл 0,5 н раствора. В сухую пипетку Лунге-Рея набирают кислотную смесь, взвешивают пипетку с точностью до 0,0002 г, снимают предохранительную колбочку и, осторожно открывая край пипетки, прикапывают 10…12 капель кислотной смеси в коническую колбу. Пипетку Лунге-Рея вновь взвешивают. К содержимому конической колбы прибавляют 3…4 капли метилоранжа и проводят титрование избытка щелочи 0,5 н раствором серной кислоты до розового окрашивания.
Общую кислотность в процентах в пересчете на серную кислоту рассчитываем по формуле:
С = 0,02452 (V1K1 — V2 K2) ∙ 100 / H,
где 0,02452 — количество серной кислоты в граммах, точно соответствующее одному миллилитру 0,5 н раствора едкого натра;
V1, K1 — объем и фактор нормальности 0,5 н раствора едкого натра (фактор нормальности – это отношение практического титра к теоретическому титру раствора);
V2, K2 — объем и фактор нормальности 0,5 н раствора серной кислоты;
Н — навеска кислотной смеси.
По результатам двух параллельных измерений выводят средний результат, округляемый до 0,01%. Между параллельными определениями допускается расхождение не более 0,5%.
Общая кислотность может быть рассчитана по формуле:
где Х — процентное содержание серной кислоты в смеси;
Y — процентное содержание азотной кислоты в смеси;
1,29 — коэффициент пересчета.
6.2.2 Определение содержания серной кислоты
Предварительно азотная и азотистая кислоты разрушаются формальдегидом:
4HNO3 + 3CH2 О = 3CO2 + 4NO + 5H2O;
4HNO2 + 2CH2O = 3CO + 2N2 + 5H2O.
Оставшаяся в смеси серная кислота оттитровывается 0,5 н раствором едкого натра.
6.2.2.1 Реактивы и посуда
1. Формалин – 40% раствор.
2. Едкий натр – 0,5 н раствор.
3. Индикатор – метилоранж.
4. Пипетка Лунге-Рея.
5. Чашки фарфоровые.
7. Конические колбы емкостью 250 мл.
6.2.2.2 Проведение анализа
В фарфоровую чашку с помощью пипетки Лунге-Рея берут навеску кислотной смеси около 1,5…2 г с точностью до 0,0002 г, нагревают на водяной бане до прекращения выделения окислов азота, добавляют несколько капель 40% раствора формалина и нагревают еще 10…15 минут до полного прекращения выделения окислов азота.
Осторожно разбавив дистиллированной водой остаток в чашке, сливают его в колбу для титрования, чашку ополаскивают и воду сливают в ту же колбу для титрования. Добавив 3…4 капли метилоранжа, титруют серную кислоту 0,5 н раствором едкого натра до слабо-желтого цвета.
Расчет содержания серной кислоты в процентах проводят по формуле:
Х = V ∙ K ∙ 0, 02452 / H,
где V — количество 0,5 н раствора едкого натра в мл, пошедшее на титрование;
К — фактор нормальности 0,5 н раствора едкого натра;
Н — навеска кислотной смеси.
Из двух параллельных опытов выводят средний результат, округляемый до 0,01%. Допустимое отклонение между параллельными определениями должно быть не более 0,5%.
6.2.3 Определение содержания азотной кислоты и воды
Содержание воды (W) и азотной кислоты (Y) в кислотной смеси рассчитывают по формулам:
Y = (C – X) ∙ 1,29; W = 100 – X – Y,
где С — общая кислотность в % в пересчете на серную кислоту;
Х — содержание серной кислоты в %.
6.2.4 Правила техники безопасности
1. Кислотная смесь в пипетку Лунге-Рея набирается грушей, соединенной через склянку Тищенко.
2. Взвешивание пипетки следует производить только на специально выделенных весах.
3. Нагревание навески кислотной смеси при определении содержания серной кислоты производится только в вытяжном шкафу при работающей вентиляции.
4. Необходимо соблюдать общие правила безопасной работы с кислотами, изложенными в предшествующей лабораторной работе.
6.3 Работа 3. Нитрация целлюлозы
Методы получения НЦ в лабораторных условиях состоят в обработке целлюлозного материала марок ХЦ, ЦА или РБ кислотными смесями, состоящими из азотной, серной кислот и воды. Поскольку реакция получения НЦ протекает в гетерогенной среде, то требуется большой избыток кислотной смеси.
В лабораторных условиях для всех видов целлюлозного материала применяют обычно модуль, равный 1 : 50.
Навеска целлюлозы для нитрации берется из расчета получения 2…3 г НЦ. Перед нитрацией целлюлоза высушивается (если влажность выше 5…7%) в сушильном шкафу при 95…97оС в течение 5…7 часов и охлаждается в эксикаторе над хлористым кальцием.
Режим нитрации устанавливается или согласовывается с руководителем работы.
6.3.1 Посуда, реактивы и спецодежда
1. Кислотная смесь.
2. Целлюлозный материал.
3. Фарфоровый стакан или стакан из кислотоупорной стали для нитрации емкостью 250…500 мл.
4. Фарфоровая воронка и колба Бунзена.
5. Стальной стакан с ложным дном либо фарфоровая воронка для промывки НЦ.
6. Защитные очки, фартук и резиновые перчатки.
6.3.2 Порядок проведения работы
Рабочая кислотная смесь заливается в стакан для нитрации, и с помощью водяной бани устанавливается температура, которая задается преподавателем.
Навеска целлюлозы вносится небольшими порциями при перемешивании стеклянной палочкой.
По окончании загрузки целлюлозы перемешивание прекращают, стакан прикрывают стеклом и смесь выдерживают 30 минут. Во время выдержки периодически, через каждые 5 минут, проводят перемешивание массы.
По истечении времени нитрации отработанная кислотная смесь осторожно сливается через сухую фарфоровую воронку (без бумажного фильтра) в колбу Бунзена, затем на эту же воронку переносят нитрат целлюлозы и отжимают его стеклянной пробкой от избытка кислот. Отжатый нитрат целлюлозы небольшими порциями щипцами или пинцетом переносится в стакан с водой и промывается от кислот сначала водопроводной, а затем дистиллированной водой в стальном стакане с ложным дном или в фарфоровой воронке. Промывку проводят до нейтральной реакции промывных вод по индикаторной бумаге. Подготовленный таким образом нитрат целлюлозы поступает на стабилизацию. Если стабилизация проводится не в день приготовления нитрата целлюлозы, то нестабилизированный нитрат целлюлозы хранится под водой.
6.3.3 Правила техники безопасности
1. К работе допускаются студенты только в соответствующей спецодежде и при наличии индивидуальных средств защиты (халат, резиновые перчатки и фартук, маска или очки).
2. Нитрация и отжим нитрата целлюлозы от избытка кислот проводится только в вытяжном шкафу при работающей вентиляции.
3. Отработанные кислотные смеси собираются в специальную бутыль, категорически запрещается слив их в канализацию.
4. Не допускается хранение химически нестойкого нитрата целлюлозы в сухом состоянии, безопасное хранение его возможно только под водой.
5. Стаканы и колбы, в которых хранятся образцы НЦ, должны иметь этикетку с указанием фамилии студента, номера группы и срока изготовления образцов.
6.4 Работа 4. Стабилизация нитрата целлюлозы
При нитрации целлюлозы протекают побочные реакции окисления и гидролиза целлюлозы. Продукты окисления и гидролиза химически взаимодействуют с кислотной смесью, давая ряд химически нестойких соединений: нитропентазаны, нитрогексазаны, нитропроизводные продуктов окисления сахаров.
Серная кислота, входящая в состав кислотных смесей, также образует с целлюлозой и побочными продуктами малостойкие сульфо — и нитросульфоэфиры. Кроме того, нитрат целлюлозы после нитрации и даже отмывки кислот всегда содержит закапсулированные кислоты во внутренних капиллярах и полостях.
Таким образом, нитрат целлюлозы после нитрации помимо целевого продукта содержит еще целый ряд побочных соединений, количество которых зависит от степени замещения НЦ: высокоазотные НЦ содержат больше нитросахаров и закапсюлированных кислот; высокоазотные НЦ – нитрооксицеллюлоз, сульфо — и нитросульфоэфиров целлюлозы.
Целью операции стабилизации является разрушение всех нестойких примесей в НЦ и получение химически стойкого продукта.
В лабораторных условиях стабилизация проводится по ускоренному способу:
— кислая варка в 0,2% растворе НNO3 – 2 часа;
— щелочная варка в 0,05% растворе соды – 2 часа;
— варка в дистиллированной воде – 1 час.
Модуль варки равен 1 : 200.
Варки проводят в термостойком стакане или конической колбе с обратным холодильником, используя обогрев электрической плиткой с закрытой спиралью.
В процессе варки НЦ необходимо систематически контролировать уровень раствора и поддерживать его постоянным, доливая воду.
6.4.1 Сушка нитрата целлюлозы
После стабилизации нитрат целлюлозы отжимают между листами фильтровальной бумаги. Прежде чем сушить весь образец предварительно проводят сушку небольшого количества нитрата целлюлозы (около 0,5 г). Для этого нитрат целлюлозы помещают на часовое стекло, поверх кладется синяя лакмусовая бумажка, и все помещается в сушильный шкаф либо под инфракрасную лампу на 30 минут. Температура сушки в пределах 90-95оС. Если во время предварительной сушки лакмусовая бумажка покраснеет, навеску нитрата целлюлозы немедленно вынимают и отдают лаборанту на уничтожение, а НЦ подвергают дополнительной стабилизации. Высушенный нитрат целлюлозы помещают в эксикатор над хлористым кальцием, поверх образца кладут синюю лакмусовую бумажку. Химически стойкий НЦ подвергают физико-химическим испытаниям. По окончании испытаний остаток НЦ сдается лаборанту.
6.4.2 Правила техники безопасности
1. Для предупреждения растрескивания стаканов и колб при варках они помещаются на металлическую сетку поверх греющего элемента электроплитки.
2. Во избежании ожога рук нагретые сосуды необходимо снимать либо специальными зажимами, либо с помощью сухого полотенца.
3. Сушку НЦ проводить в отрегулированном сушильном шкафу при одновременной загрузке не более 5 г НЦ.
4. В процессе сушки дверка шкафа должна быть только прикрытой, но не запертой на защелку.
6.5 Работа 5. Определение содержания азота в НЦ
Содержание азота является одной из основных характеристик НЦ и определяется после проведения нитрации целлюлозы и рекуперации кислот, то есть до стабилизации, а также в частных и общих партиях.
Содержание азота можно определить разными методами, наиболее старый и точный – это метод Лунге, но по этому методу необходима работа с металлической ртутью, что требует специальных помещений и особых мер по технике безопасности.
Поэтому в данной работе приводится безртутный метод определения содержания азота.
Ферросульфатный метод основан на омылении НЦ концентрированной серной кислотой, восстановлении образовавщейся азотной кислоты железом сернокислым закисным до окиси азота, которая с избытком последнего образует комплексное соединение, окрашивающее раствор в желтовато-розовый цвет.
Химизм происходящих процессов может быть выражен следующими уравнениями:
[C6H7O2(ONO2)]m + mn H2SO4 = [C6H7O2(OH)3-n(HSO4)]m + mn HNO3;
3mn FeSO4 + mn HNO3+ 1,5mn H2SO4 =1,5Fe2(SO4)3 +2mn H2O +mn NO;
mn FeSO4 + mn NO = mn [Fe(NO)]SO4.
6.5.1 Реактивы, посуда, аппаратура
1. Сернокислое закисное железо либо соль Мора.
2. Кислота ортофосфорная.
3. Кислота серная концентрированная.
4. Вода дистиллированная.
5. Калий азотнокислый, перекристаллизованный и высушенный до постоянной массы.
6. Эксикатор с прокаленным хлористым кальцием.
7. Колба мерная на 1000 мл.
8. Цилиндры измерительные на 25 и 250 мл.
9. Коническая колба на 100 мл.
10. Микробюретка с ценой деления 0,02 мл, емкостью 5 и 10 мл.
11. Бумага амальгированная или пергаментная.
12. Шкаф сушильный.
13. Весы лабораторные класса точности 1 или 2 с наибольшим пределом взвешивания 100, 200 г.
6.5.2 Проведение анализа
6.5.2.1 Приготовление 0,5 н раствора сернокислого
а) Растворяют 150 г сернокислого закисного железа в 400 мл дистиллированной воды;
б) 250 мл серной кислоты смешивают с 250 мл дистиллированной воды, приливая кислоту в воду;
в) оба приготовленных раствора охлаждают и количественно переносят в мерную колбу на 1000 мл, доводя объем до метки дистиллированной водой.
Титр приготовленного таким образом раствора сернокислого закисного железа определяют по азотнокислому калию и проверяют его в день проведения анализа.
6.5.2.2 Приготовление 0,5 н раствора соли Мора
Вместо сернокислого закисного железа используется соль Мора [(NH4)2 Fe(SO4)2]∙6H2O, которая более устойчива при хранении, не подвергается на воздухе такой степени окисления, как FeSO4.
Порядок приготовления раствора следующий:
а) растворяем 113,12 г соли Мора в 400 мл дистиллированной прокипяченой охлажденной воды;
б) растворяем 170 мл серной кислоты в 250 мл дистиллированной воды, к охлажденному раствору постепенно прибавляем 80 мл ортофосфорной кислоты также при охлаждении;
в) растворы количественно переносят в мерную колбу на 1000 мл и доводят до метки. Готовый раствор хранится в темной посуде.
6.5.2.3 Определение титра раствора сернокислого закисного железа либо соли Мора
Около 0,12 г азотнокислого калия, перекристаллизованного из горячей воды и высушенного до постоянной массы при температуре 120оС, взвешивают с точностью до 0,0002 г способом простого взвешивания, помещают в колбу и приливают 25 мл охлажденной серной кислоты. Колбу закрывают пробкой, помещают в холодную воду с температурой около 15о С и оставляют стоять до полного растворения азотнокислого калия.
Затем полученный раствор титруют раствором соли Мора или сернокислого закисного железа до перехода окраски от желтоватой до желтовато-розовой (при добавлении лишней капли окраска становится розовой).
Титрование необходимо вести при постоянном охлаждении колбы с титруемым раствором в холодной воде со льдом, чтобы температура не превышала 15оС. Титр раствора рассчитывается по формуле:
где 0,1386 – содержание азота в одном грамме азотнокислого
М — масса азотнокислого калия, г;
V — объем раствора сернокислого закисного железа или соли
Мора, пошедшей на титрование раствора азотнокислого калия, в мл.
6.5.2.4 Определение содержания азота в НЦ
Перед проведением анализа нитрат целлюлозы подсушивается на воздухе 2…3 суток, или 1,5 часа при 105оС и перед непосредственным взятием навески выдерживается 3…5 минут под ИК-лампой. Около 0,12 г нитрата целлюлозы взвешивают с точностью до 0,0002 г в лотке из амальгированной бумаги и переносят в коническую колбу. Лоточек после освобождения от нитрата целлюлозы взвешивают для уточнения веса образца. К содержимому колбы приливают 25 мл охлажденной серной кислоты; закрыв пробкой, колбу помещают в воду с температурой около 15оС и выдерживают до полного растворения навески нитрата целлюлозы. Затем проводят титрование раствора нитрата целлюлозы в серной кислоте раствором сернокислого закисного железа или соли Мора до перехода желтоватой окраски в желтовато-розовую, титрование проводят при постоянном охлаждении колбы примерно до 15оС.
По результатам титрования вычисляют содержание азота в нитрате целлюлозы в процентах:
N = T ∙ V ∙ 1000 / g ,
где V — объем раствора сернокислого закисного железа или соли Мора, пошедшей на титрование раствора нитрата целлюлозы, мл;
Т — титр раствора сернокислого закисного железа или соли Мора;
g — масса нитрата целлюлозы, г.
Производят два параллельных определения, из которых выводят среднее значение, округляемое до 0,01%.
При необходимости выразить содержание азота в нитрате целлюлозы в мл, следует значение в процентах умножить на 15,95.
6.5.3 Правила техники безопасности
1. При работе с кислотами использовать индивидуальные средства защиты.
2. Работу проводить в вытяжном шкафу с включенной вентиляцией.
6.6 Работа 6. Определение растворимости в спирто-эфирной смеси
Характеристика растворимости НЦ в спирто-эфирной смеси, наряду с содержанием азота, определяет пригодность полученного эфира целлюлозы к дальнейшей переработке.
При получении НЦ растворимость в спирто-эфирной смеси определяется после операции нитрации, а затем в частных и общих партиях.
Метод основан на весовом определении нерастворимого остатка после обработки НЦ спирто-эфирной смесью при объемном соотношении спирта к эфиру 1:2.
6.6.1 Реактивы, посуда, аппаратура
1. Спирт- ректификат и этиловый спирт.
2. Колба коническая на 100 мл.
3. Склянка для отсасывания.
4. Тигель фильтрующий или воронка со стеклянной пористой пластинкой №2.
5. Шкаф сушильный.
6.6.2 Проведение работы
В предварительно взвешенный лоточек из кальки берут навеску НЦ около 0,5 г с точностью до 0,0002 г. Навеску НЦ помещают в сухую коническую колбу с пришлифованной пробкой, наливают 17 мл этилового спирта, закрывают пробкой и встряхивают в течение 2…3 минут. Добавляют 33 мл этилового спирта и в течение 10…15 минут взбалтывают на аппарате для взбалтывания (или вручную 20…30 минут).
Затем содержимое колбы фильтруют через предварительно взвешенный фильтр со стеклянной пористой пластинкой №2. После отсасывания воронка (фильтр) сушится в шкафу при температуре
95…105о С в течение двух часов.
Растворимость рассчитывают по формуле:

где Н – навеска НЦ, г;
Б — масса сухого фильтра, г;
А – масса чистого фильтра, г.
Производят два параллельных определения, из которых выводят среднее округляемое до 0,1%.
Расхождение между параллельными определениями допускается не более 0,3%.
6.6.3 Правила техники безопасности
1. Работу проводить в вытяжном шкафу с включенной
2. Выливать спирто-эфирный растворитель в канализацию категорически запрещается.
3. После проведения анализа сухой фильтр с осадком тщательно промывают от осадка и высушивают.
6.7 Работа 7. Сравнение физико-химических свойств
целлюлозы и нитратов целлюлозы
Нитрат целлюлозы является сложным эфиром целлюлозы, в котором часть гидроксильных групп замещена на нитратные, и это резко изменяет физико-химические свойства целлюлозы. Например, плотность НЦ 1660 кг/м3, тогда как у целлюлозы 1520…1540 кг/м3. НЦ растворяются во многих органических растворителях (ацетоне, этилацетате, бутилацетате и т. д.), а целлюлоза только в крайне ограниченном числе растворителей. Целлюлоза в растворах щелочей набухает и частично растворяется, тогда как НЦ при взаимодействии с ними быстро разлагаются. Для целлюлозы не существует такого понятия, как химическая стойкость, а для НЦ химическая стойкость является одним из важнейших показателей. При повышении температуры скорость разложения НЦ резко увеличивается, и в интервале температур 160…200оС образец НЦ вспыхивает, причем при тем более низкой температуре, чем менее стоек НЦ.
В данной работе проводится сопоставление некоторых физико-химических свойств целлюлозы и нитратов целлюлозы с целью определения сходства или различия в них.
6.7.1 Приборы, реактивы, посуда
1. Прибор для определения температуры вспышки.
2. Крышки от металлических бюксов либо любые пластины из негорючих металлов.
3. Пробирки – 2 шт.
4. Образцы целлюлозы и НЦ.
5. Ацетон технический или марки ХЧ.
6.7.2 Проведение работы
6.7.2.1 Сравнение растворимости образцов целлюлозы и опытного образца НЦ в ацетоне
В две пробирки наливают 5…6 мл ацетона и помещают в одну 0,02 г сухого НЦ (опытный образец, полученный в предшествующей работе), в другую столько же целлюлозы. Пробирки прикрывают, слегка встряхивают и через 10…15 минут сравнивают их, делая выводы о действии ацетона на целлюлозу и НЦ.
6.7.2.2 Сравнение воспламеняемости целлюлозы и НЦ
На одну крышку от металлического бюкса помещают 0,05…0,1 г целлюлозы, а на другую такое же количество сухого нитрата целлюлозы, к каждому из образцов подносят зажженную спичку и отмечают, есть ли различие в воспламеняемости от открытого огня.
6.7.2.3 Определение температуры вспышки опытного
В гнездо термостата, нагретого до 100оС, помещают две пробирки: в одной из них 0,05…0,1 г высушенного валового нитрата целлюлозы, в другой – такое же количество сухого нитрата целлюлозы, полученного в лабораторных условиях. Затем равномерно, со скоростью 5оС в минуту, повышают температуру, причем данная постоянная скорость нагрева должна выдерживаться, так как при более медленном нагревании получают заниженные результаты, а при более быстром – завышенные.
В процессе нагревания происходит воспламенение с “хлопком” каждого из образцов, и в этот момент отмечают температуру вспышки.
Сопоставляя эти температуры для опытного и валового образцов НЦ, делают вывод об их относительной стойкости.
6.7.3. Правила техники безопасности
1. При работе с ацетоном и взятии навесок НЦ не допускать наличия поблизости открытого огня и включенных электроплиток с открытой спиралью.
2. Перед работой с прибором по определению температуры вспышки предварительно убедиться в исправности электроплитки.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Гиндич пироксилиновых порохов. Производство нитратов целлюлозы и регенерация кислот, т.1. – Казань, 2000.
1 Физико-химические свойства нитратов целлюлозы ………………… 3 2 Физико-химические основы процесса нитрования целлюлозы…….. 4
3 Современная теория нитрования целлюлозы…………………………. 5
4 Влияние некоторых факторов на процесс нитрования………………. 7
4.1 Влияние содержания азотной кислоты………………………. 7
4.2 Влияние серной кислоты………………………………………. 7
4.4 Влияние содержания окислов азота………………………….. 8
4.5 Влияние модуля нитрации…………………………………….. 8
4.6 Влияние температуры…………………………………………. 9
4.7 Влияние продолжительности нитрации …………. ………… 9
4.8 Влияние свойств исходной целлюлозы……………………… 9
5 Технология получения нитратов целлюлозы………………………. 10
5.1 Подготовка целлюлозы……………………………………….. 10
5.2 Подготовка рабочей кислотной смеси…………….… ………. 1 0
5.3 Нитрация целлюлозы и удаление отработанных кислот…….10
5.4 Стабилизация нитратов целлюлозы………………………….. 11
5.5 Окончательная обработка…………………………………….. 11
6.1 Работа 1. Приготовление кислотных смесей……………….. 1 1
6.2 Работа 2. Анализ кислотных смесей………………………….13
6.3 Работа 3. Нитрация целлюлозы……………………………….16
6.4 Работа 4. Стабилизация нитрата целлюлозы……………….. 18
6.5 Работа 5. Определение содержания азота в НЦ…………….. 19
6.6 Работа 6. Определение растворимости в спирто-эфирной
6.7 Работа 7. Сравнение физико-химических свойств
целлюлозы и нитратов целлюлозы……….……… ……………… 2 4
Список использованных источников……………………………………25
Дементьева Динария Ивановна
Практикум для студентов специальности 251200 по курсу “Физика и химия полимеров. Технология эфиров целлюлозы”
Подписано в печать 29.08.2001. Формат 60 ´ 84 1/16.
Усл. п. л. – 1,57. Уч. изд. л. – 1,69.
Печать – ризография, множительно-копировальный
📹 Видео
7 класс. Химия. Реакция нейтрализацииСкачать

Растворение целлюлозыСкачать

Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

10 класс. Химия. ЦеллюлозаСкачать

Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Полисахариды Крахмал ЦеллюлозаСкачать

79. Что такое реакции поликонденсацииСкачать