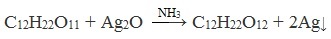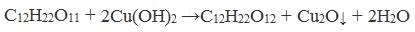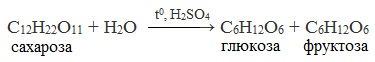Примером наиболее распространенных в природе дисахаридов (олигосахаридом) является сахароза (свекловичный или тростниковый сахар).
- Биологическая роль сахарозы
- Строение сахарозы
- Физические свойства сахарозы и нахождение в природе
- Химические свойства
- Получение сахарозы
- Применение сахарозы
- Основные сведения о сахарозе: строение, формула вещества
- Характеристика сахарозы
- Физические свойства сахарозы
- Химические свойства сахарозы. Химические реакции (уравнения) сахарозы
- Формула, молекула, строение сахарозы
- Получение и производство сахарозы
- Применение сахара в производстве
- Acetyl
- 💥 Видео
Биологическая роль сахарозы
Наибольшее значение в питании человека имеет сахароза, которая в значительном количестве поступает в организм с пищей. Подобно глюкозе и фруктозе сахароза после расщепления ее в кишечнике быстро всасывается из желудочно-кишечного тракта в кровь и легко используется как источник энергии.
Важнейший пищевой источник сахарозы — сахар.
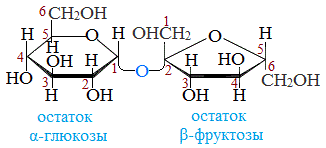
Строение сахарозы
Молекулярная формула сахарозы С12Н22О11 .
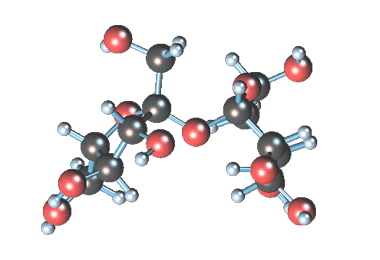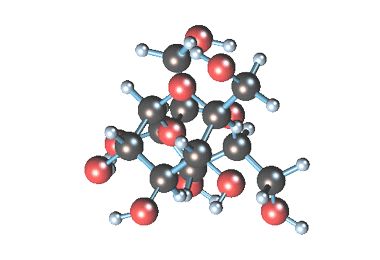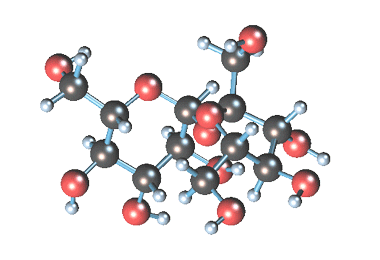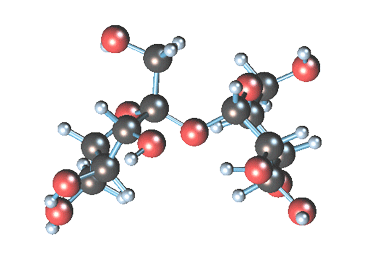
Сахароза имеет более сложное строение, чем глюкоза. Молекула сахарозы состоит из остатков молекул глюкозы и фруктозы в их циклической форме. Они соединены друг с другом за счет взаимодействия полуацетальных гидроксилов (1→2) -гликозидной связью, то есть свободный полуацетальный (гликозидный) гидроксил отсутствует:
Физические свойства сахарозы и нахождение в природе
Сахароза (обыкновенный сахар) – белое кристаллическое вещество, более сладкое, чем глюкоза, хорошо растворимое в воде.
Температура плавления сахарозы 160°C. При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
Сахароза является весьма распространённым в природе дисахаридом, она встречается во многих фруктах, плодах и ягодах. Особенно много ее содержится в сахарной свёкле (16-21%) и сахарном тростнике (до 20%), которые и используются для промышленного производства пищевого сахара.
Содержание сахарозы в сахаре 99,5%. Сахар часто называют «носителем пустых калорий», так как сахар – это чистый углевод и не содержит других питательных веществ, таких, как, например, витамины, минеральные соли.
Химические свойства
Для сахарозы характерны реакции по гидроксильным группам.
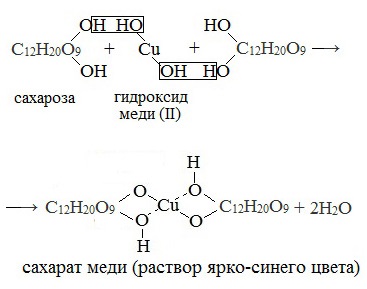
1. Качественная реакция с гидроксидом меди (II)
Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов.
Видеоопыт «Доказательство наличия гидроксильных групп в сахарозе»
Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди (качественная реакция многоатомных спиртов):
2. Реакция окисления
Восстанавливающие дисахариды
Дисахариды, в молекулах которых сохраняется полуацетальный (гликозидный) гидроксил (мальтоза, лактозы), в растворах частично превращаются из циклических форм в открытые альдегидные формы и вступают в реакции, характерные для альдегидов: реагируют с аммиачным раствором оксида серебра и восстанавливают гидроксид меди (II) до оксида меди (I). Такие дисахариды называются восстанавливающими (восстанавливают Cu (OH)2 и Ag2O).
Реакция «серебряного зеркала»
Реакция с гидроксидом меди (II)
Невосстанавливающий дисахарид
Дисахариды, в молекулах которых нет полуацетального (гликозидного) гидроксила (сахароза) и которые не могут переходить в открытые карбонильные формы, называются невосстанавливающими (не восстанавливают Cu (OH)2 и Ag2O).
Сахароза, в отличие от глюкозы, не является альдегидом. Сахароза, находясь в растворе, не вступает в реакцию «серебряного зеркала» и при нагревании с гидроксидом меди (II) не образует красного оксида меди (I), так как не способна превращаться в открытую форму, содержащую альдегидную группу.
Видеоопыт «Отсутствие восстанавливающей способности сахарозы»
3. Реакция гидролиза
Для дисахаридов характерна реакция гидролиза (в кислой среде или под действием ферментов), в результате которой образуются моносахариды.
Сахароза способна подвергаться гидролизу (при нагревании в присутствии ионов водорода). При этом из одной молекулы сахарозы образуется молекула глюкозы и молекула фруктозы:
Видеоопыт «Кислотный гидролиз сахарозы»
Мальтоза и лактоза при гидролизе расщепляются на составляющие их моносахариды за счёт разрыва связей между ними (гликозидных связей):
Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов.
В живых организмах гидролиз дисахаридов происходит при участии ферментов.
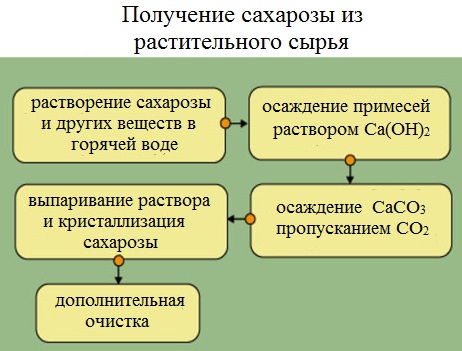
Получение сахарозы
Сахарную свеклу или сахарный тростник превращают в тонкую стружку и помещают в диффузоры (огромные котлы), в которых горячая вода вымывает сахарозу (сахар).
Вместе с сахарозой в водный раствор переходят и другие компоненты (различные органические кислоты, белки, красящие вещества и др.). чтобы отделить эти продукты от сахарозы, раствор обрабатывают известковым молоком (гидроксидом кальция). В результате этого образуются малорастворимые соли, которые выпадают в осадок. Сахароза образует с гидроксидом кальция растворимый сахарат кальция С12Н22О11·CaO·2Н2О.
Для разложения сахарата кальция и нейтрализации избытка гидроксида кальция через раствор пропускают оксид углерода ( IV).
Выпавший в осадок карбонат кальция отфильтровывают, а раствор упаривают в вакуумных аппаратах. По мере образования кристалликов сахара отделяют с помощью центрифуги. Оставшийся раствор – меласса – содержит до 50% сахарозы. Его используют для производства лимонной кислоты.
Выделенную сахарозу очищают и обесцвечивают. Для этого ее растворяют в воде и полученный раствор фильтруют через активированный уголь. Затем раствор снова упаривают и кристаллизуют.
Применение сахарозы
Сахароза в основном используется как самостоятельный продукт питания (сахар), а также при изготовлении кондитерских изделий, алкогольных напитков, соусов. Ее используют в высоких концентрациях в качестве консерванта. Путем гидролиза из нее получают искусственный мёд.
Сахароза находит применение в химической промышленности. С помощью ферментации из нее получают этанол, бутанол, глицерин, левулиновую и лимонную кислоты, декстран.
В медицине сахарозу используют при изготовлении порошков, микстур, сиропов, в том числе для новорожденных детей (для придания сладкого вкуса или консервации).
Видео:Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Основные сведения о сахарозе: строение, формула вещества
Видео:Опыты по химии. Гидролиз сахарозыСкачать

Характеристика сахарозы
Сахароза (сахар, sucrose или тростниковый сахар) — углевод, дисахарид природного происхождения. Углеводы — главный источник энергии в организме. Человек и животные не могут синтезировать их самостоятельно, поэтому запас пополняется за счет употребления растительных пищевых продуктов.
Сахароза в небольших количествах (менее 0,4 г на 100 г продукта) вместе с глюкозой присутствует в плодах и листьях многих зеленых растений. В результате обменных процессов, протекающих в клетках, остатки глюкозы образуют резервный полисахарид — крахмал. Когда основная часть глюкозы в крахмале израсходована, он переходит в сахарозу.
Высоким содержанием сахарозы отличаются:
- сок стеблей сахарного тростника 14-19 %; корни сахарной свеклы 16-21 %;
- фрукты: абрикосы до 11 %, слива до 8 %; апельсины до 6 %; яблоки, груши до 5 %;
- овощи: лук до 8 %, морковь 4-6 %;
- зародыши семян зерновых культур, например, маис до 14 % и сорго до 11 %;
- сок деревьев около 20 %, например, сахарный клен и различные виды пальм, в том числе кокосовая и финиковая.
Рисунок 1. Кристаллы сахарозы.
Физические свойства сахарозы
| Физическая характеристика | Простое вещество | Примечание |
| Цвет | белый кристаллический порошок | |
| Вкус, запах | сладкий, без запаха | |
| Растворимость в воде при 20 °С | 204 г в 100 мл | с ростом температуры растворимость увеличивается |
| Плотность | 1 , 59 г / с м 3 | |
| Т плавления | 186 °С | при застывании расплава образуется карамель |
| Т кипения раствора | 101 °С | |
| Молярная масса | 342,3 г/моль |
Таблица 1. Физические свойства сахарозы.
Из-за низкой температуры плавления быстро становится жидкой и тягучей.
Имеет изомеры с молекулярной формулой С 12 Н 22 О 11 — мальтозу и лактозу.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические свойства сахарозы. Химические реакции (уравнения) сахарозы
1. Как многоатомный спирт, к примеру, глицерин или глюкоза, сахароза имеет гидроксильные группы. Это проявляется в способности сахарозы реагировать с гидроксидами металлов.
Например, качественная реакция на сахарозу: бесцветный раствор сахарозы при реакции с C u ( O H ) 2 становится ярко-синим:
C 12 H 22 O 5 + C u ( O H ) 2 → ( C 12 H 20 O 5 ) C u ярко-синий сахарат меди (II) + 2 H 2 O .
2. Сахароза является невосстанавливающим дисахаридом и не обладает свойствами альдегидов, поэтому не идут реакции:
- «серебряного зеркала» при нагревании с аммиачным раствором оксида серебра (I);
- образования красного раствора оксида меди (I) при нагревании с гидроксидом меди (II);
- полного окисления.
3. Гидролиз сахарозы идет при кипячении с добавлением серной кислоты:
C 12 H 22 O 11 + H 2 O → t ° , H 2 S O 4 C 6 H 12 O 6 + C 6 H 12 O 6 .
В результате реакции образуется смесь двух моносахаридов — глюкозы и фруктозы.
В живых организмах гидролиз сахарозы происходит при участии ферментов.
4. Горение и обугливание сахарозы проходит в присутствии солей лития.
C 12 H 22 O 11 + 12 O 2 → с о л и L i 12 C O 2 + 11 H 2 O .
Видео:Только так можно убрать инсулинорезистентность, метаболический синдром и сахарный диабет 2 типа!Скачать

Формула, молекула, строение сахарозы
В химии сахароза имеет формулу C 12 H 22 O 11 .
Сахароза — это дисахарид, в состав которого входят остатки глюкозы и фруктозы, соединенные атомом кислорода O-глюкозидным типом связи.
Рисунок 2. Строение сахарозы.
Структура молекулы сахарозы: молекулярная кристаллическая решетка.
Видео:Отсутствие восстановительных свойств у сахарозыСкачать

Получение и производство сахарозы
Способы производства сахарозы основаны на выделении сока из растений и получении из него сначала раствора, а затем кристаллической сахарозы.
Рассмотрим на схеме получения сахарозы из свеклы.
Продукт измельчают в тонкую стружку, помещают в большие котлы (диффузоры). Через них пропускают горячую воду, которая вымывает сахарозу в виде раствора.
В нем присутствуют различные примеси, в том числе органические кислоты с общей формулой R-COOH.
Чтобы отделить их от сахарозы, в раствор добавляют известковое молоко (гидроксид кальция) C a ( O H ) 2 . Параллельно идут две реакции:
- 2 R — C O O H + C a ( O H ) 2 → ( R — C O O ) 2 C a ↓ + 2 H 2 O и
- С 12 Н 22 О 11 + C a ( O H ) 2 → С 12 Н 22 О 11 C a сахарат кальция + 2 H 2 O .
Затем через раствор сахарата кальция пропускают диоксид углерода (углекислый газ):
С 12 Н 22 О 11 C a + C O 2 + H 2 O → С 12 Н 22 О 11 + C a C O 3 ↓ .
Осадок карбоната кальция отфильтровывают, а раствор сахарозы упаривают в вакуумных аппаратах до образования кристалликов сахара. Получается сахар-сырец желтого цвета.
Далее его очищают и обесцвечивают: растворяют в воде и полученный раствор фильтруют через активированный уголь. Затем раствор снова упаривают и кристаллизуют, получая на выходе очищенный сахар или рафинад.
Видео:Карамелизация Сахарозы. Органическая химияСкачать

Применение сахара в производстве
- Пищевые производства: в качестве продукта питания; компонента кондитерских изделий, алкогольных напитков, соусов и искусственного меда. Растворы с высоким содержанием сахарозы — консервант при производстве фруктово-овощных заготовок.
- Химическая отрасль: как субстрат при ферментации этанола, глицерина, бутанола, левулиновой и лимонной кислот.
- Фармакология: тростниковый сахар используют при изготовлении лекарственных средств (сиропов, порошков), главным образом, для детей (как консервант, а также для маскировки горького или неприятного привкуса).
Биологическая функция в организме: сахароза — источник энергии. Она быстро расщепляется в пищеварительном тракте на глюкозу и фруктозу, легко проникает в кровь. Сахароза необходима для образования жира, гликогена, белково-углеродных соединений.
В умеренных количествах (до 40 грамм в день) оказывает благоприятное влияние на организм:
- активизирует работу головного мозга;
- снабжает клетки энергией;
- защищает печень от токсинов.
Однако чрезмерное употребление сахара, особенно в детском возрасте, повышает риск возникновения кариеса и диабета, ведет к ожирению.
Видео:Опыты по химии. Взаимодействие сахарозы с гидроксидом меди (II)Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 💥 ВидеоКислотный гидролиз сахарозыСкачать  Продукция Vertera | Обзор водорослей от Вертеры | СуперфудыСкачать  Гидроксид натрия.Цветные реакции с едким натром.Получение щелочи и опыты.Сульфид,сульфит из натрия!Скачать  Отсутствие восстанавливающей способности сахарозыСкачать  Отсутствие восстанавливающей способности сахарозыСкачать  Реакция сульфата меди II ( медный купорос) с гидроксидом натрия ( щелочами)Скачать  Качественные реакции на глицерин, глюкозу и сахарозуСкачать  Реакция фенолфталеина на гидроксид натрияСкачать  МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать  Гидролиз сахарозы: олимпиадная задача от кандидата химических наук (Задачи на даче-6)Скачать  ЧТО такое ЯБЛОЧНО МОЛОЧНОЕ БРОЖЕНИЕ в вине и для ЧЕГО оно НУЖНО.Скачать  Дегидратация сахарозыСкачать  Реакция СУЛЬФИТА НАТРИЯ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Простые опыты по химии.Скачать  |