Хлорид натрия NaCl — соль щелочного металла натрия и хлороводородной кислоты. Белое кристаллические вещество. Плавится и кипит без разложения. Умеренно растворяется в воде (гидролиза нет);
Относительная молекулярная масса Mr = 58,44; относительная плотность для ж. и тв. состояния d = 2,165; tпл = 800,8º C; tкип = 1465º C;
Видео:Реакция лития, натрия и калия с водойСкачать

Способ получения
1. Хлорид натрия можно получить путем взаимодействия натрия и разбавленной хлороводородной кислоты, образуются хлорид натрия и газ водород:
2Na + 2HCl = 2NaCl + H2↑.
2. При комнатной температуре, в результате взаимодействия натрия и хлора, образуется хлорид натрия:
2Na + Cl2 = 2NaCl
3. Концентрированный раствор гидроксида натрия реагирует с концентрированным раствором хлорида аммония при кипении. При этом образуются хлорид натрия, газ аммиак и вода:
NaOH + NH4Cl = NaCl + NH3↑ + H2O
4. При взаимодействии с разбавленной и холодной хлороводородной кислотой пер окси д натрия образует хлорид натрия и пероксид водорода:
5. Разбавленная хлороводородная кислота реагирует с гидроксидом натрия . Взаимодействие хлороводородной кислоты с гидроксидом натрия приводит к образованию хлорида натрия и воды:
NaOH + HCl = NaCl + H2O
6. В результате взаимодействия сульфата натрия и хлорида бария образуется сульфат бария и хлорид натрия:
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Качественная реакция
Качественная реакция на хлорид натрия — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид натрия образует нитрат натрия и осадок хлорид серебра:
NaCl + AgNO3 = NaNO3 + AgCl↓
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Химические свойства
1. Хлорид натрия вступает в реакцию со многими сложными веществами :
2.1. Хлорид натрия взаимодействует с кислотами :
2.1.1. Хлорид натрия в твердом состоянии при кипении реагирует с концентрированной серной кислотой с образованием сульфата натрия и газа хлороводорода:
а если температуру опустить до 50º С, то твердый хлорид натрия и концентрированная серная кислота образуют гидросульфат натрия и газ хлороводород:
2.2. Хлорид натрия способен вступать в реакцию обмена со многими солями :
2.2.1. Твердый хлорид натрия реагирует с концентрированной и горячей серной кислотой и твердым перманганатом калия . Взаимодействие хлорида натрия с перманганатом калия и серной кислотой приводит к образованию сульфата марганца, натрия, калия, газа хлора и воды:
2.2.2. Хлорид натрия взаимодействует с гидросульфатом натрия при температуре 450–800º C . При этом образуются сульфат натрия и хлороводородная кислота:
2.2.3. При взаимодействии холодного хлорида натрия с насыщенным нитритом серебра выделяются нитрат натрия и осадок хлорид серебра:
NaCl + AgNO2 = NaNO2 + AgCl↓
Видео:Окисление органических соединений перманганатом калияСкачать

Хлорид натрия

2Na + 2Cl = 2NaCl
Реакцией натрия с соляной кислотой :
2Na + 2HCl = 2NaCl + H2↑
Реакцией гидроксида натрия с соляной кислотой :
Реакцией на соли более слабых кислот :
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Взаимодействием гидроксида натрия с хлоридом аммония причём в ходе нагревания выделяется газообразный аммиак , подобные реакции используют ( как качественную реакцию для проверки на нахождения аммиака в солях ) :
NaOH + NH4Cl = NaCl + NH3↑ + H2O
Обменная реакция между солью щелочью с образованием новой соли и нерастворимого гидроксида :
FeCl3 + 3NaOH = Fe( OH )3↓ + 3NaCl
Видео:ТЕТРАХЛОРМЕТАН и КАЛИЙ-НАТРИЕВЫЙ сплавСкачать

Применение хлорида натрия
Хлорид натрия неотъемлемая часть жизнедеятельности всех живых организмов , он участвует в обмене веществ в организмах , а в растениях как минеральная соль без которой они погибают , у животных и людей нехватка хлорида натрия приводит к нарушению работы всего организма , так как в основном его свойства используются для выведения из организма через пот вредных веществ .
В производстве неорганических удобрений , получении натрия , хлора , водорода , в химической промышленности , для получения гидроксида натрия и всех его соединений . Большое количество используется в производстве мыла .
Действием на хлорид натрия более сильных кислот получают соляную кислоту и гидросульфат натрия , для выделения её из раствора нагревают ( 50 °С ):
NaCl + H2SO4 =NaHSO4 + HCl↑
Кипячение приводит к полному образованию сульфата натрия и соляной кислоты :
2NaCl + H2SO4 = Na2SO4 + 2HCl↑
В лабораторных условиях при взаимодействии хлорида натрия , серной кислоты и оксида свинца получают газообразный хлор ( который в свою очередь можно использовать как окислитель для получения золота и платины , метод Миллера ) :
2NaCl + 4H2SO4 + PbO2 = Cl2↑ + Pb( HSO4 )2 + 2NaHSO4 + 2H2O
Аналогично ведёт себя оксид марганца :
2NaCl + 2H2SO4 + MnO2 = Cl2↑ + MnSO4 + Na2SO4 + 2H2O
Реакцию с перманганатом калия , хлоридом натрия и концентрированной серной кислотой проводят только добавлением серной кислоты в хлорид натрия , а затем перманганат калия . Если поменять вещества местами то произойдёт мгновенное выделение оксида марганца которое приведёт к воспламенению и взрыву , поэтому подобную реакцию проводят крайне редко :
10NaCl + 8H2SO4 + 2KMnO4 = 5Cl2↑ + 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O
Реакция хлорида натрия с солями серебра приводит к осаждению солей серебра из их растворов в качестве белого творожистого осадка ( качественная реакция на ионы серебра ) :
NaCl + AgNO3 = NaNO3 + AgCl↓
NaCl + AgNO2 =NaNO3 + AgCl↓
В водных растворах при пропускании газообразного аммиака и оксида углерода образуются две новых соли хлорид аммония и гидрокарбонат натрия :
NaCl + H2O + NH3 + CO2 = NaHCO3 + NH4Cl
При нагревании до температуры ( 300°С ) хлорида натрия и хлорида алюминия образуется соединение тетрахлоралюминат натрия :
NaCl + AlCl3 = NaAlCl4
Статья на тему хлорид натрия
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Видео:Взаимодействие калия и натрия с водойСкачать

Калий и натрий
- Краткая характеристика и нахождение в природе.
- История открытия.
- Физические свойства.
- Химические свойства.
- Едкие щелочи. Соли металлов.
- Способы получения и область применения.
- Краткая характеристика и нахождение в природе.
Натрий и калий относятся к числу довольно распространенных элементов.
Содержание натрия в земной коре составляет 2,64%, калия – 2,6%.
В свободном виде калий и натрий в природе не встречаются. Эти щелочные металлы входят в состав различных соединений. Одним из таких соединений является – хлорид натрия NaCl (образует залежи каменной соли — Донбасс, Соликамск, Соль-Илецк и др).
Также хлорид натрия содержится в морской воде и соляных источниках.
Калийные соли также присутствуют в морской воде, но в значительно меньших количествах. Обычно калийные соли содержат верхние слои залежей. Самые большие в мире запасы калийных солей находятся на Урале в районе Соликамска. В Белоруссии (г.Солигорск) открыты крупные залежи калийных солей
Мы не случайно рассматриваем натрий и калий вместе, сходные своими физическими свойствами, они и открыты были одновременно.
В 1807 г. Дэви, путем электролиза слегка увлажненных твердых щелочей, были получены свободные металлы — калий и натрий. В то время они получили названия — потассий (Potassium) и содий (Sodium).
В следующем году Гильберт, издатель известных «Анналов физики»,
предложил именовать новые металлы калием и натронием (Natronium).
Позднее Берцелиус сократил последнее название до «натрий» (Natrium).
Вообще, название «натрий» (англ. и франц. Sodium, нем. Natrium) происходит от древнего слова, распространенного в Египте, у древних греков (vixpov) и римлян и соответствует древнееврейскому нетер (neter).
В древнем Египте натроном, или нитроном называли щелочь, получаемую не только из природных содовых озер, но и из золы растений. Ее употребляли для мытья, изготовления глазурей, при мумификации
трупов. В конце XVIII в. Клапрот ввел для минеральной щелочи
название натрон (Natron), а для растительной — кали (Kali).
Известно, что в начале XIX в. в России натрий называли содием.
Что касается слова калий, то оно происходит от арабского термина
алкали (щелочные вещества, именуемые в средние века “щелочные соли”). В то время их еще не отличали друг от друга и называли именами, имевшими сходное значение: натрон, боракс, варек т. д. Слово кали (qila) впервые встречается в 850 г. у арабских писателей, затем начинает употребляться слово Qali (al-Qali), которое обозначало продукт, получаемый из золы некоторых
растений. В России, в первой четверти XIX в., калий назывался потассий, поташ, а также поташий. В 1828 г. в химической литературе наряду с названием поташ уже встречается название кали (едкое кали, кали соляный и др.).
Название калий стало общепринятым во всем мире после выхода в свет учебника Гесса.
Калий и натрий – серебристо-белые металлы, с плотностью
K = 0,86 г/см3, Na = 0,97г/см3,
Эти металлы очень мягкие, режутся ножом.
Обладают всеми свойствами, присущими веществам с металлической связью, а именно: металлический блеск, пластичность, мягкость, хорошая электрическая проводимость и теплопроводность.
Это обусловлено тем, что в атомах щелочных металлов один внешний электрон приходится на 4 и более свободные орбитали, а энергия ионизации атомов низкая, в следствии чего между атомами металлов возникает металлическая связь.
В природе натрий состоит из одного изотопа
калий – из двух стабильных изотопов
При химическом взаимодействии, атомы калия и натрия легко отдают валентные электроны, переходя в положительно заряженные ионы: K+ и Na+. Оба металла являются сильными восстановителями.
Быстро окисляются на открытом воздухе, поэтому необходимо хранить калий и натрий под слоем керосина.
Реакция с водой — бурная. Эти металлы легко взаимодействуют со многими неметаллами –серой, фосфором, галогенами и др.
Образуют гидриды NaH, KH, взаимодействуя с водородом, при нагревании. Эти гидриды легко разлагаются водой с образованием
соответствующей щелочи и водорода:
NaH + H2O = NaOH + H2
При сгорании натрия в избытке кислорода образуется пероксид натрия Na2O2, который в свою очередь взаимодействует с влажным углекислым газом воздуха, выделяя кислород:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
На этой реакции основано применение пероксида натрия для получения кислорода на
подводных лодках и для регенерации воздуха в закрытых помещениях.
Едкие щелочи. Соли металлов.
Едкими щелочами называются хорошо растворимые в воде гидроксиды. Важнейшие из них NaOH и KOH.
Гидроксид натрия и гидроксид калия – белые, непрозрачные, твердые
кристаллические вещества. В воде хорошо растворяются с выделением большого количества теплоты. В водных растворах практически нацело диссоциированы и являются сильными щелочами. Проявляют все свойства оснований.
Твердые гидроксиды натрия и калия и их водные растворы поглощают оксид углерода (IV):
NaOH + CO2 = NaHCO3
2NaOH + CO2 = Na2CO3 + H2O
или в иной форме:
2OH- + CO2 = CO + H2O
В твердом состоянии на воздухе NaOH и KOH поглощают влагу, благодаря чему используются как осушители газов.
В промышленности гидроксид натрия и гидроксид калия получают электролизом концентрированных растворов соответственно NaCl и KCl. При этом одновременно получаются хлор и водород. Катодом служит железная сетка, анодом – графит.
Схему электролиза (на примере KCl) следует представлять так, KCl полностью диссоциирует на ионы K+ и Cl-. При прохождении электрического тока к катоду подходят ионы K+, к аноду – хлорид-ионы Cl-. Калий в ряду стандартных электродных потенциалов расположен до алюминия, и его ионы восстанавливаются
(присоединяют электроны) гораздо труднее, чем молекулы воды. Ионов же водорода H+ в растворе очень мало. Поэтому на катоде разряжаются молекулы воды с выделением молекулярного водорода:
2H2O + 2e- = H2 + 2OH-
Хлорид-ионы в концентрированном растворе легче отдают электроны (окисляются), чем молекулы воды, поэтому на аноде разряжаются хлорид-ионы:
Общее уравнение электролиза раствора в ионной форме:
2H2O + 2e- = H2 + 2OH- 1
2Cl- + 2H2O электролиз H2 + 2OH- + Cl2
2KCl + 2H2O электролиз H2 + 2KOH + Cl2
Аналогично протекает электролиз раствора NaCl. Раствор, содержащий NaOH и NaCl, подвергается упариванию, в результате чего выпадает в осадок хлорид натрия (он имеет намного меньшую растворимость и она мало изменяется с температурой), который отделяют и используют для дальнейшего электролиза. Гидроксид натрия получают в очень больших количествах. Он является одним из важнейших продуктов основной химической промышленности. Применяют его для очистки нефтяных продуктов – бензина и керосина, для производства мыла, искусственного шелка, бумаги, в текстильной, кожевенной, химической промышленности, а также в быту (каустик,каустическая сода).
Более дорогой продукт – гидроксид калия – применяется реже, чем NaOH.
Соли калия и натрия.
Практически все соли калия и натрия растворимы в воде.
Натрий способен образовывать соли со всеми кислотами.
Наиболее распространенными и используемыми в быту и промышленности являются – хлорид натрия NaCl (поваренная соль), сода и сульфат натрия Na2SO4.
Рассмотрим каждую из них в одельности.
Хлорид натрия NaCl – используется для консервирования пищевых продуктов, в качестве приправы при приготовлении пищи, является сырьем в промышленности при получения гидроксида натрия, хлора, соляной кислоты, соды и др.
Сульфат натрия Na2SO4 – используется в промышленности для приготовления глауберовой соли, путем кристаллизации десятиводного гидрата Na2SO4 * 10H2O.
Глауберова соль применяется в медицине как слабительное.
Соли натрия и калия (ионы натрия и калия), применяются при качественном обнаружении натрия и калия в соединениях.
Соли натрия окрашивают пламя горелки в желтый цвет.
Соли калия окрашивают пламя горелки в фиолетовый цвет.
Это очень чувствительный метод. Единственный его минус то, что в присутствии даже ничтожных количеств натрия в соединениях фиолетовый цвет маскируется желтым. В этом случае используют синее стекло, поглощающее желтые лучи.
Калийные соли используют главным образом как калийные удобрения.
- Получение и область применения.
Натрий получают в процессе электролиза расплавленного хлорида натрия или гидроксида натрия.
При электролизе расплава гидроксида натрия NaOH на катоде выделяется натрий:
а на аноде – вода и кислород:
4OH- — 4e- = 2H2O + O2
При электролизе расплава хлорида натрия NaCl на катоде выделяется натрий:
А на аноде – хлор:
Предпочтительнее, с экономической точки зрения, вследствие дороговизны гидроксида натрия,использовать в качестве основного метода электролиз расплава NaCl.
Также как и натрий, калий можно получить в процессе электролиза хлорида калия KCl и гидроксида калия KOH.
Но этот способ не получил широкого распространения, т.к. в процессе электролиза возник ряд технических трудностей, в том числе, трудность обеспечения техники безопасности.
На сегодняшний день получение калия в промышленности основано на следующих реакциях:
1. KCl + Na Ы NaCl + K
При получении калия этим способом, через расплавленный хлорид калия пропускают пары натрия при 8000С, а выделяющиеся пары калия конденсируют.
2. KOH + Na Ы NaOH + K
Здесь взаимодействие между расплавленным гидроксидом калия и жидким натрием осуществляется противотоком при температуре 4400С в реакционной колонне из никеля.
Также этими способами можно получать сплав калия с натрием. Этот сплав применяется:
в атомных реакторах, как жидкий металлический теплоноситель.
в качестве восстановителя при производстве титана.
Широко используют калий и его соединения в различных отраслях хозяйства:
- при получении некоторых красителей,
- при гидролизе крахмала,
- при производстве пороха,
- при отбелке тканей.
С помощью пероксидов натрия и калия проводится регенерация воздуха в космических кораблях и подводных лодках.
Поташ в больших количествах идет на производство стекла. Используя едкий калий производят самое лучшее — жидкое туалетное мыло.
1. “Пособие по химии для поступающих в вузы”. Г.П.Хомченко. 1976 г.
2. “Основы общей химии”. Ю.Д.Третьяков, Ю.Г.Метлин. Москва “Просвещение” 1980 г.
Ошибка в тексте? Выдели её мышкой и нажми
Остались рефераты, курсовые, презентации? Поделись с нами — загрузи их здесь!
📺 Видео
Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Решаем жгучий ПРОБНИК ЕГЭ ПО ХИМИИ 2024Скачать

Получение хлората калия методом электрооизаСкачать

8 класс. Составление уравнений химических реакций.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Самая лучшая подборка реакций с хлоратом калия! (химия)Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Реакции ионного обмена. 9 класс.Скачать

Качественная реакция на ион трехвалентного железаСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Реакции ионного обменаСкачать

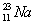 В природе натрий состоит из одного изотопа
В природе натрий состоит из одного изотопа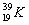 калий – из двух стабильных изотопов
калий – из двух стабильных изотопов