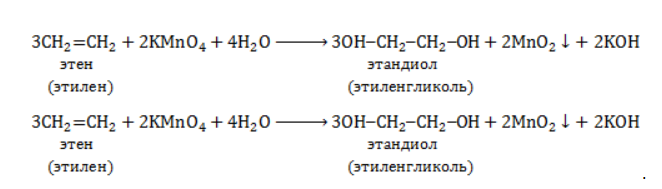
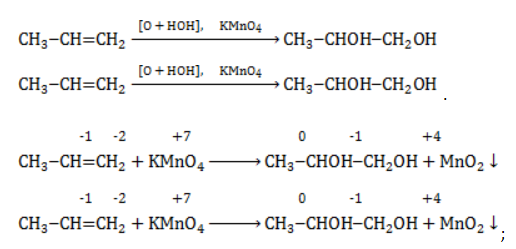
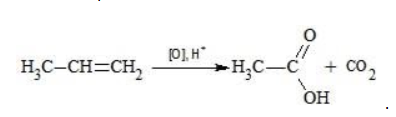
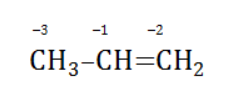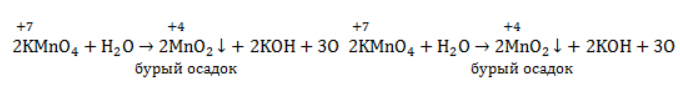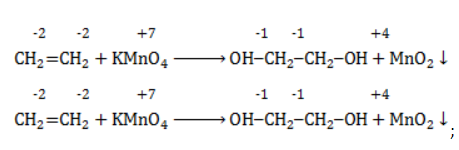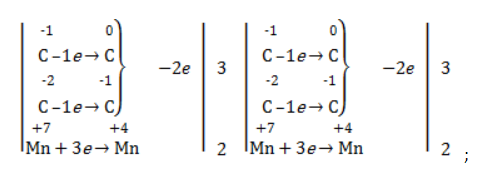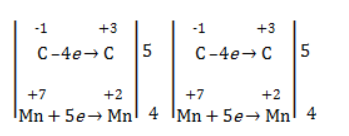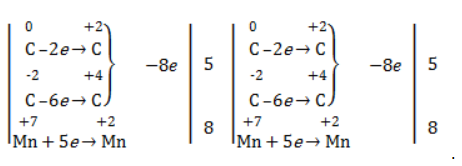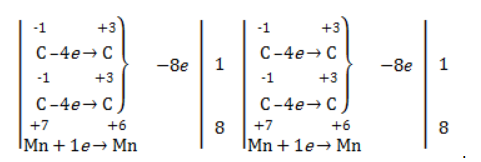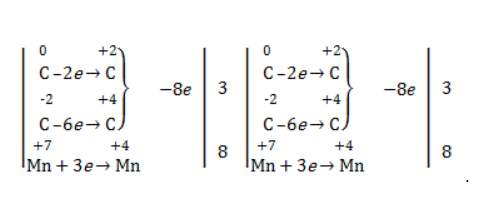Реакция Вагнера — это реакция мягкого окисления алкенов водным раствором перманганата калия. Алкены реагируют с водным раствором перманганатов при низкой температуре или без нагревания, при этом разрывается и окислятся только π-связь. Атомы углерода при двойной связи в алкене окисляются. При окислении по одной π-связи каждый атом образует по одной связи с атомами кислорода, что соответствует группе ОН. Таким образом, алкены окисляются до двухатомных спиртов (диолов или гликолей):
Составить уравнение химической реакции удобно с помощью электронного баланса:
2С –2 –2e = 2C –
Mn +7 +3e = Mn +4
Обратите внимание! При составлении баланса мы обязательно учитываем, что окисляются оба атома углерода при двойной связи.
При окислении этилена водным раствором перманганата калия образуется этиленгликоль.
Обесцвечивание водного раствора перманганата – качественная реакция на алкены!
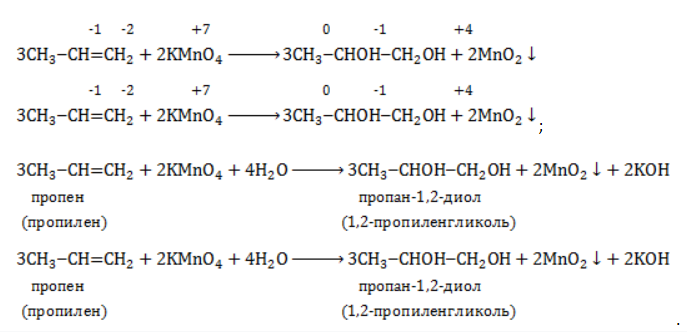
Взаимодействие пропилена с водным раствором перманганата калия:
- Окисление алкенов перманганатом калия
- Понятие о неполном окислении
- Определение степеней окисления
- Влияние среды на окислитель
- Мягкое окисление
- Жесткое окисление
- Окисление перманганатом калия в кислой среде
- Окисление алкенов в щелочной среде
- Окисление в нейтральном растворе
- Заключение
- Мягкое окисление алкенов. Пошаговый алгоритм составления уравнений.
- 🌟 Видео
Видео:Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать

Окисление алкенов перманганатом калия
В отличие от предельных углеводородов, алкены характеризуются высокой химической активностью, обусловленной особенностями строения молекулы. При обычных условиях алкены охотно вступают в реакции неполного окисления с превращением в органические соединения других классов. Универсальный реагент в процессах окисления алкенов – перманганат калия.
Видео:ОКИСЛЕНИЕ АЛКЕНОВ ЕГЭ / жёсткое, мягкое окисление в органике с KMnO4Скачать

Понятие о неполном окислении
В химии органических соединений под окислением понимается взаимодействие, при котором происходит обеднение реагента водородом или обогащение кислородом, сопровождающееся отдачей электронов молекулой. Обратный процесс называется восстановлением.
Полное окисление происходит при горении углеводородов с разрушением молекулы. Продуктами в этом случае являются углекислый газ и вода. При неполном окислении продуктами становятся различные вещества.
Высокая реакционная способность алкенов обусловливается присутствием в молекуле двойной связи. Один из ее компонентов – слабая 
Определение степеней окисления
Для того чтобы правильно записать уравнение реакции неполного окисления алкена, нужно определить степени окисления атомов до вступления во взаимодействие и после него. Они рассчитываются исходя из электроотрицательности элементов.
Например, при окислении пропена перманганатом калия 


- В составе группы
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
, отнимая у водородных атомов по одному отрицательному заряду. На связи
сдвига электронов нет. Следовательно, атом углерода приобретает степень окисления -2 -2;
- В группе
аналогичный подсчет показывает для углерода степень окисления -1 -1 (для каждого водорода соответственно +1 +1);
- В радикале
углерод оттягивает на себя отрицательные заряды с трех водородных атомов и имеет степень окисления -3 -3.
В общем виде результат можно записать следующим образом:
Расчет степеней окисления в кислородсодержащих соединениях производится аналогично с учетом большей электроотрицательности кислорода.
Видео:Окисление органических соединений перманганатом калияСкачать

Влияние среды на окислитель
Состав раствора (наряду с температурой) определяет, до какого соединения окислится восстановитель – алкен. Окислитель в растворах с различным уровнем кислотности (щелочности) также ведет себя неодинаково.
Неорганическая соль 


В нейтральной и слабощелочной среде марганец приобретает степень окисления +4 +4:
Кислород из перманганат-аниона присоединяется к алкену по месту двойной связи.
Под воздействием серной кислоты марганец восстанавливается до степени окисления +2 +2:
При окислении со щелочью (гидроксид лития достаточно высокой концентрации) марганец восстановится до +6 +6:
Видео:Мягкое окисление алкенов или реакция ВагнераСкачать

Мягкое окисление
Процесс в нейтральной или слабощелочной среде при обычной температуре представляет собой так называемое мягкое окисление перманганатом калия, или гидроксилирование. В алкене разрывается 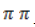
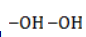
- кислород из перманганат-иона;
- вода.
Продукт реакции – диол (двухатомный спирт). Например, окисление этилена перманганатом калия приводит к образованию этиленгликоля:
Для составления полного уравнения нужно:
- определить степени окисления реагентов:
- рассчитать электронный баланс:
- расставить коэффициенты:
- ввести в уравнение недостающие реагенты и продукты, исходя из равенства состава в левой и правой частях уравнения, и определить окончательные коэффициенты:
Реакция окисления пропена в нейтральной среде перманганатом калия составляется аналогично:
Дальше мягкое окисление не идет, так как 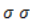
Видео:Реакция этилена с раствором перманганата калияСкачать

Жесткое окисление
Жесткими называют процессы окисления, протекающие в нейтральном растворе в условиях повышенной температуры, а также при добавлении кислоты или щелочи. В этих случаях двойная связь в алкене разрушается полностью, а продуктами реакции становятся кетоны, кислоты (с промежуточным окислением до альдегида) либо соли.
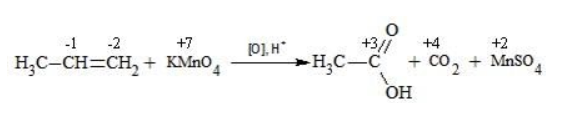
Окисление перманганатом калия в кислой среде
Пропен в содержащем кислоту растворе 

Степени окисления участвующих в реакции углеродных атомов и марганца составят:
Электронный баланс определяется только с учетом углерода, вошедшего в состав кислоты:
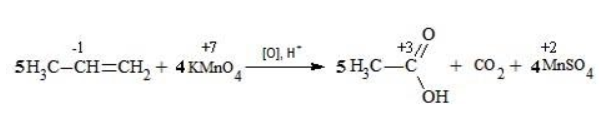
Сначала расставляются коэффициенты в окислителе, восстановителе и в продуктах окисления:
Затем вписываются недостающие вещества и полностью рассчитываются коэффициенты:
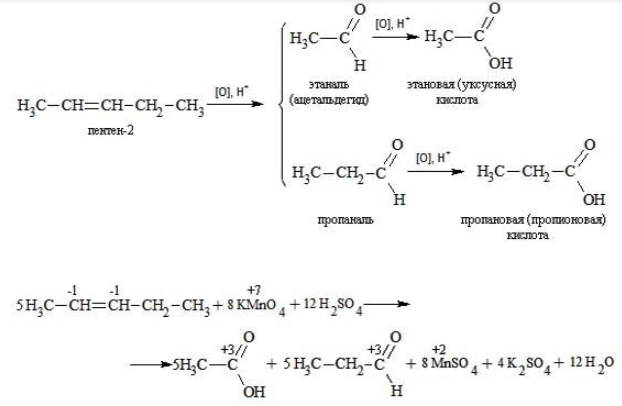
Еще один пример жесткого окисления алкенов перманганатом калия с серной кислотой – реакция с участием пентена-2. Молекула расщепляется по месту двойной связи, и ее фрагменты окисляются через промежуточное образование альдегидов до двух кислот:
Электронный баланс составляется для двух углеродных атомов алкена, поскольку оба они являются восстановителями.
Правило, по которому осуществляется окисление углерода, отражено в таблице:
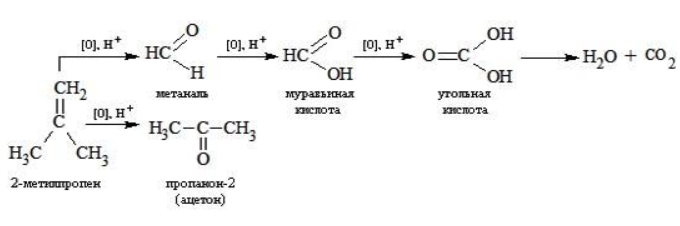
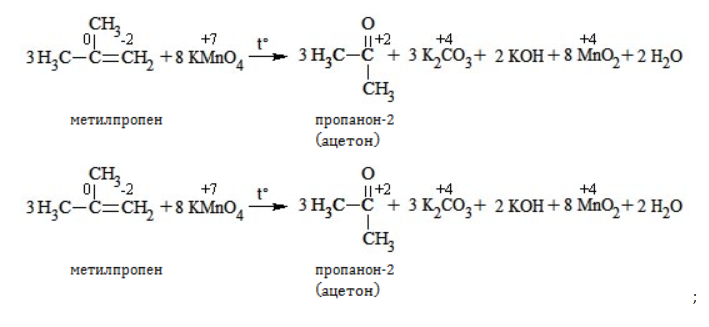
Так, в 2-метилпропене первичный атом окисляется через промежуточные формальдегид (метаналь) и муравьиную кислоту полностью – до углекислого газа, а третичный – только до ацетона:
Окисление алкенов в щелочной среде
При нагревании с концентрированной щелочью алкены окисляются до солей:
Если один из углеродных атомов – первичный, он окисляется до углекислого газа:
Окисление в нейтральном растворе
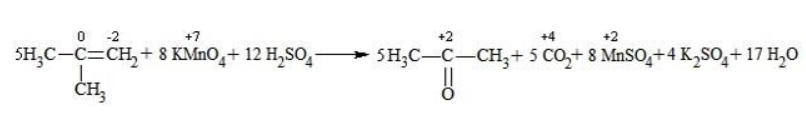
В условиях высокой температуры образующаяся щелочь вступает в реакцию, в результате которой окисление алкенов продолжается до образования кетонов или солей. Так, при жестком окислении пропена в нейтральной среде получаются те же продукты, что и в присутствии концентрированного гидроксида калия: ацетат 




Кетон – результат окисления третичного углеродного атома, и дальнейшую реакцию они не поддерживают. Например, при окислении метилпропена как конечный продукт образуется ацетон:
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Заключение
Взаимодействие с раствором перманганата калия в мягких или жестких условиях является показателем высокой реакционной способности алкенов, которая обусловлена присутствием в молекуле легко разрываемой -связи. Реакции мягкого и жесткого окисления относятся к числу характерных химических свойств алкенов как ненасыщенных углеводородов.
Видео:Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать

Мягкое окисление алкенов. Пошаговый алгоритм составления уравнений.
Под мягким окислением алкенов подразумевают действие на них нейтрального холодного водного раствора перманганата калия. В результате такого окисления образуются, так называемые вицинальные диолы – двухатомные спирты с двумя ОН-группами при соседних атомах углерода в молекуле.
Поскольку среда нейтральная, в качестве продуктов восстановления перманганата калия образуются диоксид марганца — MnO2 и щелочь.
Вывод о том, что вода также является реагентом (будет входить в левую часть уравнения реакции), можно легко сделать хотя бы по тому, что в молекуле органического вещества появляются дополнительные атомы водорода, которых в перманганате нет.
Таким образом, схема реакции будет выглядеть так:
Расставим коэффициенты в этой схеме методом электронного баланса. Для этого сначала нужно определить степени окисления у тех атомов углерода, при которых изменилось окружение (в нашем случае у тех атомов углерода, к которым прикрепятся ОН группы). Отметим, что при окислении органических веществ степень окисления водорода не меняется и равна +1.
Для расстановки степеней окисления атомов углерода в органических веществах можно использовать так называемый метод блоков. В данном методе мы должны мысленно «изолировать» друг от друга фрагменты молекулы органического вещества по углерод-углеродным связям и рассматривать такие фрагменты условно как нейтральные молекулы. В частности, формулу пропена можно разбить на условно нейтральные блоки таким образом:
Далее, приняв заряд каждого блока за 0 и помня, что водород в органических веществах всегда имеет степень окисления, равную +1, несложно посчитать степени окисления всех атомов углерода.
Обозначим степени окисления первого, второго и третьего атомов С как х, у, и z соответственно. Тогда, подписав степени окисления для каждого элемента в формуле, мы получим:
Таким образом, составив уравнения и решив их, получаем:
Проведем аналогичную манипуляцию с формулой органического продукта окисления. Разбиваем мысленно его молекулу на нейтральные блоки по углерод-углеродным связям. Пусть степени окисления первого, второго и третьего атома С также будут равны x, y и z соответственно. Атомы водорода в органике всегда имеют степень окисления +1, а кислорода практически всегда -2 (за исключением редких случаев — органических пероксидов, которые в ЕГЭ не рассматриваются). Поэтому, подписав степени окисления для каждого элемента, получим:
Далее, составим уравнения, помня, что условно заряд каждого блока равен нулю, и решим их:
y + 1 −2 +1 = 0 => y = 0
z + 2·1 − 2 +1 = 0 => z = −1
Таким образом, мы видим, что степень окисления первого атома углерода не изменилась, что и логично, ведь не изменилось его окружение.
Степень окисления второго атома С была равна -1, стала равна 0.
Степень окисления третьего атома С была равна -2, стала равна -1.
Также в этой окислительно-восстановительной реакции изменяется степень окисления марганца. Изначально она была равна +7 (в перманганате калия), после реакции стала равна +4 (в диоксиде марганца).
Запишем еще раз схему реакции и составим для нее электронный баланс, используя в балансе только те атомы С, степень окисления которых изменилась:
3·| С −1 С −2 − 2е − → С 0 С −1
2·| Mn +7 + 3e − → Mn +4
(вывод о том, что от двух атомов С слева нужно отнять 2 электрона делаем на основании того, что суммарный заряд двух «атомов» С слева равен -3, а справа -1)
Перенесем коэффициенты из электронного баланса в схему:
Далее, мы видим, что в левой части схемы уже точно известно количество атомов калия, поскольку перед единственным калийсодержащим веществом левой части известен коэффициент. Таким образом, очевидно, что перед KOH в правой части схемы нужно поставить коэффициент 2. Получаем:
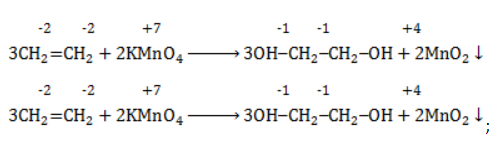
Далее, мы видим, что в левой части уравнения уже известно точное количество атомов кислорода, поскольку перед всеми кислородсодержащими веществами правой части коэффициенты известны. Всего в правой части уравнения 12 атомов кислорода. В левой части (не считая воды) – 8 атомов кислорода. Таким образом, чтобы в левой части тоже было 12 атомов кислорода, перед водой нужно поставить коэффициент 4. Таким образом, конечное уравнение окисления пропилена нейтральным холодным раствором перманганата будет иметь вид:
Следует отметить, что абсолютно такие же коэффициенты в уравнении реакции будут при мягком окислении любого другого органического вещества с одной двойной связью (при условии, что в молекуле будут отсутствовать другие фрагменты, способные к окислению).
Для демонстрации того, что коэффициенты будут идентичными, давайте рассмотрим мягкое окисление 2-фенилпропена
Схема окисления 2-фенилпропена будет выглядеть следующим образом:
Учитывая опыт примера с мягким окислением пропена, мы будем определять степени окисления не всех атомов углерода, а только тех, у которых изменилось окружение. Поэтому в молекуле 2-фенилпропена мы выделим только два условно нейтральных блока. Обозначив степени окисления атомов углерода как x и y, а также не забывая, что степень окисления водорода в органических веществах равна +1, подпишем степени окисления для каждого элемента в выделенных блоках:
Таким образом, составив и решив уравнения получаем:
x = 0
Аналогично поступим с продуктом окисления:
x −2 + 1 = 0 => x = 1
y +2·1 −2 + 1 = 0 => y = −1
Запишем повторно схему окисления 2-фенилпропена нейтральным раствором перманганата и составим электронный баланс:
3|С 0 С −2 − 2е − → С +1 С −1
2|Mn +7 + 3e − → Mn +4
Перенесем коэффициенты из электронного баланса в схему реакции:
Далее мы видим, что калия в левой части схемы 2, значит коэффициент 2 нужно поставить перед KOH. Получаем:
В правой части мы видим 12 атомов кислорода, в связи с чем для получения такого же количества атомов кислорода в левой части перед водой необходимо поставить коэффициент 4. Таким образом, конечное уравнение мягкого окисления 2-фенилпропена холодным нейтральным раствором перманганата калия будет иметь вид:
Как можно видеть, коэффициенты в этом уравнении полностью совпали с коэффициентами уравнения реакции мягкого окисления пропилена.
🌟 Видео
Как уравнять органическую ОВР? Реакция мягкого окисления алкенов Вагнера//Подготовка к ЕГЭ по ХимииСкачать

Окисление алкенов с Тасей | Химия ЕГЭСкачать

Химические свойства алкенов | Химия 10 класс | УмскулСкачать

Алкены. Ч.3-3. Химические свойства. Реакции окисления и горения.Скачать

Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Мягкое окисление алкенов. Реакция Вагнера.Скачать

ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

2.3. Алкены: Химические свойстваСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Как расставить коэффициенты в органических ОВР? | Екатерина СтрогановаСкачать

Химия с нуля — Химические свойства АлкеновСкачать

Алкены. Реакция окисления. Практическая часть. 10 класс.Скачать



 углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей