Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание
Видео:Муравьиная кислота. РеакцииСкачать  Муравьиная кислота
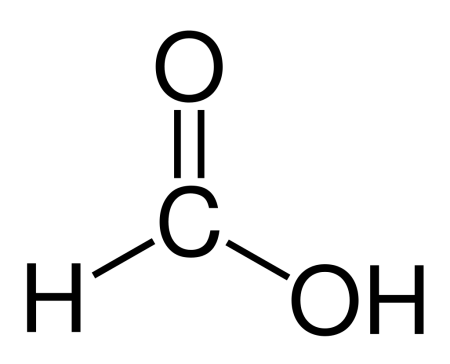
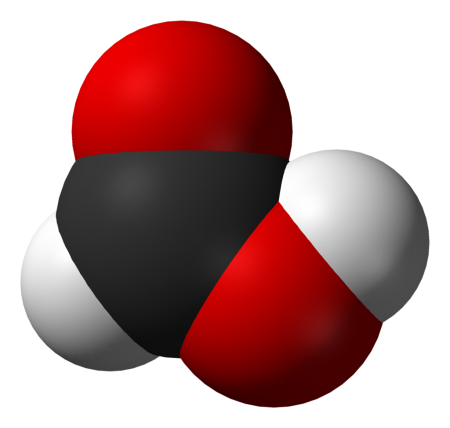
Муравьиная кислота (систематическое наименование: метановая кислота) HCOOH — органическое соединение, первый представитель в ряду насыщенных одноосновных карбоновых кислот. Зарегистрирована в качестве пищевой добавки под обозначением E236. Своё название муравьиная кислота получила потому, что впервые она была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв. В природе также обнаружена у пчёл, в крапиве, хвое. Соли и анионы муравьиной кислоты называются формиатами. Видео:Качественная реакция на альдегиды с гидроксидом медиСкачать  Содержание
Видео:Взаимодействие муравьиной кислоты с гидроксидом меди II при нагреванииСкачать  Физические и химические свойстваПри стандартных условиях муравьиная кислота представляет собой резко пахнущую бесцветную жидкость. Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом. Константа диссоциации: 1,772⋅10 −4 . Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например: При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается на воду и моноксид углерода: Муравьиная кислота реагирует с аммиачным раствором оксида серебра: Взаимодействие муравьиной кислоты с гидроксидом меди: Проявляет все свойства одноосновных карбоновых кислот: Образует формиаты с металлами: Со спиртами образует сложные эфиры: HCOOH + CH3OH → HCOOCH3 + H2O Видео:Качественная Реакция На Альдегиды С Гидроксидом Меди.Скачать  Получение
Видео:Окисление метаналя HCHO + Cu(OH)2 → и муравьиной кислоты HCOOH + [Ag(NH3)2]OH → ХИМИЯ ЕГЭ 10 классСкачать ![Окисление метаналя HCHO + Cu(OH)2 → и муравьиной кислоты HCOOH + [Ag(NH3)2]OH → ХИМИЯ ЕГЭ 10 класс](https://i.ytimg.com/vi/JmXSmUSQZmU/0.jpg) БезопасностьОпасность муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10 % обладает раздражающим эффектом, больше 10 % — разъедающим. При контакте с кожей 100%-я жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Контакт с концентрированными парами муравьиной кислоты может привести к повреждению глаз и дыхательных путей. Случайное попадание внутрь даже разбавленных растворов вызывает явления тяжёлого некротического гастроэнтерита. Муравьиная кислота быстро метаболизируется и выводится организмом. Тем не менее, муравьиная кислота и формальдегид, образующиеся при отравлении метанолом, вызывают повреждение зрительного нерва и ведут к слепоте. По данным ПДК в воздухе рабочей зоны равна 1 мг/м 3 (максимально-разовая). Может попадать в организм при вдыхании. Порог восприятия запаха может достигать, например, 453 мг/м 3 . можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками СИЗОД) приведёт к чрезмерному воздействию муравьиной кислоты на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Для защиты от неё следует использовать более эффективные изменение технологии и средства коллективной защиты. Видео:Что если в соляную кислоту добавить медьСкачать  Нахождение в природеВ природе муравьиная кислота обнаружена в хвое, крапиве, фруктах, едких выделениях медуз, пчёл и муравьёв. Муравьиная кислота впервые была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв, чем и объясняется её название. В больших количествах муравьиная кислота образуется в качестве побочного продукта при жидкофазном окислении бутана и лёгкой бензиновой фракции в производстве уксусной кислоты. Муравьиную кислоту получают также гидролизом формамида ( 35 % от общего мирового производства); процесс состоит из нескольких стадий: карбонилирование метанола, взаимодействие метилформиата с безводным NH3 и последующий гидролиз образовавшегося формамида 75%-ной H2SO4. Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного амина), гидратацию СО в присутствии щёлочи (кислоту выделяют из соли действием H2SO4), дегидрогенизацию CH3OH в паровой фазе в присутствии катализаторов, содержащих Cu, а также Zr, Zn, Cr, Mn, Mg и др. (метод не имеет промышленного значения). Видео:Опыты по химии. Окисление муравьиного альдегида гидроксидом меди (II)Скачать  ПрименениеВ основном, муравьиную кислоту используют как консервирующий и антибактериальный агент при заготовке корма. Муравьиная кислота замедляет процессы гниения и распада, поэтому сено и силос, обработанные муравьиной кислотой, дольше сохраняются. Муравьиная кислота также используется в протравном крашении шерсти, для борьбы с паразитами в пчеловодстве, как растворитель в некоторых химических реакциях. В лабораториях используют разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5, для получения монооксида углерода. В медицине используется для приготовления растворов пермуравьиной кислоты («первомур», или рецептура «С-4» (смесь перекиси водорода и муравьиной кислоты)). Первомур используют в хирургии в качестве предоперационного антисептического средства, в фармацевтической промышленности для дезинфекции оборудования. Видео:Особые свойства муравьиной кислоты | ХимияСкачать  Производные муравьиной кислотыСоли и эфиры муравьиной кислоты называют формиатами. Видео:Химия. 7 класс. Реакции разбавленных кислот с металлами /26.01.2021/Скачать  Медь. Химия меди и ее соединенийПоложение в периодической системе химических элементовМедь расположена в 11 группе (или в побочной подгруппе II группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева. Электронное строение медиЭлектронная конфигурация меди в основном состоянии : +29Cu 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 1s 3s У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень. Физические свойстваМедь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства. Изображение с портала zen.yandex.com/media/id/5d426107ae56cc00ad977411/uralskaia-boginia-liubvi-5d6bcceda660d700b075a12d Температура плавления 1083,4 о С, температура кипения 2567 о С, плотность меди 8,92 г/см 3 . Медь — ценный металл в сфере вторичной переработки. Сдав лом меди в пункт приема, Вы можете получить хорошее денежное вознаграждение. Подробнее про прием лома меди. Нахождение в природеМедь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2 (OH) 2 CO 3 . Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн . Способы получения медиМедь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
Например , вытеснение меди из сульфата железом: CuSO4 + Fe = Cu + FeSO4
1) Обжиг сульфидов: 2CuS + 3O2 = 2CuO + 2SO2 2) восстановление меди из оксида, например, водородом: CuO + H2 = Cu + H2O
Качественные реакции на ионы меди (II)Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами . При этом образуется голубой осадок гидроксида меди(II). Например , сульфат меди (II) взаимодействует с гидроксидом натрия: Соли меди (II) окрашивают пламя в зеленый цвет. Химические свойства медиВ соединениях медь может проявлять степени окисления +1 и +2. 1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами. 1.1. При нагревании медь реагирует с достаточно сильными окислителями , например , с кислородом , образуя CuО, Cu2О в зависимости от условий: 2Cu + О2 → 2CuО 1.2. Медь реагирует с серой с образованием сульфида меди (II): Cu + S → CuS 1.3. Медь взаимодействует с галогенами . При этом образуются галогениды меди (II): Но, обратите внимание: 2Cu + I2 = 2CuI 1.4. С азотом, углеродом и кремнием медь не реагирует: Cu + N2 ≠ Cu + C ≠ Cu + Si ≠ 1.5. Медь не взаимодействует с водородом. 1.6. Медь взаимодействует с кислородом с образованием оксида: 2Cu + O2 → 2CuO 2. Медь взаимодействует и со сложными веществами: 2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II): 2.2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.). Например , медь не реагирует с разбавленной серной кислотой : 2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой . При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода: 2.4. Медь реагирует даже при обычных условиях с азотной кислотой . С концентрированной азотной кислотой: С разбавленной азотной кислотой: Реакция меди с азотной кислотой 2.5. Растворы щелочей на медь практически не действуют. 2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей . Например , медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути: Hg(NO 3 ) 2 + Cu = Cu(NO 3 ) 2 + Hg 2.7. Медь окисляется оксидом азота (IV) и солями железа (III) 2Cu + NO2 = Cu2O + NO Оксид меди (II)Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета. Способы получения оксида меди (II)Оксид меди (II) можно получить различными методами : 1. Термическим разложением гидроксида меди (II) при 200°С : 2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С: 2Cu + O2 2CuO 3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2: Химические свойства оксида меди (II)Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства) . При этом он является довольно сильным окислителем. 1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли. Например , оксид меди (II) взаимодействует с соляной кислотой: СuO + 2HBr = CuBr2 + H2O CuO + 2HCl = CuCl2 + H2O 2. Оксид меди (II) вступает в реакцию с кислотными оксидами. Например , оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II): 3. Оксид меди (II) не взаимодействует с водой. 4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства: Например , оксид меди (II) окисляет аммиак : 3CuO + 2NH3 → 3Cu + N2 + 3H2O Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании: СuO + C → Cu + CO Более активные металлы вытесняют медь из оксида. Например , алюминий восстанавливает оксид меди (II): 3CuO + 2Al = 3Cu + Al2O3 Оксид меди (I)Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета. Способы получения оксида меди (I)В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой: Химические свойства оксида меди (I)1. Оксид меди (I) обладает основными свойствами. При действии на оксид меди (I) галогеноводородных кислот получают галогениды меди (I) и воду: Например , соляная кислота с оксидом меди (I) образует хлорид меди (I): Cu2O + 2HCl = 2CuCl↓ + H2O 2. При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II): 3. Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2] + . Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I): Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом : СH ≡ CH + 2[Cu(NH3)2]Cl → СuC ≡ CCu + 2NH4Cl 4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность: Например , при взаимодействии с угарным газом, более активными металлами или водородом оксид меди (II) проявляет свойства окислителя : Cu2O + CO = 2Cu + CO2 А под действием окислителей, например, кислорода — свойства восстановителя : Гидроксид меди (II)Способы получения гидроксида меди (II)1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II). Например , хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия: CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl Химические свойстваГидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных ). 1. Взаимодействует с кислотами . Например , взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды: 2. Гидроксид меди (II) легко взаимодействует с раствором аммиака , образуя сине-фиолетовое комплексное соединение: 3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение: Но этой реакции в ЕГЭ по химии пока нет! 4. При нагревании гидроксид меди (II) разлагается : Соли медиСоли меди (I)В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность . Как восстановители они реагируют с окислителями. Например , хлорид меди (I) окисляется концентрированной азотной кислотой : Также хлорид меди (I) реагирует с хлором : 2CuCl + Cl2 = 2CuCl2 Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты: 4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O Прочие галогениды меди (I) также легко окисляются другими сильными окислителями: Иодид меди (I) реагирует с концентрированной серной кислотой : Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании: Для соединений меди (I) возможна реакция диспропорционирования : 2CuCl = Cu + CuCl2 Комплексные соединения типа [Cu(NH3)2] + получают растворением в концентрированном растворе аммиака : Соли меди (II)В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства. Например , соли меди (II) окисляют иодиды и сульфиты : 2CuCl2 + 4KI = 2CuI + I2 + 4KCl Бромиды и иодиды меди (II) можно окислить перманганатом калия : Соли меди (II) также окисляют сульфиты : Более активные металлы вытесняют медь из солей. Например , сульфат меди (II) реагирует с железом : CuSO4 + Fe = FeSO4 + Cu Сульфид меди (II) можно окислить концентрированной азотной кислотой . При нагревании возможно образование сульфата меди (II): Еще одна форма этой реакции: CuS + 10HNO 3( конц .) = Cu(NO 3 ) 2 + H 2 SO 4 + 8NO 2 ↑ + 4H 2 O При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы: 2CuS + 3O2 2CuO + 2SO2↑ Соли меди (II) вступают в обменные реакции, как и все соли. Например , растворимые соли меди (II) реагируют с сульфидами: CuBr2 + Na2S = CuS↓ + 2NaBr При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II): CuSO 4 + 2NaOH = Cu(OH) 2 ↓ + Na 2 SO 4 Электролиз раствора нитрата меди (II): Некоторые соли меди при нагревании разлагаются , например , нитрат меди (II): Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду: При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы: При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты: Видео:Реакция меди с азотной кислотой. Химический опытСкачать  Медь и соединения меди1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций. 2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций. 3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций. 4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций. 5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций. 6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций. 7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций. 8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций. 9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций. 10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций. 11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций. 12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций. 13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций. 14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций. 15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций. 16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций. 17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций. 18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций. 19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций. 20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций. 21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций. 22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций. 23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций. 24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций. 25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций. 26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций. 27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций. 🎥 ВидеоПолучение гидроксида меди (II) и растворение его в кислотахСкачать  Опыты по химии. Взаимодействие муравьиной кислоты с цинкомСкачать  Взаимодействие меди с концентрированной азотной кислотой - 9 - 11 классСкачать  Реакции металлов с кислородом и водой. 8 класс.Скачать  Реакция МЕДИ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Получение СУЛЬФАТА МЕДИ.Опыты по химии.ЭкспериментыСкачать  Реакция оксида меди(II) со спиртом.Скачать  Почему муравьиная кислота такая странная??Скачать  Медь и азотная кислота 🧑🔬Скачать  Реакция "серебряного зеркала" для муравьиной кислоты/Подготовка к ЕГЭ по ХимииСкачать  Муравьиная кислота. Или альдегид? | Школьная химия | Даниил БазановСкачать  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||






 2s
2s
 3d
3d 




