Задача 584.
Написать в ионно-молекулярной форме уравнения реакций взаимодействия между водными растворами следующих веществ:
a) NaHCO3 + HCl ⇔;
б) FeCl3 + 3KOH ⇔;
в) Pb(CH3COO)2 + Na2S ⇔;
г) 2КHS + H2SO4 ⇔;
д) Zn(NO3)2 + 2KOH ⇔;
е) Са(ОН)2 + СО2⇔;
ж) Са(ОН)2 + СО2(избыток) ⇔.
Для каждого случая указать причину смещения равновесия в сторону прямой реакции.
Решение:
a) NaHCO3 + HCl ⇔ NaCl + H2O + CO2↑;
HCO3 — + H + ⇔ H2O + CO2↑.
Равновесие системы смещено в сторону прямой реакции, потому что при реакции образуется неустойчивая угольная кислота, которая в водных растворах распадается на углекислый газ и воду:
б) FeCl3 + 3KOH ⇔ Fe(OH)3↓ + 3H2O;
Fe 3+ + 3OH — ⇔ Fe(OH)3↓.
Равновесие системы смещено в сторону прямой реакции, потому что при реакции образуется малорастворимое вещество Fe(OH)3.
Равновесие системы смещено в сторону прямой реакции, потому что при реакции образуется малорастворимое вещество PbS.
Равновесие системы смещено в сторону образования малодиссциируемого электролита H2S.
В результате реакции образуется малорастворимое вещество гидроксид цинка, поэтому равновесие системы сместится вправо.
Равновесие реакции смещено вправо, потому что образуется малорастворимое вещество карбонат кальция.
2ОН — +2СО 2– ⇔ НСО3 — .
При избытке углекислого газа карбонат кальция превращается в гидрокарбонат кальция. В данной реакции при избытке углекислого газа в растворе происходит реакция:
Хотя при данном процессе образуется электролит, но равновесие реакции всё же смещено вправо, потому что согласно принципу Ле Шателье, равновесие системы при избытке углекислого газа будет смещено в сторону уменьшения его концентрации, действительно при постоянном подведении углекислого газа в систему осадка не образуется.
Задача 585.
Какие из перечисленных ниже солей подвергаются гидролизу: NaCN, KNO3, KOCl, NaNO2, CH3COONH4, CaCl2, NaClO4, HCOOK, KBr? Для каждой из гидролизующихся солей написать уравнение гидролиза в ионно-молекулярной форме и указать реакцию ее водного раствора.
Решение:
a) NaCN — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
CN — + H2O ⇔ HCN + OH — .
При гидролизе образуется дополнительное количество ионов OH-, которые придают раствору щелочную среду, рН > 7.
б) KNO3 — соль сильного основания и сильной кислоты, поэтому гидролизу не подвергается. рР = 7, реакция среды нейтральная.
в) KOCl — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
ClO — + H2O ⇔ HOCl + OH —
При гидролизе соли образуется дополнительное количество ионов OH-, которые придают раствору щелочную среду, рН > 7.
г) NaNO2 — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
При гидролизе образуется дополнительное количество ионов OH-, которые придают раствору щелочную среду, рН > 7.
д) CH3COONH4 — соль слабого основания и слабой кислоты, поэтому гидролиз протекает как по катиону, так и по аниону:
Так как K(NH4OH) ()= K(CH3COOH) = 1.8 . 10 -5 , то гидролиз соли равномерно протекает как по катиону, так и по аниону, т.е. содержание ионов H+ и OH- примерно одинаково, поэтому рН ((= 7. Реакция среды нейтральная.
е) CaCl2, NaClO4 и KBr являются солями сильных оснований и сильных кислот, поэтому гидролиз этих солей не протекает и, реакция их растворов будет нейтральной, рН = 7.
ж) HCOOK — соль сильного основания и слабой кислоты, поэтому гидролиз соли протекает по аниону:
HCOO — + H2O ⇔ HCOOH + OH —
При гидролизе соли образуется дополнительное количество ионов OH-, которые придают раствору щелочную среду, рН > 7.
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Уравнение реакции мононатриевой соли гидрохинона с углекислым газом в водном растворе
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Приведите молекулярную и структурную формулы фенола.
Молекулярная формула фенола: C6H5OH.
Структурная формула фенола: 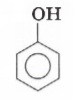
Найдите черты сходства и различия в строении молекул фенола и этанола.
Сходство: молекулы имеют в своём составе гидроксильную группу ОН, которая связана с атомом углерода.
Различия: в молекуле фенола гидроксильная группа связана с ароматическим радикалом, а в этаноле ― с алкильным радикалом.
Задание 2 Как взаимное влияние фенильного радикала и гидроксильной группы отражается на свойствах фенола? Ответ проиллюстрируйте уравнениями химических реакций.
Влияние фенильного радикала –C6H5 на гидроксильную группу выражается в значительном усилении кислотных свойств, так, например, фенол, в отличие от спиртов, вступает в реакцию нейтрализации со щелочами:
C6H5OH + NaOH ⟶ C6H5ONa + H2O
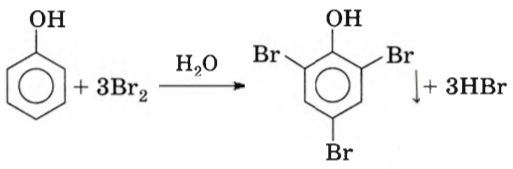
Влияние гидроксильной группы на фенильный радикал –C6H5 выражается в значительном облегчении протекания реакции по фенильному радикалу, так, например, для бромирования фенола, в отличие от бензола, не требуется катализатор и замещаются сразу три атома водорода в положениях 2, 4 и 6 с образованием белого нерастворимого осадка 2,4,6-трибромфенола:
Задание 3
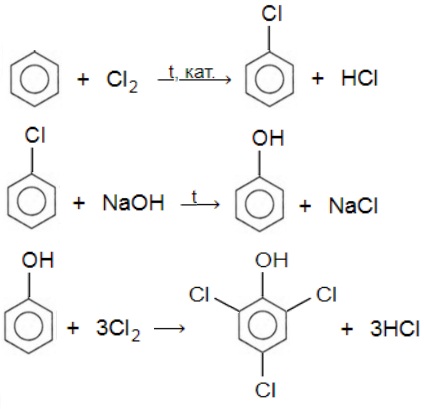
В настоящее время вместо фенола в качестве дезинфицирующего средства используют 2,4,6-трихлорфенол. Предложите способ его получения исходя из бензола. Напишите уравнения соответствующих реакций.
или
С6H6 + Cl2 t,кат. ⟶ C6H5Cl + HCl
C6H5Cl + NaOH t ⟶ C6H5OH + NaCl
C6H5OH + 3Cl2 ⟶ C6H2Cl3OH + 3HCl
Задание 4
В результате взаимодействия 47 г водного раствора фенола с бромной водой выпало 1,655 г осадка. Рассчитайте массовую долю фенола в исходном растворе.
Дано: m(раствора)=47 г, m(C6H2 Br3OH )=1,655 г
Найти: ω(C6H5OH)—?
Решение
1. Количество вещества осадка рассчитываем по формуле: n=m/M, где M ― молярная масса.
M( C6H2Br3OH )=331 г/моль
n( C6H2Br3OH )=m( C6H2 Br3OH )/M( C6H2 Br3OH )=1,655 г : 331 г/моль=0,005 моль
2. Составим химическое уравнение:
C6H5OH + 3Br2 = C6H2Br3OH↓ + 3HBr
По уравнению реакции n(C6H5OH):n(C6H2Br3OH)=1:1, количество вещества одинаковое, поэтому
n( C6H5OH )=n( C6H2 Br3OH )=0,005 моль
3. Рассчитываем массу фенола количеством вещества 0,005 моль по формуле: m = n • M, где M ― молярная масса.
M ( C6H5OH )=94 г/моль
m( C6H5OH )=n ( C6H5OH ) • M( C6H5OH )=0,005 моль • 94 г/моль=0,47 г
4. Рассчитываем массовую долю фенола в растворе:
ω ( C6H5OH )=( m ( C6H5OH ):m(раствора)) • 100%=(0,47 г : 47 г) •100%=1%
Ответ: 1%
Задание 5
В трёх пробирках без подписи находятся водные растворы пропанола-1, глицерина и фенола. С помощью каких реагентов можно определить каждый из растворов?
Качественной реакцией на фенол является реакция с бромной водой при комнатной температуре, в результате образуется белый осадок.
Качественной рекцией на глицерин (мноатономный спирт) является реакция со свежеполученным осадком гидроксида меди (II), в результате которой образуется раствор ярко-синего цвета.
Определить раствор пропанола-1 можно при помощи оксида меди (II), при его добавлении, наблюдается окисление спирта до альдегида, и раствор приобретает фруктовый запах.
Задание 6
Фенолят натрия взаимодействует с углекислым газом с образованием гидрокарбоната натрия и фенола согласно уравнению C6H5ONa + CO2 + H2O ⟶ C6H5OH + NaHCO3 Какой вывод относительно кислотных свойств фенола и угольной кислоты можно сделать на основании этой реакции? Фенол является слабой кислотой, при этом кислотные свойства фенола настолько слабые, что даже такая слабая кислота, как угольная, вытесняет фенол из раствора его солей .
Задание 7
Опишите физические свойства фенола.
Фенол ― бесцветные кристаллы, розовеющие при хранении на воздухе, с температурой плавления 41°C и температурой кипения 181,2°C, летучие, имеют специфический стойкий запах (запах гуаши, или так называемый «карболовый запах»). При комнатной температуре фенол растворим в воде незначительно, а при нагревании до 70°С растворяется полностью.
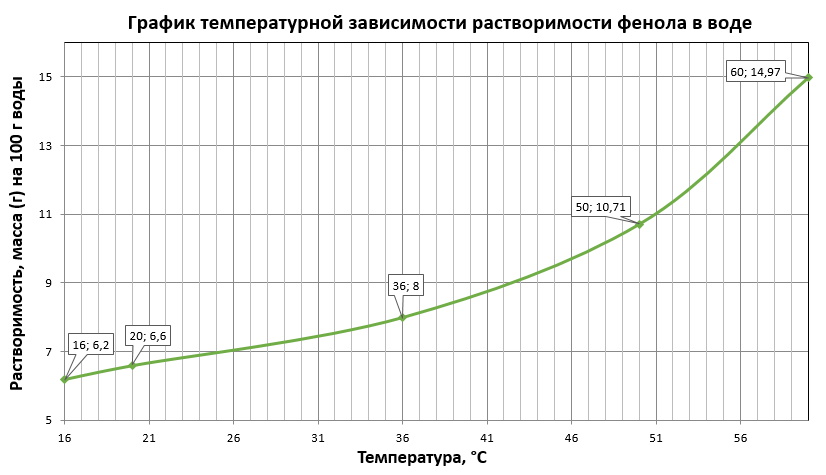
Найдите в Интернете данные о растворимости фенола в воде при различных температурах. Постройте график температурной зависимости растворимости фенола в воде.
В справочнике химика нашли, що 1 г кристаллического фенола растворяется в 15 г воды при 20 0 С, поэтому в 100 г воды при 20 0 С растворится 6,6 г фенола, следовательно первая координата (20;6,6). Остальные координаты берем из других справочников в интернете: (16;6,2); (36;8); (50;10,71); (60;14,97).
Построили график температурной зависимости растворимости фенола в воде:
Видео:Качественная реакция на углекислый газСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Реакции обмена в водных растворах электролитов. Ионные реакции и уравненияТак как молекулы электролитов в растворах распадаются на ионы, то и реакции в растворах электролитов происходят между ионами. Реакции, протекающие между ионами, называются ионными реакциями. С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции. Рассмотрим реакции ионного обмена, например взаимодействие между растворами двух солей: Это уравнение является молекулярным уравнением, так как формулы всех веществ записаны в виде молекул. Исходные вещества Na2SО4 и ВаCl2 являются сильными электролитами, т. е. в растворе находятся в виде ионов. Сульфат бария — нерастворимая соль, которая выпадает в осадок, следовательно, ионы Ва 2+ и SО4 2- уходят из раствора. Хлорид натрия NaCl — растворимая соль, сильный электролит, в растворе находится в виде ионов (Na + + Сl — ). Таким образом, с учетом диссоциации сильных электролитов уравнение реакции можно записать так: Такое уравнение называется полным ионным уравнением. Ионы Na + и Cl — имеются и в левой, и в правой частях уравнения, т. е. эти ионы в реакции участия не принимают, их можно исключить из уравнения: Полученное уравнение называется сокращенным ионным уравнением. Оно показывает, что в ходе данной реакции происходит связывание ионов SO4 2- , которые находились в растворе NaSО4, и ионов Ва 2+ , которые находились в растворе ВаCl2, и в результате образовалась нерастворимая соль BaSО4. Сокращенное ионное уравнение (3) выражает сущность не только реакции (1). Напишем уравнения нескольких реакций: Как видим, сущность реакций (4) и (5), как и реакции (1), заключается в связывании ионов SO4 2- и Ва 2+ с образованием нерастворимой соли BaSО4. В ионных уравнениях формулы веществ записывают в виде ионов или в виде молекул. В виде ионов записывают формулы: В виде молекул записывают формулы: — малорастворимых солей(↓) AgCl, BaSO4, СаСО3, FeS и др.; Большая часть молекул слабых электролитов в растворе не диссоциирует на ионы. В виде молекул также записывают: В уравнениях реакций ставят знак ↓, если среди продуктов реакции есть осадок — нерастворимые или малорастворимые вещества. Знак ↑ показывает газообразные и летучие соединения. Реакции обмена в водных растворах электролитов могут быть: 1) практически необратимыми, т. е. протекать до конца; 2) обратимыми, т. е. протекать одновременно в двух противоположных направлениях. 1) Реакции обмена между сильными электролитами в растворах протекают до конца, или практически необратимы, когда ионы соединяются друг с другом и образуют: а) малорастворимые вещества; б) малодиссоциирующие вещества — слабые электролиты; в) газообразные или летучие вещества. Рассмотрим эти случаи. а) Реакции с образованием малорастворимых веществ, выпадающих в осадок (↓). Составим молекулярное и ионное уравнения реакции между нитратом серебра (I) AgNO3 и хлоридом натрия NaCl: Эта реакция обмена необратима, потому что один из продуктов уходит из сферы реакции в виде нерастворимого вещества. б) Реакции, идущие с образованием малодиссоциирующих веществ (слабых электролитов). Составим молекулярное и ионное уравнения реакции нейтрализации между растворами гидроксида натрия NaOH и серной кислоты H2SO4: или, сокращая коэффициенты, получим: ОН — + Н + = Н2О. В результате реакции нейтрализации ионы водорода Н + и гидроксид-ионы ОН — образуют малодиссоциирующие молекулы воды. Процесс нейтрализации идет до конца, т. е. эта реакция необратима. в) Реакции, протекающие с образованием газообразных веществ. Составим молекулярное и ионное уравнения реакции между растворами гидроксида кальция и хлорида аммония NH4Cl: Эта реакция обмена необратима, потому что образуются газ аммиак NH3 и малодиссоциирующее вещество вода. 2) Если среди исходных веществ имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т. е. до конца не протекают. Например: Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают. При смешивании их растворов образуется смесь ионов, которые не соединяются друг с другом. Например: 📺 ВидеоХимия 8 класс: Реакции обмена в водных растворахСкачать  Как выглядит совместный гидролиз солей на ЕГЭ - химические опыты | Химия 10 класс УмскулСкачать  Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать  Реакции ионного обмена. 9 класс.Скачать  45. Реакция магния с углекислым газомСкачать  Химия 11 класс (Урок№7 - Гидролиз органических и неорганических соединений.)Скачать  Уравнивание реакций горения углеводородовСкачать  Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать  Химия | Тепловой эффект химической реакции (энтальпия)Скачать  пропускание углекислого газа через воду раствор гидроксида кальцияСкачать  Совместный гидролиз за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать  11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать  Щелочь + соль = ??? | Опыты для ЕГЭ и ОГЭ по химииСкачать  Совместный гидролиз в реакциях ионного обмена: за что?! | Химия ЕГЭ | УмскулСкачать  Галилео. Эксперимент. Опыт с углекислым газомСкачать  §34, 9 кл. Кислородные соединения углеродаСкачать  Получение углекислого газа и его свойстваСкачать  |


 Результат взаимодействия хлорида бария с сульфатом натрия
Результат взаимодействия хлорида бария с сульфатом натрия





