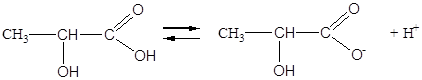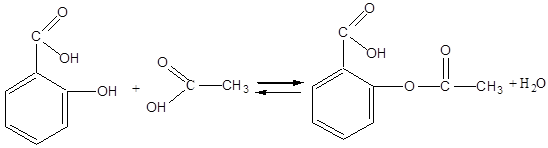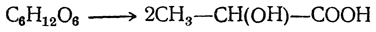Химические свойства гидроксикислот обусловлены наличием в их структуре спиртовых (-ОН) и кислотных (-СООН) групп. В реакциях эти функциональные группы могут реагировать независимо друг от друга, обуславливая спиртовые и кислотные свойства гидроксикислот соответственно. В некоторых реакциях эти группы взаимодействуют друг с другом, либо влияют друг на друга, что обуславливает их специфические свойства.
Кислотные свойства гидроксикислот
Диссоциация гидроксикислот.
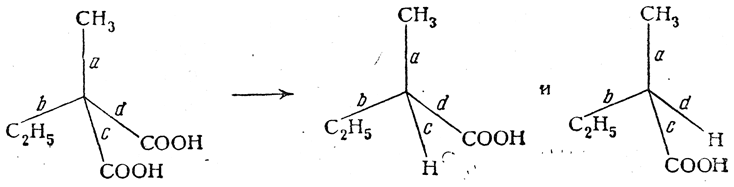
Все гидроксикислоты являются более сильными кислотами по сравнению с соответствующими карбоновыми кислотами, т.е. гидроксильная группа усиливает диссоциацию кислотной карбоксильной группы:
молочная кислота лактат-ион
Чем ближе спиртовый радикал находится к карбоксильной группе, тем сильнее данная кислота.
Образование солей.
молочная кислота Na-лактат
винная кислота К, Na-тартрат (К, Na-виннокислый, сегнетова соль)
Сегнетова соль используется в радиотехнике как диэлектрик, в приготовлении реактива Фелинга.
Осуществлению реакций по карбоксильной группе отчасти мешает присутствие гидроксильной группы, которая тоже может вступать в реакции. Поэтому ее обычно «защищают», превращая в простую или сложноэфирную группировку:
Получение функциональных производных по карбоксилу.
А) сложные эфиры
молочная кислота этанол этил-лактат
Салициловая кислота фенол фениловый эфир салициловой кислоты
В медицинской и ветеринарной практике салол используется как вяжущее и антисептическое средство при энтеритах, колитах и др. заболеваниях желудочно-кишечного тракта.
Б) амиды
молочная кислота амид молочной кислоты
В) галогенангидриды
γ-окси-масляная кислота хлорангидрид γ-хлор-масляной
Г) ангидриды
молочная кислота уксусная кислота ангидрид молочной и
Реакция декарбоксилирования.
Спиртовые свойства оксикислот
Получение сложных эфиров по гидроксилу.
яблочная кислота уксусная к-та ацетил-яблочная кислота
салициловая кислота ацетил-салициловая кислота (аспирин)
Аспирин широко используется как анальгезирующее, жаропонижающее и противовоспалительное средство.
Получение простых эфиров.
«Заблокировано» простой этиловый эфир
Реакции замещения водорода в гидроксиле на металл.
молочная кислота Na-алкоголят, Na-лактат
сегнетова соль медный гликолят-К,Na-тартрата
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Химические свойства КИСЛОТ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием кислотСкачать  Молочная кислотаМолочная кислота СН3—СН(ОН)—СООН (α-оксипропионовая, этилиденмолочная) содержит асимметрический атом углерода и поэтому может существовать, в оптически изомерных формах. Молочная кислота может быть получена различными синтетическими способами, но при всех этих синтезах кислота получается в виде оптически недеятельной, т. е. всегда получаются равные количества правого и левого изомеров. То же наблюдается и во всех других случаях, когда путем синтетических реакций получаются вещества, содержащие асимметрический атом углерода. Причина обязательного образования оптически недеятельных соединений при синтетических реакциях может быть показана на следующих примерах: Как видно из приведенной схемы, при действии цианистоводородной кислоты на уксусный альдегид анион CN – может атаковать π-связь карбонильной группы равновероятно как с одной, так и с другой стороны плоскости, в которой расположены σ-связи а, b и с молекулы кетона. В результате должны образоваться равные количества оптически изомерных молекул оксинитрилов. Точно так же в тех случаях, когда асимметрический атом углерода появляется в результате реакций замещения вероятности образования молекул оптических антиподов совершенно одинаковы, что и должно вести к образованию оптически недеятельных смесей или рацемических соединений. Значительные количества молочной кислоты образуются при действии щелочей на водные растворы простейших сахаристых веществ (моноз). Так, например, из смеси глюкозы и фруктозы («инвертный» сахар) можно получить до 60% молочной кислоты. И в этом случае образуется недеятельная молочная кислота. Наиболее важным источником получения молочной кислоты является процесс молочнокислого брожения, которому легко подвергаются растворы многих сахаристых веществ (молочного сахара, тростникового сахара, виноградного сахара и др.). Брожение является результатом жизнедеятельности бактерий молочнокислого брожения, зародыши которых всегда находятся в воздухе. Протеканием этого процесса и объясняется наличие молочной кислоты в кислом молоке, откуда она была впервые выделена Шееле (1780). Молочнокислое брожение сахарных растворов лучше всего протекает под действием чистых культур молочнокислых бактерий (Bacillus Delbrückii) при температуре 34—45° С, с добавкой необходимых для жизни бактерий минеральных веществ, а также мела или карбоната цинка. Последние добавки вводятся для нейтрализации свободной кислоты, так как при сколько-нибудь значительной концентрации кислоты бактерии погибают и брожение прекращается. Молочнокислое брожение является одним из процессов, протекающих при изготовлении масла (из скисшего молока), при созревании сыра, квашении капусты, при силосовании кормов и пр. Уравнение процесса молочнокислого брожения имеет вид: Для молочнокислого брожения, как и для спиртового, доказано существование особого энзима, зимазы молочнокислого брожения, могущего вызывать брожение и без живых бактерий (Бухнер и Мейзенгеймер). Обычно молочнокислое брожение приводит к образованию оптически недеятельной молочной кислоты, однако часто при этом получается кислота, обладающая слабым правым или левым вращением. Чистая левовращающая молочная (D-молочная) кислота может быть получена брожением сахаристых веществ при посредстве особого возбудителя брожения (Bacillus acidi laevolactici). Правовращающий изомер молочной кислоты (L-молочная) был открыт Либихом (1847) в мясном экстракте и получил названиемясомолочной кислоты. Правовращающая молочная кислота всегда содержится в мышцах животных. Обыкновенная (недеятельная) молочная кислота, часто называемая «молочной кислотой брожения», долгое время была известна лишь в виде густой жидкости. Осторожным выпариванием в высоком вакууме (0,1—0,5 мм рт. ст.) можно получить ее в безводном состоянии в виде кристаллической массы, плавящейся при 18° С. Из солей i-молочной кислоты характерной является хорошо кристаллизующаяся цинковая соль, содержащая три молекулы воды (С3Н5О3)2Zn ∙ 3Н2О. Различие свойств недеятельной молочной кислоты и оптически деятельных кислот и их солей показывает, что недеятельное вещество представляет собой не смесь, а рацемическое соединение обеих (D— и L-) кислот или их солей (лактатов). Правовращающая (L-молочная) и левовращающая (D-молочная) кислоты представляют собой расплывающиеся на воздухе призмы с т. пл. 25—26° С. Они обладают равным, но противоположным оптическим вращением (в 10%-ном растворе [α]D 15°C =±3,82° и в 2,5%-ном [α]D 15°C =±2,67°). При продолжительном нагревании до 130—150°С оптически деятельные изомеры рацемизуются и дают ангидриды недеятельной молочной кислоты. Цинковые соли оптически деятельных изомеров молочной кислоты кристаллизуются только с двумя молекулами воды (C3H5O3)2Zn ∙ 2H2O и обе обладают совершенно одинаковой растворимостью в воде (1 : 175 при 15° С), отличной от растворимости недеятельной соли (1 : 50 при 10° С). Оптически недеятельная молочная кислота может быть разделена на оптически деятельные изомеры с помощью плесневых грибков, а также кристаллизацией молочнокислых солей оптически деятельных алкалоидов: стрихнина, хинина или морфина. Особенно легко (даже при высушивании в вакууме) идет выделение воды с превращением в лактид, являющийся гомологом гликолида. Молочная кислота брожения находит значительное применение в технике, например в протравном крашении, в кожевенном производстве, в бродильных производствах (для предохранения от попадающих из воздуха посторонних бактерий), а также в медицине (80%-ный сироп; относительная плотность 1,21 — 1,22). 📸 ВидеоЗадача на разбавление уксусного ангидрида уксусной кислотой. Органика. Олимпиада.Скачать  Лабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать  Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать  ЛЕКЦИЯ 2. КИСЛОТЫСкачать  8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать  ЗАКИСЛЕНИЕ МЫШЦ. Как быстро вывести молочную кислоту?Скачать  КАК ВЫВЕСТИ МОЛОЧНУЮ КИСЛОТУ ИЗ МЫШЦСкачать  Практическая работа.Получение и свойства уксусной кислоты.Скачать  Реакция уксусной кислоты с карбонатом натрияСкачать  Взаимодействие уксусной кислоты с гидроксидом натрияСкачать  Взаимодействие уксусной кислоты с раствором щелочиСкачать  Реакция магния с уксусной кислотойСкачать  Взаимодействие уксусной кислоты с оксидом медиСкачать  Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать  Взаимодействие уксусной кислоты с металламиСкачать  Шноль С. Э. - Введение в биоорганическую химию - Роль молочной кислоты, ядовитые вещества, гликолизСкачать  Редкие реакции в органической химииСкачать 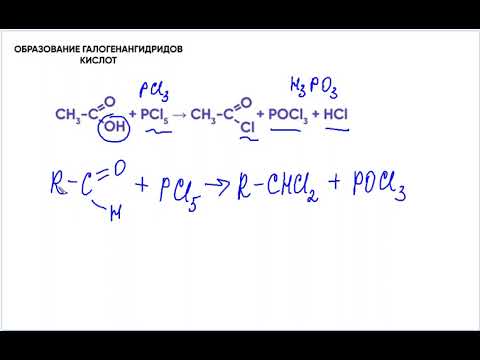 Реакции кислот-окислителей со сложными веществами: как понять? | Химия ЕГЭ 2022 | УмскулСкачать  |