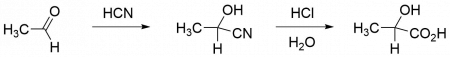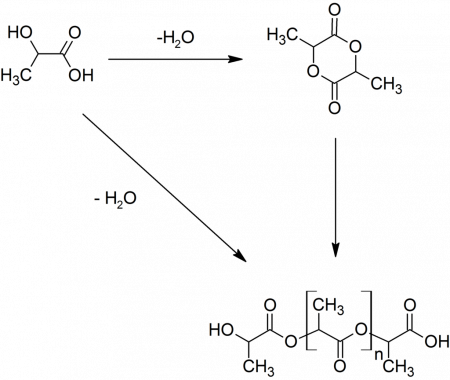Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание
Видео:7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать  Этанол: химические свойства и получениеЭтанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт . Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O. Видео:Органика. Механизм реакции этерификации (карбоновая кислота + спирт)Скачать  Строение этанолаВ молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода. Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о . Водородные связи и физические свойства спиртовСпирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов: Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С). Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
Этанол смешивается с водой в любых соотношениях. Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать  Изомерия спиртовВидео:Спирты: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать  Структурная изомерияДля этанола характерна структурная изомерия – межклассовая изомерия. Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
Видео:Несколько лайфхаков со спиртом. Химия – просто.Скачать  Химические свойства этанолаСпирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН. 1. Кислотные свойства
1.1. Взаимодействие с раствором щелочейПри взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой. Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей. 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Видео:Качественная реакция на этанолСкачать  2. Реакции замещения группы ОН2.1. Взаимодействие с галогеноводородамиПри взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
2.2. Взаимодействие с аммиакомГидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
2.3. Этерификация (образование сложных эфиров)Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
2.4. Взаимодействие с кислотами-гидроксидамиСпирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать  Видео:РЕАКЦИЯ ЭТЕРИФИКАЦИИСкачать  3. Реакции замещения группы ОНВ присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация. 3.1. Внутримолекулярная дегидратацияПри высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
Видео:25. Схема реакции и химическое уравнениеСкачать  В качестве катализатора этой реакции также используют оксид алюминия. 3.2. Межмолекулярная дегидратацияПри низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Видео:7.3. Спирты: Способы получения. ЕГЭ по химииСкачать  4. Окисление этанолаРеакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода). В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора. 4.1. Окисление оксидом меди (II)Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
4.2. Окисление кислородом в присутствии катализатораCпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). 4.3. Жесткое окислениеПри жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
4.4. Горение спиртовОбразуются углекислый газ и вода и выделяется большое количество теплоты.
Видео:Спирты. Ч.5-1. Химические свойства. Реакции по О-Н связи в предельных одноатомных спиртах.Скачать  5. Дегидрирование этанолаПри нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
Видео:Взаимодействие металлов с кислотами. 8 класс.Скачать  Получение этанолаВидео:ПОЛУЧЕНИЕ Галогенпроизводных. Получение хлорэтана. Реакция Этанола, Хлорида Натрия и Серной КислотыСкачать  1. Щелочной гидролиз галогеналкановПри взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
Видео:Химия. 11 класс. Качественное определение спиртов, альдегидов, карбоновых кислот /24.02.2021/Скачать  2. Гидратация алкеновГидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Видео:ЗАКИСЛЕНИЕ МЫШЦ. Как быстро вывести молочную кислоту?Скачать  3. Гидрирование карбонильных соединенийПрисоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
Видео:Шноль С. Э. - Введение в биоорганическую химию - Роль молочной кислоты, ядовитые вещества, гликолизСкачать  Видео:10 класс. Химия. Промышленное получение этилового спирта. 13.05.2020.Скачать  4. Получение этанола спиртовым брожением глюкозыДля глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение. Видео:🐳Дистилляция и ректификация. 10 класс. Химия. Промышленное получение этилового спирта.Скачать  Молочная кислота
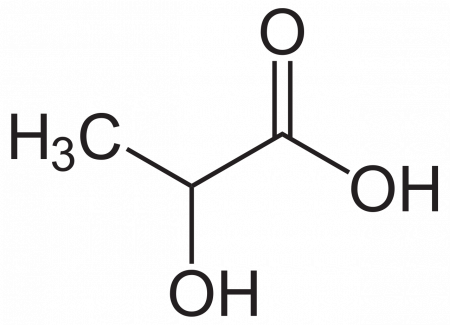
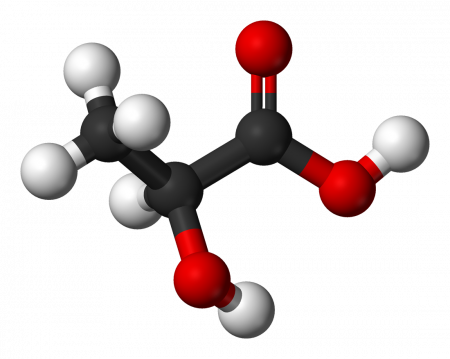
Молочная кислота (α-оксипропионовая, 2-гидроксипропановая кислота) CH3CH(OH)COOH — одноосновная карбоновая кислота с тремя атомами углерода, содержащая гидроксильную группу. Соли и эфиры молочной кислоты называются лактатами. Молочная кислота образуется при молочнокислом брожении сахаров и играет важную роль в метаболизме. Видео:Можно ли отличить опасный для здоровья метанол от этилового спиртаСкачать  Содержание
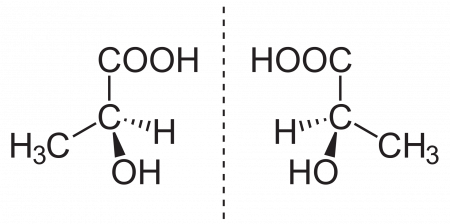
Видео:МОЛОЧНАЯ КИСЛОТА: КРИТИКА МОЛОЧНОКИСЛОГО АЦИДОЗАСкачать  ИсторияМолочную кислоту открыл шведский химик Карл Шееле. В 1780 году он выделил её из прокисшего молока в виде коричневого сиропа. Французский химик Анри Браконно обнаружил, что она образуется при молочнокислом брожении. В 1807 году Йенс Якоб Берцелиус выделил из мышц цинковую соль молочной кислоты. Физические свойстваМолочная кислота является простейшей хиральной карбоновой кислотой и может существовать в виде двух энантиомеров: L-(+)-молочной кислоты, D-(-)-молочной кислоты или их рацемической смеси — DL-молочной кислоты. Если в смеси энантиомеров один находится в избытке, его можно выделить дробными перекристаллизациями из смеси диэтилового эфира и диизопропилового эфира. Чистые энантиомеры имеют температуру плавления 52,7-52,8 °С. Молочная кислота очень гигроскопична и обычно существует в виде водного раствора с концентрацией до 90 мас. %. В связи с этим очень сложно установить её температуру плавления; литература приводит значения от 18 до 33 °С. Кроме того, в таких растворах присутствует значительное количество лактоилмолочной кислоты и других олигомеров молочной кислоты. Молочная кислота растворима в воде, этаноле, диэтиловом эфире и других органических растворителях, смешивающихся с водой. Она практически нерастворима в бензоле и хлороформе. Химические свойстваПри взаимодействии с окислителями молочная кислота разлагается. При окислении кислородом воздуха или азотной кислотой в присутствии железа или меди она превращается в муравьиную кислоту, уксусную кислоту, щавелевую кислоту, уксусный альдегид, углекислый газ и пировиноградную кислоту. Молочную кислоту можно восстановить до пропионовой кислоты действием иодоводорода Промышленный интерес представляет дегидратация молочной кислоты до акриловой кислоты и её восстановление до пропиленгликоля. Поскольку молочная кислота является одновременно карбоновой кислотой и спиртом, она вступает в межмолекулярную этерификацию, давая лактоилмолочную кислоту. При дальнейшей конденсации образуется лактид — циклический сложный эфир. Также при конденсации могут образовываться линейные полилактиды. Эти соединения являются примесями в молочной кислоте. Так, в 6,5%-й молочной кислоте содержится около 0,2 % лактоилмолочной кислоты, 88%-я молочная кислота содержит меньше 60 % свободной молочной кислоты, а 100%-я — только 32 %. ПолучениеФерментативное получениеВ промышленности молочную кислоту получают либо ферментативным способом, либо синтетическим. Первый из них имеет преимущество, поскольку приводит к молочной кислоте с более высокой стереохимической чистотой, поэтому новые производства, открывавшиеся с 1995 года, пользуются этим способом. Для ферментативного производства молочной кислоты необходимо иметь углеводное сырьё, питательные вещества и соответствующие микроорганизмы. В качестве сырья используют глюкозу, кукурузные сиропы, мелассу, сок сахарной свёклы, сыворотку и крахмал. Питательными веществами являются пептиды и аминокислоты, фосфаты, соли аммония и витамины. Здесь находят применение дрожжевой экстракт, кукурузный ликёр , кукурузная глютеновая мука , солодовые ростки, соевый или мясной пептон. Молочную кислоту из углеводов вырабатывают культуры Lactobacillus, Bacillus и Rhizopus. Последняя из них является грибной и не требует сложных источников азота, хотя и даёт более низкий выход, чем бактериальные культуры. Во время процесса вырабатывается кислота, поэтому необходимо поддерживать pH в области 5,0–6,5: для этого используют гидроксид кальция, карбонат кальция, аммиак и гидроксид натрия. Из-за этого в процессе ферментации образуются соответствующие соли молочной кислоты. Разработка новых подходов к ферментации связана с выведением бактерий, способных работать в области низких pH: это позволило бы получать саму молочную кислоту, а не её соли, снизило бы затраты на подщелачивающие реагенты и на серную кислоту, используемую для выделения молочной кислоты из солей. После ферментации молочную кислоту подвергают очистке. Микроорганизмы отделяют флокуляцией в щелочной среде либо ультрафильтрацией. Образовавшиеся соли молочной кислоты переводят в саму кислоту под действием серной кислоты. При этом образуется также малополезный сульфат кальция. Ведётся поиск других методов очистки, при которых образование это побочной соли не происходило бы. Для некоторых пищевых целей смесь пропускают через активированный уголь и ионообменную колонну. Для фармацевтической промышленности и получения полимеров необходима более глубокая очистка. Интерес представляет экстракция молочной кислоты в органическую фазу длинноцепными третичными аминами, а затем обратная экстракция в воду. Этот метод позволяет эффективно очистить продукт от остаточных углеводов и белков. Также возможна перегонка молочной кислоты, если предпринимаются меры против её олигомеризации. Выход молочной кислоты в процессе ферментации составляет 85–95 %. Побочными продуктами являются муравьиная и уксусная кислота. Синтетическое получениеС 1960-х гг. рацемическую молочную кислоту производят в промышленности также синтетически. Подход основан на реакции ацетальдегида с циановодородом и последующем гидролизе образовавшегося лактонитрила. Недостатком синтетического подхода является то, что получаемая молочная кислота является рацемической, а подходящий и дешёвый хиральный катализатор пока не найден. Последним крупным производителем синтетической молочной кислоты является фирма «Musashino». Экономические аспектыГодовая потребность в молочной кислоте составляет примерно 450 тыс. тонн. Крупнейшим производителем молочной кислоты является компания NatureWorks LLC: её завод, размещённый в штате Небраска (США), имеет приблизительную мощность 180 тыс. тонн в год. Это в 3-4 раза больше, чем у следующего завода по порядку. Рынок молочной кислоты очень чувствителен к потребности в полилактиде, поскольку его производство является либо вскоре станет крупнейшим направлением использования молочной кислоты. Молочная кислота в организме человека и животныхМолочная кислота формируется при распаде глюкозы. Иногда называемая «кровяным сахаром» глюкоза является главным источником углеводов в нашем организме. Это основной источник энергии для мозга и нервной системы, так же как и для мышц во время физической нагрузки. Когда расщепляется глюкоза, клетки производят АТФ (аденозинтрифосфат), который обеспечивает энергией большинство химических реакций в организме. Уровень АТФ определяет, как быстро и как долго мышцы смогут сокращаться при физической нагрузке. Производство молочной кислоты не требует присутствия кислорода, поэтому этот процесс её синтеза часто называют «анаэробным метаболизмом» (см. Анаэробная тренировка). Ранее считалось, что мышцы производят молочную кислоту при нехватке кислорода в крови. Другими словами, организм находится в анаэробном состоянии. Однако современные исследования показывают, что молочная кислота образуется и в мышцах, получающих достаточно кислорода. Увеличение количества молочной кислоты в кровотоке свидетельствует лишь о том, что уровень её поступления превышает уровень удаления. Резкое увеличение (в 2—3 раза) уровня лактата в сыворотке крови наблюдается при тяжёлых расстройствах кровообращения, таких как геморрагический шок, острая левожелудочковая недостаточность и др., когда одновременно страдает и поступление кислорода в ткани, и печёночный кровоток. Зависимое от лактата производство АТФ очень незначительно, но имеет большую скорость. Это обстоятельство делает идеальным его использование в качестве источника энергии, когда нагрузка превышает 50 % от максимальной. При отдыхе и умеренной нагрузке организм предпочитает расщеплять жиры для получения энергии. При нагрузках в 50 % от максимума (порог интенсивности для большинства тренировочных программ) организм перестраивается на преимущественное потребление углеводов. Чем больше углеводов человек использует в качестве топлива, тем больше производство молочной кислоты. Исследования показали, что у престарелых людей в головном мозге количество солей кислоты (лактатов) имеет повышенный уровень. Регулятор обменаЧтобы глюкоза могла проходить через клеточные мембраны, ей необходим инсулин. Молекула же молочной кислоты в два раза меньше молекулы глюкозы, и гормональная поддержка ей не нужна — она с лёгкостью сама проходит через клеточные мембраны. АнализКоличественный анализ молочной кислоты обычно проводят титрованием гидроксидом натрия в присутствии фенолфталеина. Этот способ не подходит для концентрированных растворов, потому что в них молочная кислота частично находится в виде лактоилмолочной кислоты. Если такой раствор нужно оттитровать, используют приём обратного титрования: молочную кислоту обрабатывают избытком щёлочи (лактоилмолочная кислота при этом гидролизуется), а затем остаток щёлочи оттитровывают соляной кислотой. В промышленности и исследовательских лабораториях молочную кислоту анализируют методом ВЭЖХ. Содержание энантиомерных форм в молочной кислоте можно определить ферментативным методом либо ВЭЖХ на хиральной колонке. Такие колонки, как и образцы высокочистых энантиомеров молочной кислоты коммерчески доступны. Молочную кислоту можно обнаружить по следующим качественным реакциям:
При осторожном нагревании молочной кислоты с концентрированной серной кислотой она вначале образует уксусный альдегид и муравьиную кислоту; последняя немедленно разлагается: В растворе серной кислоты медленно окисляется в фиолетовый продукт неизвестного состава. Поэтому, как и при обнаружении гликолевой кислоты с помощью 2,7-диоксинафталина, в данном случае происходит взаимодействие альдегида с фенолом, при котором концентрированная серная кислота действует как конденсирующий агент и окислитель. Такую же цветную реакцию дают α-оксимасляная и пировиноградная кислоты.
Выполнение реакции: В пробирку прилить 1 мл молочной кислоты, а затем немного подкисленного серной кислотой раствора перманганата калия. Нагревать в течение 2 минут на слабом огне. Ощущается запах уксусной кислоты. C3H6O3 + [O] = C3H4O3 + H2O↑ Продуктом данной реакции может быть пировиноградная кислота C3H4O3, которая тоже имеет запах уксусной кислоты. C 3H6O3 + [O] = C3H4O3 + H2O↑ Однако пировиноградная кислота при обычных условиях неустойчива и быстро окисляется до уксусной кислоты, поэтому реакция протекает согласно суммарному уравнению: C 3H6O3 + 2[O] = CH3COOH + CO2↑ + H2O
Описание реакции: Эта реакция называется реакцией Уффельмана и используется, например, в клинической медицине для определения присутствия молочной кислоты в желудочном соке, открыта Юлиусом Уффельманом в 1880-х гг. Для проведения реакции нужно растворить одну каплю хлорида железа и 0,4 грамма фенола в 50 см 3 воды. Затем добавить тестируемую жидкость, если в ней есть молочная кислота, то синий цвет раствора сменится жёлтым, поскольку образуется лактат железа. ПрименениеМолочная кислота используется преимущественно в трёх сферах: пищевой промышленности, производстве полимеров и других промышленных целях. В пищевой промышленности молочная кислота используется как консервант и подкислитель. Благодаря тому, что её соли хорошо растворимы в воде, их также можно использовать в тех продуктах, где важно значение pH. Молочная кислота и её соли используются в напитках, конфетах, мясных изделиях и соусах. Лактат кальция добавляется в продукты как источник кальция. В полимерной промышленности из молочной кислоты получают полилактид. Производится он из лактида полимеризацией с раскрытием цикла. Сам же лактид получают конденсацией молочной кислоты. Также молочная кислота используется в покрытии металлов, косметике, текстильной и кожевенной промышленности. Её эфиры находят применение в производстве красок и чернил, электроники и чистке металлов. БезопасностьМолочная кислота — это органическая карбоновая кислота, которая присутствует во многих организмах и является безопасной для окружающей среды. Увеличение производства молочной кислоты и, соответственно, полилактида оказывает положительное влияние тем, что вытесняет использование полимеров, производимых из нефти, снижает выбросы углекислого газа и предоставляет более широкие возможности по утилизации отходов. Молочная кислота также используется в пищевой промышленности и не является токсичной. Тем не менее при попадании в глаза или на повреждённую кожу она вызывает раздражение. Полулетальная доза для крыс при оральном приёме составляет 3,73 г/кг. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||