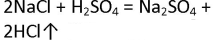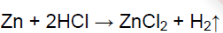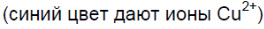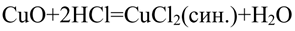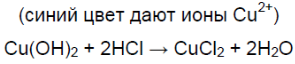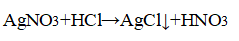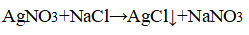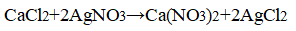Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
- § 16. Практическая работа №3.
- Получение соляной кислоты и изучение её свойств
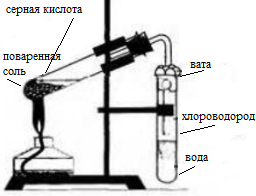
- 1. Получение соляной кислоты. Соберите прибор, как показано на рисунке 13 (см. с. 56). В пробирку насыпьте 2—3 г поваренной соли и прилейте концентрированную серную кислоту (2 : 1), чтобы она смочила всю соль. Закройте пробирку пробкой с газоотводной трубкой. Конец газоотводной трубки опустите в пробирку с водой так, чтобы он находился на расстоянии примерно 0,5—1,0 см от поверхности воды. Затем осторожно нагревайте смесь в первой пробирке в течение 5—6 мин. Следите, чтобы кислоту не перебросило в пробирку с водой! Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях (образуется гидрокарбонат натрия) и при сильном нагревании. Чем вызвано появление во второй пробирке тонких струек, опускающихся вниз? Почему конец газоотводной трубки должен находиться на расстоянии 0,5—1,0 см от поверхности воды?
- 2. Химические свойства соляной кислоты. Полученную при растворении хлороводорода в воде соляную кислоту разлейте поровну в шесть пробирок. В первую пробирку опустите лакмусовую бумагу, во вторую пробирку положите кусочек цинка или магниевые стружки, а в третью — кусочек меди. В четвертую пробирку поместите немного оксида меди (II) и нагрейте раствор. В пятую пробирку поместите немного свежеприготовленного гидроксида меди (II) в шестую — немного мела или другого карбоната. Со всеми ли металлами реагирует соляная кислота? Составьте уравнения реакций, протекающих между соляной кислотой и указанными металлами. Как объяснить образование в четвёртой и пятой пробирках растворов синего цвета, а в шестой — выделение газа? составьте уравнения соответствующих реакций.
- 3. Распознавание соляной кислоты и её солей. В одну пробирку налейте 1-2 мл разбавленной соляной кислоты, во вторую — столько же раствора хлорида натрия, а в третью — раствор хлорида кальция.во все пробирки добавьте по нескольку капель раствора нитрата серебра (I) или нитрата свинца (II) Pb(NO3)2. Проверьте, растворяется ли выпавший осадок в концентрированной азотной кислоте. Напишите уравнения соответствующих реакций и подумайте, как можно отличить: а) соляную кислоту от других кислот; б) хлориды от других солей; в) растворы хлоридов от соляной кислоты. Почему вместо раствора нитрата серебра (I) можно также использовать раствор нитрата свинца (II)? Напишите уравнения проведенных реакций и ответьте на вопрос, что является реактивом на соляную кислоту и её соли.
- webHimik
- Напишите уравнения реакций между α – аминомасляной кислотой и гидроксидом калия
- Уравнение реакции между калиевой солью пальмитиновой кислоты и соляной кислотой
- 🔍 Видео
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

§ 16. Практическая работа №3.
Получение соляной кислоты и изучение её свойств
1. Получение соляной кислоты. Соберите прибор, как показано на рисунке 13 (см. с. 56). В пробирку насыпьте 2—3 г поваренной соли и прилейте концентрированную серную кислоту (2 : 1), чтобы она смочила всю соль. Закройте пробирку пробкой с газоотводной трубкой. Конец газоотводной трубки опустите в пробирку с водой так, чтобы он находился на расстоянии примерно 0,5—1,0 см от поверхности воды. Затем осторожно нагревайте смесь в первой пробирке в течение 5—6 мин. Следите, чтобы кислоту не перебросило в пробирку с водой! Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях (образуется гидрокарбонат натрия) и при сильном нагревании. Чем вызвано появление во второй пробирке тонких струек, опускающихся вниз? Почему конец газоотводной трубки должен находиться на расстоянии 0,5—1,0 см от поверхности воды?
Получение соляной кислоты
Насыпали 2-3 г. поваренной соли и прилили концентрированную кислоту (2:1). Закрыли пробирку пробкой с газоотводной трубкой, конец трубки опустили в пробирку с водой, чтобы он находился над уровнем воды на 1 см. нагрели смесь с помощью спиртовки.
Появление в пробирке с водой тонких струек объясняются выделяющимся хлороводородом. Конец газоотводной трубки надо выставить на расстоянии 0,5 см, чтобы воду не засосало в пробирку с серной кислотой, иначе произойдёт взрыв и пробирка лопнет.
В лаборатории соляную кислоту можно получить с помощью растворения в воде хлороводорода, который получают воздействием концентрированной H2SO4 на хлорид.
2. Химические свойства соляной кислоты. Полученную при растворении хлороводорода в воде соляную кислоту разлейте поровну в шесть пробирок. В первую пробирку опустите лакмусовую бумагу, во вторую пробирку положите кусочек цинка или магниевые стружки, а в третью — кусочек меди. В четвертую пробирку поместите немного оксида меди (II) и нагрейте раствор. В пятую пробирку поместите немного свежеприготовленного гидроксида меди (II) в шестую — немного мела или другого карбоната. Со всеми ли металлами реагирует соляная кислота? Составьте уравнения реакций, протекающих между соляной кислотой и указанными металлами. Как объяснить образование в четвёртой и пятой пробирках растворов синего цвета, а в шестой — выделение газа? составьте уравнения соответствующих реакций.
Химические свойства соляной кислоты
Лакмусовая бумажка окрашивается в красный цвет.
Есть кислотные свойства.
Выделяется бесцветный газ
Zn или Mg стоят левее водорода в ряду напряжений, поэтому реагируют с соляной кислотой с выделением водорода.
Изменений не происходит
Медь стоит правее водорода в ряду напряжений, поэтому реакция не идёт.
Чёрный порошок растворяется, образуется раствор синего цвета.
Реагирует с основными оксидами.
Синий осадок растворяется, образуется раствор синего цвета.
Реагирует с нерастворимыми основаниями.
Выделяется бесцветный газ.
Реагирует с солями слабых кислот
3. Распознавание соляной кислоты и её солей. В одну пробирку налейте 1-2 мл разбавленной соляной кислоты, во вторую — столько же раствора хлорида натрия, а в третью — раствор хлорида кальция.во все пробирки добавьте по нескольку капель раствора нитрата серебра (I) или нитрата свинца (II) Pb(NO3)2. Проверьте, растворяется ли выпавший осадок в концентрированной азотной кислоте. Напишите уравнения соответствующих реакций и подумайте, как можно отличить: а) соляную кислоту от других кислот; б) хлориды от других солей; в) растворы хлоридов от соляной кислоты. Почему вместо раствора нитрата серебра (I) можно также использовать раствор нитрата свинца (II)? Напишите уравнения проведенных реакций и ответьте на вопрос, что является реактивом на соляную кислоту и её соли.
Распознавание соляной кислоты её солей
Прилили раствор нитрата серебра
Взаимодействие с нитратом серебра является качественной реакцией на хлорид-ионы.
Выпадение белого осадка, нерастворимого в азотной кислоте.
Выпадение белого осадка, нерастворимого в азотной кислоте.
Отличить а) и б) можно, применяя раствор нитрата серебра (I), потому что образовывается нерастворимый в концентрированной азотной кислоте белый осадок — хлорид серебра (I).
в) применить индикатор и щёлочь, при этом изменится цвет индикатора из кислотной среды в нейтральную в случае соляной кислоты.
Заменить раствор серебра (I) нитратом свинца можно, потому что идёт такая же качественная реакция с образованием белого осадка, но он растворяется в азотной кислоте.
Видео:Химия 9 класс (Урок№15 - Азотная кислота. Строение молекулы.Соли азотной кислоты.Азотные удобрения.)Скачать

webHimik
подробное решение задач по химии
Видео:11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать

Напишите уравнения реакций между α – аминомасляной кислотой и гидроксидом калия
Напишите уравнения реакций между: а) α – аминомасляной кислотой и гидроксидом калия; б) аминоуксусной и соляной кислотами; в) β – аминопропионовой кислотой и метанолом.
Решение:
а) Аминокислоты проявляют кислотные свойства при взаимодействии с основаниями. При этом образуется соли:
б) Основные свойства аминокислот проявляются в их реакциях с кислотами:
в) Взаимодействие аминокислот со спиртами идет по карбоксильной группе и приводит к образованию сложных эфиров:
Видео:Химия 8 класс Взаимодействие карбоната натрия и соляной кислотыСкачать

Уравнение реакции между калиевой солью пальмитиновой кислоты и соляной кислотой
I. Физические свойства
Cоляная кислота (также хлороводородная, хлористоводородная кислота, хлористый водород) — раствор хлороводорода в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящая» на воздухе (техническая соляная кислота желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около 0,5 % присутствует в желудке человека. Максимальная концентрация при 20 °C равна 38% по массе, плотность такого раствора 1,19 г/см³. Молярная масса 36,46 г/моль.
II. Получение соляной кислоты
III. Химические свойства
Раствор хлороводорода в воде — соляная кислота — сильная кислота:
3) Взаимодействие соляной кислоты с основаниями и аммиаком:
HCl + KOH → KCl + H2O
4) Взаимодействие соляной кислотыс солями:
Образование белого осадка хлорида серебра — AgCl, нерастворимого в минеральных кислотах используется в качестве качественной реакции для обнаружения анионов Cl — в растворе.
Хлориды металлов — соли соляной кислоты, их получают взаимодействием металлов с хлором или реакциями соляной кислоты с металлами, их оксидами и гидроксидами; путем обмена с некоторыми солями
Большинство хлоридов растворимы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути).
IV. Применение соляной кислоты и ее солей
1. Соляная кислота входит в состав желудочного сока и способствует перевариванию белковой пищи у человека и животных.
2. Хлороводород и соляная кислота используются для производства лекарств, красителей, растворителей, пластмасс.
3. Применение основных солей соляной кислоты:
KCl (Рис.1. Сильвинит) — удобрение, используется также в стекольной и химической промышленности.
HgCl2 (Рис.2. Сулема) — яд, используется для дезинфекции в медицине, для протравливания семян в сельском хозяйстве.
Hg2Cl2 (Рис.3. Каломель) – не ядовита, слабительное средство.
NaCl — поваренная соль — сырье для производства соляной кислоты, гидроксида натрия, водорода, хлора, хлорной извести, соды. Применяется в кожевенной и мыловаренной промышленности, в кулинарии и консервировании.
ZnCl2— для пропитки древесины против гниения, в медицине, при паянии.
AgCl — применяется в черно-белой фотографии, так как обладает светочувствительностью — разлагается на свету с образованием свободного серебра:
V. Задания для повторения и закрепления
Задание №1
Задание №2
Расставьте коэффициенты методом электронного баланса в следующей реакции
HCl + KClO3 -> KCl + H2O + Cl2
Укажите окислитель и восстановитель; процессы окисления и восстановления.
Задание №3
Задание №4
Решите задачу:
Какое количество алюминия прореагирует с избытком соляной кислоты для получения 5,6 л водорода (н.у.)?
🔍 Видео
Взаимодействие карбоната кальция с соляной кислотой I ЕГЭ по химииСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

ПОЛНЫЙ разбор ВАРИАНТА №4 из сборника Добротина! | Химия ЕГЭ УМСКУЛСкачать

Соляная кислота. Свойства и особенности. То чего вы не знали.Скачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Реакция цинка с соляной кислотой. Химический опытСкачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Zn + 2HCl → ZnCl2 + H2 | Реакция цинка и соляной кислотыСкачать

Взаимодействие соды с соляной кислотойСкачать

8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать

СОБИРАЮ ЭТУ ПЛЕСЕНЬ ЛОЖКАМИ И КЛАДУ В ЗЕМЛЮ. Как выращивать и использовать домашнюю БОВЕРИЮ.Скачать

СОЛЯНАЯ КИСЛОТА ИЗ ВОДЫ И СОЛИ! ПРОЩЕ НЕ ПРИДУМАТЬ...Скачать

Опыты по химии. Реакция нейтрализацииСкачать

Получение соляной кислотыСкачать

Химические свойства соляной кислотыСкачать