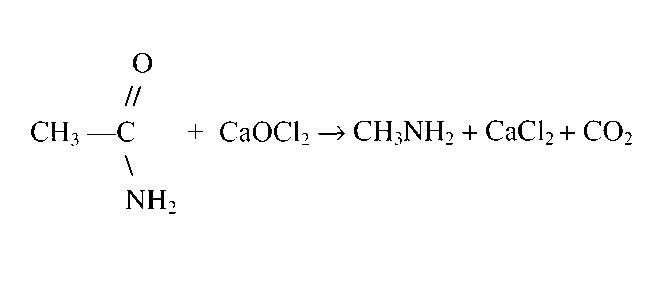Формула метиламина в химии считается почти примитивной. Однако для простых смертных одно название данного соединения является устрашающим, не говоря о том, что о структуре или формуле и вовсе ничего не известно. Многим неизвестно о специфичном запахе данного соединения или о его удивительно широких возможностях применения в различных производствах. Это вполне очевидно, ведь всего знать невозможно, и это факт. Но разве не интересно открывать для себя что-то ранее неизвестное?
Видео:Окисление этанола оксидом меди (II). Опыт 3Скачать

Что такое метиламин?
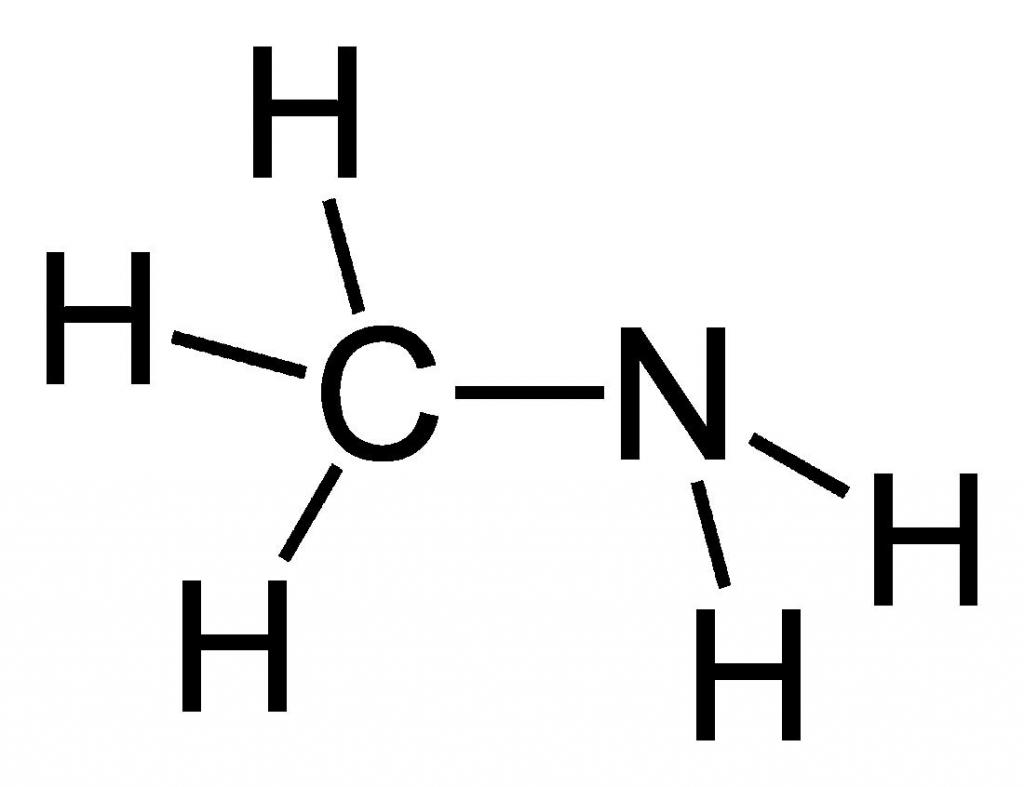
Метиламин — органическое соединение с формулой CH3NH2. Он является одним из производных аммиака, принадлежит к алифатическим органическим веществам. Его относят к крайне огнеопасным соединениям, так как этот газ легко смешивается с воздухом, образуя при этом взрывчатые смеси. Структура данного вещества представлена на рисунке ниже.
Из названия очевидно, что данное вещество относится к такому классу органических соединений, как амины (а именно — первичные амины), и оно является простейшим его представителем.
При нормальных условиях метиламин — это газ (как и упоминалось ранее), без цвета, но с ярко выраженным запахом аммиака.
Ингаляция данным веществом чревата сильным раздражением кожи, глаз, верхних дыхательных путей. Способен оказывать негативное влияние на почки и печень организма. А вдыхание его ведет к возбуждению и последующему угнетению центральной нервной системы. Возможно наступление смерти из-за остановки дыхания.
Видео:Качественная реакция на этанолСкачать

Способы синтеза метиламина
Один из промышленных способов получения метиламина опирается на реакцию метанола с аммиаком. Условиями проведения данного химического взаимодействия является высокая температура (370-430 °С), а также давление 20-30 бар.
Реакция осуществляется в газовой фазе, но на гетерогенном катализаторе, основанном на цеолите.
В смеси с метиламином образуются побочные вещества, такие как диметиламин и триметиламин. Поэтому данный способ получения нуждается в очистке метиламина (например, путем неоднократной перегонки).
Иной способ получения метиламина заключается в проведении реакции формалина с хлоридом аммония при нагревании. Но и это не последний возможный вариант синтеза данного амина!
Также известен способ получения метиламина посредством перегруппировки ацетамида по Гофману. На рисунке ниже представлено уравнение данной реакции.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химические свойства метиламина
Как правильно знакомиться с новым химическим соединением? Для начала нужно узнать, каково его название, особенности структуры. Затем важно понять, как его можно получить, поэтому сначала было рассказано о методах получения метиламина. А теперь нужно изучить его химические свойства.
Данному органическому соединению присущи все типичные свойства первичных аминов, так как оно является стандартным представителем данного класса.
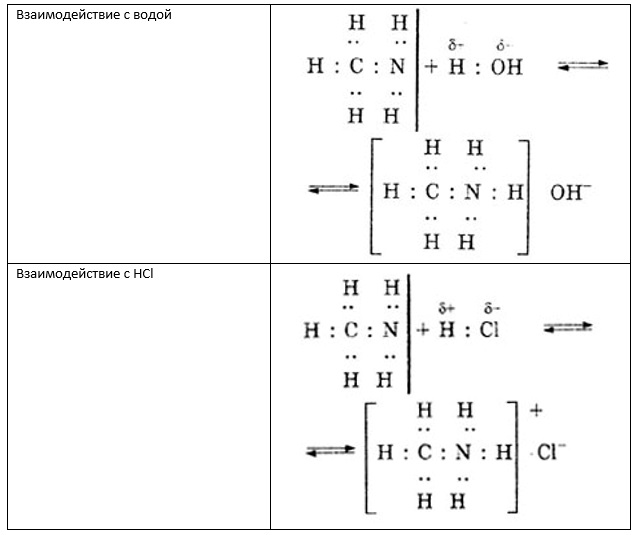
Если в качестве вещества, вступающего в реакцию с метиламином, выступает вода или минеральная кислота, то происходит образование, соответственно, гидроксида метиламмония или кристаллической соли.
Данные реакции представлены на рисунке ниже.
Если проводить сравнение метиламина с анилином или аммиаком, то можно прийти к выводу, что метиламин проявляет более сильные основные свойства. Это объясняется тем, что атом азота в составе молекул метиламина более электроотрицателен.
Если в качестве вещества, вступающего в реакцию с метиламином, выступает NaOCl, то происходит хлорирование — замещение атома водорода в аминогруппе на атом хлора. Так же как и другие первичные амины, метиламин образует спирт при взаимодействии с азотистой кислотой (HNO2).
Видео:Окисление этанола (тест на алкоголь)Скачать

Применение метиламина и условия хранения
CH3NH2 имеет очень широкую область применения. Он используется для синтеза красителей, фармацевтических препаратов (например, неофиллина, теофиллина, промедола), пестицидов, гербицидов, инсектицидов (севин, шрадан), фунгицидов, стерилизаторов земли в сельской промышленности, а также применяется в ветеринарной медицине.
Используется метиламин и при изготовлении сильных взрывоопасных веществ (таких как, например, тетрил), различных материалов для фото (метол), растворителей (например, ДМФА, диметилацетамид), ускорителей вулканизации, ингибиторов коррозии, дубильных веществ, ракетных топлив (N,N-диметилгидразин).
Также встречается метиламин в природе как второстепенный экскрет у костных рыб.
Чаще всего используют данное соединение в виде 40-процентного раствора в воде, метаноле, этаноле или тетрагидрофуране.
Чтобы применять метиламин в производстве или в процессе изготовления чего-либо, необходимо правильно его хранить.
Оптимальные условия хранения: в сжиженном виде в объеме 10-250 м 3 , в цилиндрических резервуарах, расположенных горизонтально, при комнатной температуре, но вдали от солнечных лучей, в местах, недоступных для детей и животных.
Разумеется, при работе с метиламином, как и с любым другим химическим веществом, необходимо использовать специальную одежду, перчатки и очки для индивидуальной защиты. Особое внимание нужно уделить защите слизистых оболочек и органов дыхания.
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Самые удивительные химические реакцииСкачать  АминыАмины — органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная группой аминов является аминогруппа — NH2. Классификация аминовПо числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные. Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций. Таким образом, у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены). Номенклатура и изомерия аминовНазвания аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин, пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке. Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации. Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы. Получение
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония. При такой реакции нитрогруппа превращается в аминогруппу, образуется вода. Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород. Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды. Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна — нейлон. В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу. В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов. Химические свойства аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет. В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием. Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония. Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют. При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C». Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода. При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ. © Беллевич Юрий Сергеевич 2018-2022 Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. 📸 ВидеоОкисление этанола оксидом меди(II). | Лабораторный опыт № 2.Скачать  Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать  7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать  12.2. Амины: Способы получения. ЕГЭ по химииСкачать  Самые красивые химические реакции. ТОП-3. Химия – ПростоСкачать  Обратимые и необратимые химические реакции. Самоподготовка к ЕГЭ и ЦТ по химииСкачать  Химическая реакция йода и алюминия.Скачать  Невероятные, крутые химические реакции взрывающие мозг!Скачать  Получение абсолютного этанолаСкачать  Лайфхак для реакций с аминами #химия #егэ2023 #соткаСкачать  25. Схема реакции и химическое уравнениеСкачать  Качественные реакции для обнаружения этанола, фенола и многоатомных спиртовСкачать  7 ПРОСТЫХ ХИМИЧЕСКИХ ОПЫТОВ ДЛЯ ДОМА!Скачать  Химические свойства аминов: понять, а не заучить | Химия ЕГЭ 2022 | УмскулСкачать  |