Проверим, будет ли взаимодействовать метан с окислителями, пермангонатом калия KMnO4 и бромом Br2.
При пропускании метана через раствор перманганата калия не наблюдается никаких изменений. Метан не взаимодействует с пермангонатом калия.
При пропускании метана через раствор бромной воды, бромная вода не изменяет своей окраски. Метан не реагирует с бромом.
В этих условиях метан не реагирует ни с бромом ни с пермангонатом калия.
Видео:Отношение метана к перманганату калия и бромной водеСкачать

Уравнение реакции метана к бромной воде и перманганату калия
CH3COONa + NaOH 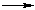
Пропустим метан через раствор перманганата калия. Никаких видимых изменений не наблюдаем. Бромная вода также не изменяет своей окраски. Метан стоек к окислителям и не вступает в реакцию с бромом при данных условиях.
Оборудование: пробирка, газоотводная трубка, промывалка, кристаллизатор, цилиндр, горелка, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами и нагревательными приборами.
Видео:Отношение метана к раствору перманганата калия и бромной водеСкачать

Опыты по химии. Предельные углеводороды
Постановка опытов и текст – к.п.н. Павел Беспалов.
Получение метана
Метан в лаборатории получают прокаливанием безводного ацетата натрия с натронной известью. Натронная известь представляет собой смесь гидроксида натрия с гидроксидом кальция. Тщательно перемешаем натронную известь с ацетатом натрия и поместим в пробирку. Закроем пробирку пробкой с газоотводной трубкой. Нагреем смесь. Через некоторое время начинает выделяться метан
CH3COONa + NaOH = CH4 + Na2CO3
Оборудование: пробирка, газоотводная трубка, промывалка, кристаллизатор, цилиндр, горелка, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами и нагревательными приборами. Не допускать попадания натронной извести на кожу.
Горение метана и изучение его физических свойств
Заполним метаном цилиндр. Метан представляет собой бесцветный газ, мало растворимый в воде. Он легче воздуха, поэтому легко улетучивается из открытого цилиндра. При поджигании метан загорается. При сгорании метана образуются углекислый газ и водяные пары.
CH4 + 2О2 = СО2 + 2 Н2О
Оборудование: пробирка, газоотводная трубка, промывалка, кристаллизатор, цилиндр, горелка, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами и нагревательными приборами. Не допускать попадания натронной извести на кожу.
Взрыв метана с кислородом
Для полного сгорания метана на один объем метана нужно взять два объема кислорода (см. уравнение реакции). Пластиковую бутылку, разделенную метками на три равные части, заполним способом вытеснения воды одной частью метана и двумя частями кислорода. При поджигании смеси происходит взрыв — полное сгорание метана в кислороде.
CH4 + 2О2 = СО2 + 2 Н2О
Оборудование: пробирка, газоотводная трубка, промывалка, кристаллизатор, цилиндр, горелка, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами и нагревательными приборами.
Отношение метана к раствору перманганата калия и бромной воде
Получаем метан прокаливанием безводного ацетата натрия с натронной известью. Пропустим метан через раствор перманганата калия. Никаких видимых изменений не наблюдаем. Бромная вода также не изменяет своей окраски. Метан стоек к окислителям и не вступает в реакцию с бромом при данных условиях.
Оборудование: пробирка, газоотводная трубка, промывалка, кристаллизатор, цилиндр, горелка, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами и нагревательными приборами.
Горение жидких углеводородов
Возьмем для опыта гексан и керосин.
Молекула гексана содержит шесть атомов углерода. Керосин – это смесь молекул алканов, в составе которых от двенадцати до восемнадцати атомов углерода. Подожжем небольшие количества гексана и керосина. Гексан загорается сразу: алканы с небольшой молекулярной массой загораются легко.
Поджечь керосин оказывается немного труднее, появляется коптящее пламя. В виде копоти выделяется несгоревший углерод. Большинство алканов горят коптящим пламенем из-за высокого содержания углерода. Мы убедились в том, что алканы с небольшой молекулярной массой загораются легче, чем алканы с большой молекулярной массой.
Оборудование: фарфоровые чашки, лучина, огнезащитная прокладка.
Техника безопасности. Соблюдать правила работы с горючими жидкостями. Работать с небольшими количествами жидких углеводородов (не более 2 мл).
Горение твердых углеводородов (на примере парафина)
Парафин – смесь твердых алканов, содержащих в своем составе от 16 до 40 атомов углерода. Твердый парафин на воздухе загорается с трудом. Кипящий парафин на воздухе самовозгорается. Нагреем парафин до кипения. Выливаем кипящий парафин из пробирки в кристаллизатор, наполненный водой. Кипящий парафин, смешиваясь с воздухом, загорается. При горении парафина образуются углекислый газ и водяные пары.
Оборудование: пробирка, зажим пробирочный, горелка, кристаллизатор.
Техника безопасности. Соблюдать правила работы с горючими веществами. Не наклоняться над кипящим парафином. Не допускать попадание парафина на одежду, кожу.
Установление качественного состава предельных углеводородов
Общим методом определения углерода и водорода в органических соединениях является окисление веществ оксидом двухвалентной меди. При этом углерод окисляется до углекислого газа, а водород до воды. Оксид меди (II) восстанавливается до меди или до оксида одновалентной меди, имеющих красный цвет
С18Н38 + СuО = 18СО2 + 19 Н2О + 55Сu
Углекислый газ обнаруживают при помощи известковой воды. Известковая вода мутнеет от углекислого газа.
Ca (OH)2 + CO2 = CaCO3 ↓ + H2O
Воду обнаруживают безводным сульфатом меди (II). Под действием воды белый сульфат меди (II) переходит в голубой кристаллогидрат — медный купорос
CuSO4 + 5H2O = CuSO4 * 5 H2O
Оборудование: пробирка с газоотводной трубкой, стакан, штатив, горелка.
Техника безопасности. Соблюдать правила работы с нагревательными приборами.
Определение содержания хлора в органических соединениях
Качественно определить содержание галогена в органическом соединении можно при помощи медной проволоки. При нагревании с оксидом меди (II) галогенсодержащие вещества сгорают с образованием летучих соединений, окрашивающих пламя в сине-зеленый цвет. Эта качественная реакция на галогены в органических соединениях называется пробой Бейльштейна. Для проведения пробы медную проволоку прокаливают в пламени горелки, опускают в жидкость или касаются твердого вещества и вновь вносят в пламя горелки. Появление сине-зеленого окрашивания, свидетельствует о наличии галогена в органическом соединении. Испытаем диметиламин хлорид и убедимся в том, что в его составе присутствует галоген — хлор.
Оборудование: горелка, медная спираль.
Техника безопасности. Соблюдать правила работы с нагревательными приборами.
Видео:Отношение метана к перманганата калия и бромной водеСкачать

Опыт №2 Отношение метана к бромной воде и перманганату калия
Лабораторная работа №1
Получение метана и изучение его свойств
Цель: отработать методику получения метана и изучить его свойства.
Реактивы и материалы: натриевая соль этановой кислоты обезвоженная (ацетат натрия) – CH3COONa; смесь гидроксидов натрия (NaOH) и кальция (Са(ОН)2) – натронная известь сухая; насыщенный раствор Вr2 (бромная вода); перманганат калия KMnO4, 1Н; жидкие алканы: гептан С7Н16 и гексан С6Н14; раствор брома (Вr2) в бензоле (С6Н6); гидроксид аммония (NH4OH), 25% раствор; лакмусовая синяя или универсальная индикаторная бумага; серная кислота H2SO4.
Оборудование: газоотводная трубка, штатив с пробирками, физический штатив, спиртовка, стеклянная палочка, вытяжной шкаф, держатели.
ТБ: опыты проводят в вытяжном шкафу!
Опыт №1 Получение метана и его горение
В сухую пробирку, снабжённую пробкой с газоотводной трубкой, помещают смесь из обезвоженной натриевой соли этановой кислоты и натронной извести (1:2, высота слоя 6-10 мм). Затем укрепляют пробирку горизонтально и нагревают смесь в пламени горелки.
Поджигают выделяющийся газообразный метан у конца газоотводной трубки. Метан горит голубоватым несветящимся пламенем.
При нагревании натриевой соли уксусной кислоты с натронной известью происходит расщепление соли с образованием метана.
Опыт №2 Отношение метана к бромной воде и перманганату калия
Во вторую пробирку помещают 5 капель раствора перманганата калия, а в третью пробирку 3-5 капель бромной воды. Не прекращая нагревания смеси в первой пробирке, вводят поочерёдно конец газоотводной трубки во вторую и третью пробирки. Обесцвечивания растворов перманганата калия и бромной воды не происходит. В обычных условиях алканы устойчивы к действию окислителей. Реакции замещения у них идут в довольно жёстких условиях, к реакциям присоединения не способны.
Не нашли, что искали? Воспользуйтесь поиском:
📽️ Видео
Реакция этилена с раствором перманганата калияСкачать

Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать

Взаимодействие этилена с бромной водойСкачать

Отношения бензола к бромной воде и раствору перманганата калияСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Реакция Дюма. Получение метанаСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Химические свойства алканов. 1 часть. 10 класс.Скачать

Отношение метана к раствору перманганата калия и бромной водеСкачать

Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Взаимодействие фенола с бромной водойСкачать

Получение и изучение свойств метана. Опыт 1Скачать

1.3. Алканы: Химические свойства. Подготовка к ЕГЭ по химииСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

ОВР с перманганатом калия.Скачать

8 метан с бромной водойСкачать

Взаимодействие ацетилена с бромной водойСкачать
