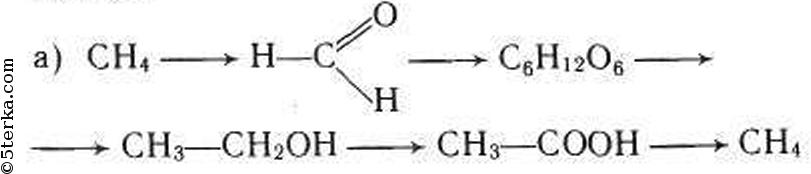
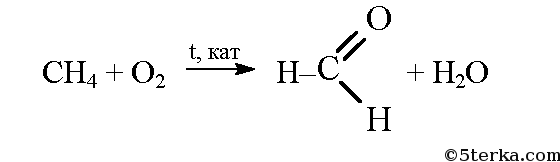
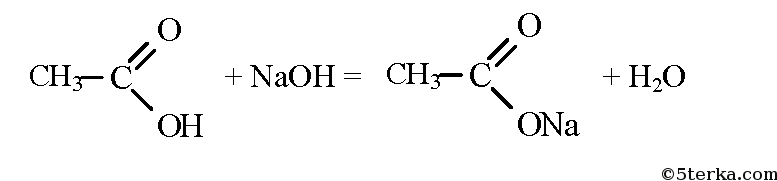а) При окислении метана в присутствии катализатора образуется мета-наль (формальдегид):
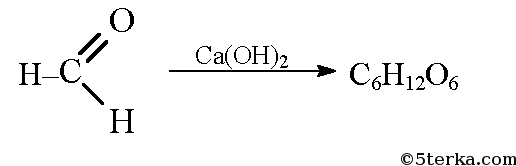
В присутствии гидроксида кальция из метаналя образуется смесь углеводов, в том числе глюкоза:
При спиртовом брожении глюкозы образуется этиловый спирт:
При окислении этилового спирта в присутствии катализатора образуется уксусная кислота:
Из уксусной кислоты в две стадии можно получить метан. При взаимодействии уксусной кислоты и гидроксида натрия образуется натриевая соль уксусной кислоты — ацетат натрия.
При сильном нагревании ацетата натрия с твердым гидроксидом натрия выделяется метан:
При гидролизе крахмала образуется глюкоза. Уравнение реакции:
При сжигании глюкозы образуется оксид углерода (IV):
Превращение оксида углерода в глюкозу осуществимо только в клетках растений, содержащих хлорофилл, в процессе фотосинтеза:

задача №8
к главе «Глава X. Углеводы §§1-4 (стр. 137) Вопросы».
- Как получить из глюкозы метан?
- Получить бутанон из метана?
- Как получить полиэтилен из метана?
- Помогите осуществить превращения) Из сахарозы получить глюкозу?
- 1)Глюкоза — — > ; метан ; 2)Целлюлоза — — > ; этиловый эфир молочной кислоты?
- Как получить из метана масляную кислоту?
- Осуществить превращение : метан → этин → хлорэтан → этанол → углекислый газ → глюкоза?
- Как из пропана получить метан?
- Как из глюкозы получить этиловый спирт?
- МЕТАН — > ; УГЛЕКИСЛЫЙ ГАЗ — > ; ГЛЮКОЗА — > ; ЭТАНОЛ — > ; ЭТИЛЕН ПОЖАЛУЙСТА?
- Как получить пентанол — 1 из метана?
- Метан: способы получения и свойства
- Гомологический ряд метана
- Строение метана
- Изомерия метана
- Химические свойства метана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование метана
- 2. Реакции разложения метана (д егидрирование, пиролиз)
- 3. Окисление метана
- 3.1. Полное окисление – горение
- 3.2. Каталитическое окисление
- Получение метана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Водный или кислотный гидролиз карбида алюминия
- 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 4. Синтез Фишера-Тропша
- 5. Получение метана в промышленности
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Как получить из глюкозы метан?
Химия | 10 — 11 классы
Как получить из глюкозы метан?
1) Спиртовое брожение глюкозы C6H12O6 — — — > ; 2C2H5OH + 2CO2.
2) Окисление спирта до уксусной(этановой кислоты) : С2H5OH + 2[O] — — > ; CH3 — COOH + H2O.
3)Получение ацетата натрия : СH3 — COOH + NaOH — — — > ; CH3COONa + H2O.
Соли с твердым NaOH : CH3COONa + NaOH — — — > ; CH4 + Na2CO3.
5) из спирта сначала можно получить уксусный альдегид или этаналь :
C2H5OH + CuO — — — > ; CH3 — CHO + Cu + H2O, а его окислением, — кислоту :
СH3 — CHO + Ag2O — — > ; CH3COOH + 2Ag.
Видео:Качественная реакция глюкозы с гидроксидом меди (II)Скачать

Получить бутанон из метана?
Получить бутанон из метана.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Как получить полиэтилен из метана?
Как получить полиэтилен из метана?
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Помогите осуществить превращения) Из сахарозы получить глюкозу?
Помогите осуществить превращения) Из сахарозы получить глюкозу.
Из глюкозы получить карбон(4) оксид.
Из глюкозы получить этанол.
Видео:Реакция глюкозы с гидроксидом меди (II)Скачать

1)Глюкоза — — > ; метан ; 2)Целлюлоза — — > ; этиловый эфир молочной кислоты?
1)Глюкоза — — > ; метан ; 2)Целлюлоза — — > ; этиловый эфир молочной кислоты.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Как получить из метана масляную кислоту?
Как получить из метана масляную кислоту.
Видео:Взаимодействие сахара с концентрированной серной кислотойСкачать

Осуществить превращение : метан → этин → хлорэтан → этанол → углекислый газ → глюкоза?
Осуществить превращение : метан → этин → хлорэтан → этанол → углекислый газ → глюкоза.
Видео:Проклятая химическая реакция 😜 #shortsСкачать

Как из пропана получить метан?
Как из пропана получить метан?
Видео:7.3. Спирты: Способы получения. ЕГЭ по химииСкачать

Как из глюкозы получить этиловый спирт?
Как из глюкозы получить этиловый спирт?
Видео:Реакция метана с хлором в разных соотношениях / Reaction of methane with chlorineСкачать

МЕТАН — > ; УГЛЕКИСЛЫЙ ГАЗ — > ; ГЛЮКОЗА — > ; ЭТАНОЛ — > ; ЭТИЛЕН ПОЖАЛУЙСТА?
МЕТАН — > ; УГЛЕКИСЛЫЙ ГАЗ — > ; ГЛЮКОЗА — > ; ЭТАНОЛ — > ; ЭТИЛЕН ПОЖАЛУЙСТА.
Видео:Опыты по химии. Обнаружение глюкозы в виноградном соке и медеСкачать

Как получить пентанол — 1 из метана?
Как получить пентанол — 1 из метана?
На странице вопроса Как получить из глюкозы метан? из категории Химия вы найдете ответ для уровня учащихся 10 — 11 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
Окуратно, а то «сожжет» все, в специальных перчатках.
Очень, очень, очень, очень, очень, очень, очень, аккуратно.
3 — H2, O2 , HBr точно не знаю.
Решение есть на фотографии.
Сера, озон, аммиак. Остальные смеси.
3 может быть . Ну аналогичное.
Дано : m(FeSO4) = 15. 2 r m(Fe(OH)2) — ? M(FeSO4) = 152 г / моль n(FeSO4) = 15, 2 г / 152 г / моль = 0, 1 моль M(Fe(OH)2) = 90 г / моль FeSO4 + 2NaOH = Na2SO4 + Fe(OH)2 Из УХР следует, что n(Fe(OH)2 = n(FeSO4) n(Fe(OH)2) = 0. 1 моль m(Fe(OH)2) = 0..
1. 4FeO + O2 = 2Fe2O3 (Соединения) 2. Построенная не верно. Mg + FeSO4 = MgSO4 + Fe3 (Замещение).
C3H8 + 5O2 = 3CO2 + 4H2O M(H2O) = 18г / моль V(C3H8) : V(O2) : V(CO2) = 1 : 5 : 3 V(O20 = 44, 8 * 5 = 224л V(CO2) = 44, 8 * 3 = 134, 4л n(C3H8) = 44, 8 / 22, 4 = 2моль nС3Н8 : nH2O = 1 : 4 n(H2O) = 2 * 4 = 8моль m(H2O) = 18 * 8 = 144г.
Видео:Моносахариды. Глюкоза. 11 класс.Скачать

Метан: способы получения и свойства
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Видео:Свойства глюкозы. 11 класс.Скачать
Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Видео:29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

Строение метана
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Видео:ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Видео:Реакция Дюма. Получение метанаСкачать

Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
| Например. При нитровании метана образуется преимущественно нитрометан: Видео:Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать  2. Реакции разложения метана (д егидрирование, пиролиз)При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. Видео:25. Схема реакции и химическое уравнениеСкачать  3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окисление
Продукт реакции – так называемый «синтез-газ». Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать  Получение метана1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя. 2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: 4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: 5. Получение метана в промышленностиВ промышленности метан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы. |