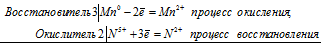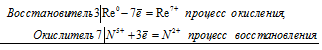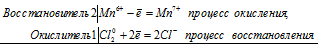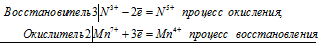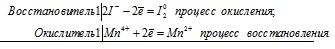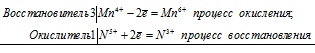Ма́рганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 25. Обозначается символом Mn (лат. Manganum , ма́нганум, в составе формул по-русски читается как марганец, например, KMnO4 — калий марганец о четыре). Простое вещество марганец — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой.
Минералы марганца
- пиролюзит MnO2·xH2O, самый распространённый минерал (содержит 63,2 % марганца);
- манганит (бурая марганцевая руда) MnO(OH) (62,5 % марганца);
- браунит 3Mn2O3·MnSiO3 (69,5 % марганца);
- гаусманит (Mn II Mn2 III )O4;
- родохрозит (марганцевый шпат, малиновый шпат) MnCO3 (47,8 % марганца);
- псиломелан mMnO • MnO2 • nH2O (45-60 % марганца);
- пурпурит Mn 3+ [PO4], (36,65 % марганца).
Химические свойства:
Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (степени окисления +1, +5 малохарактерны).
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
Марганец при нагревании разлагает воду, вытесняя водород:
При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
C соляной и серной кислотами реагирует по уравнению:
С концентрированной серной кислотой реакция идёт по уравнению:
С разбавленной азотной кислотой реакция идёт по уравнению:
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.
Mn2O7 в обычных условиях жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·MnO2, или соль Mn2MnO4).
При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:
Раствор окрашивается в малиновый цвет из-за появления аниона MnO4 − , и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия):
Под действием сильных окислителей ион Mn 2+ переходит в ион MnO4 − :
Эта реакция используется для качественного определения Mn 2+
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления.
Соли MnCl3, Mn2(SO4)3 неустойчивы. Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основный характер, MnO(OH)2 — амфотерный. Хлорид марганца (IV) MnCl4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора:
Видео:Реакции 16ти металлов с азотной кислотой разной концентрации Reactions of 16 metals with nitric acidСкачать

Химические свойства марганца
Задание 417
Марганец окисляется азотной кислотой до низшей степени окисления, а рений приобретает высшую степень окисления. Какие соединения при этом получаются? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Марганец взаимодействует с азотной кислотой с образованием нитрата марганца (II) оксида азота (II)
3Mn 0 + 2N 5+ = 3Mn 2+ + 2N 2+
б) Рений окисляется азотной кислотой до высшей степени окисления. При этом образуются рениевая кислота HReO4 и оксид азота (II) NO:
3Re 0 + 7N 5+ = 3Re 2+ + 7N 2+
Задание 418
Хлор окисляет манганат калия К2MnO4. Какое соединение при этом получается? Как меняется окраска раствора в результате этой реакции? Составьте электронные и молекулярное уравнения реакции.
Решение:
При окислении хлором манганата калия образуются перманганат калия и хлорид калия:
2Mn 6+ + Сl2 0 = 2Mn 7+ + 2Cl —
Манганат-ионы MnO4 2- окрашивают раствор в ярко-зелёный цвет, перманганат-ионы MnO4 — в красно-фиолетовый. Поэтому при окислении манганата калия хлором раствор изменяет окраску с ярко-зелёного на красно-фиолетовый цвет.
Задание 419
Как меняется степень окисления марганца при восстановлении КМпО4 в кислой, нейтральной и щелочной средах? Составьте электронные и молекулярное уравнения реакций между КМпО4 и KNO2 в нейтральной среде.
Решение:
Степень окисления марганца при восстановлении КМпО4 в кислой, нейтральной и щелочной средах меняется следующим образом: в кислой среде марганец уменьшает свою степень окисления от +7 до +2 (перманганат-ион MnO4 — превращается в ион Mn 2+ ); в нейтральной среде марганец уменьшает свою степень окисления от +7 до +4 (ион MnO4- восстанавливается до MnO2); в щелочной среде марганец уменьшает свою степень окисления от +7 до +6 (ион MnO4 — превращается в ион MnO4 2- ).
Электронные и молекулярное уравнения реакций между КМпО4 и KNO2 в нейтральной среде:
2Mn 7+ + 3N 3+ = 2Mn 4+ + 3N 5+
Задание 420
На основании электронных уравнений составьте уравнение реакции получения манганата калия K2MnO4 сплавлением оксида марганца (IV) с хлоратом калия КСlО3 в присутствии гидроксида калия. Окислитель восстанавливается максимально, приобретая низшую степень окисления.
Решение:
При сплавлении MnO2 со щёлочью ) с хлоратом калия КСlО3 в присутствии гидроксида калия образуются манганат калия, хлорид калия и вода:
3Mn 4+ + Сl 5+ = 3Mn 6+ + Cl —
Задание 421
Почему оксид марганца (IV) может проявлять и окислительные, и восстанвительные свойства? Исходя из электронных уравнений, составьте уравнения реакций:
а)МnО2 + КI + Н2SO4 = ; б)МnO2 + КNO3 + КОН = .
Решение:
Марганец в MnO2 находится в своей промежуточной степени окисления +4, поэтому в окислительно-восстановительных реакциях атом марганца в оксиде марганца (IV) может как увеличивать свою степень окисления, т.е. проявлять свойства восстановителя, так и уменьшать свою степень окисления – проявлять свойства окислителя.
а)МnО2 + КI + Н2SO4 =
Mn 4+ + 2I — = Mn 2+ + I2 0
б)МnO2 + КNO3 + КОН = .
Mn 4+ + N 5+ = Mn 6+ + N 3+
Задание 422
Для получения хлора в лаборатории смешивают оксид марганца (IV) с хлоридом натрия в присутствии концентрированной серной кислоты. Составьте электронные и молекулярное уравнения этой реакции.
Решение:
Уравнение реакции получения хлора в лаборатории
Видео:Азотная кислота на ОГЭ по химии | ОГЭ 2023 | УмскулСкачать

Марганец растворили в разбавленной азотной кислоте. Образовавшийся раствор выпарили, и полученное вещество прокалили — в газовой фазе было получено
Видео:Азотная кислота. Физические и химические свойства азотной кислоты. Подготовка к ЕГЭ по химии | ХимияСкачать

Ваш ответ
Видео:Химия 9 класс (Урок№15 - Азотная кислота. Строение молекулы.Соли азотной кислоты.Азотные удобрения.)Скачать

решение вопроса
Видео:Как правильно писать ОВР с азотной кислотой? В интернете кто-то неправСкачать

Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,256
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
💡 Видео
Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Химические св-ва соединений марганца Mn (+7) (KMnO4). Решаем окислительно-восстановительные р-ции.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Азотная кислота. Химические свойства. Реакции с НЕметаллами.Скачать

Азотная кислота и металлы за 13 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Азотная кислота. Химические свойства. Взаимодействие с металлами.Скачать

Химические свойства марганца. Часть 1.Скачать

Опыты по химии. Взаимодействие меди с разбавленной азотной кислотойСкачать

СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Реакция Между Перманганатом Калия, Сульфатом Марганца и Серной Кислотой. Сульфат Марганца(4).Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Реакции металлов с азотной кислотой. Химический опытСкачать

Все реакции по теме «Хром» для ЕГЭ по химии | Екатерина СтрогановаСкачать

На что способен ГЕПТАОКСИД МАРГАНЦА?Скачать

Получение оксида марганца VII. Химический опытСкачать