Коррозией металлов называют самопроизвольное разрушение металлов под действием различных окислителей из окружающей среды.
В реальных условиях коррозии обычно подвергаются технические металлы, содержащие примеси других металлов и неметаллических веществ.
Механизм электрохимической коррозии в таких металлах аналогичен механизму процессов, протекающих в короткозамкнутых гальванических элементах, в которых на участках с более отрицательным потенциалом идет процесс окисления (разрушение металлов), а на участках с более положительным потенциалом процесс восстановления окислителя (коррозионной среды).
Наиболее часто встречаются окислители (деполяризаторы):
· ионы водорода (коррозия с водородной деполяризацией)
2Н + + 2 ē = Н 2 (в кислой среде),
2Н2О + 2 ē = Н2 + 2ОН — (в нейтральной и щелочной средах);
O2 + 4 ē + 4Н + = 2Н2О (в кислой среде);
О2 +4 ē + 2Н2О = 4ОН — (в щелочной и нейтральной средах).
Методика рассмотрения работы гальванопары при электрохимической коррозии.
· Составляют схему гальванопары:
· Выписывают стандартные потенциалы металлов и окислителей коррозионной среды (табл.П.7), определяют восстановитель (меньший потенциал), окислитель (больший потенциал).
· Записывают уравнения процессов окисления и восстановления и суммарное уравнение окислительно-восстановительной реакции, протекающей при гальванокоррозии.
· Указывают направление движения электронов.
Пример 1.Гальванопара алюминий —железо в воде (среда нейтральная). В воде растворен кислород.
· Схема гальванопары Al / H2O, O2 / Fe
· Потенциалы 


Восстановитель – Al, окислитель — О2.


· Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:


Пример 2. Определить процессы, протекающие при коррозии луженого железа (среда – влажный воздух, содержащий кислород, пары воды и ионы Н + ), если нарушена сплошность покрытия.
· Потенциалы: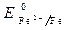


Восстановитель – железо, окислитель – кислород.


2Fe + О2 + 4Н + = 2Fe 2+ + 2Н2О
При нарушении целостности покрытия будет разрушаться Fe.
· Электроны движутся от участка с меньшим потенциалом к участку с большим потенциалом:


Пример 3. Рассмотреть коррозию детали из железа и алюминия в щелочной среде (КОН), если растворенный кислород отсутствует.
· Схема гальванопары: Al / КОН/ Fe
· Потенциалы: 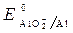


· 
Fe(+): 3 2 H2O + 2 ē = 2 OH — + H2 – процесс восстановления
2 Al + 2 OH — + 2H2O = 2 AlO2 — + 3 H2
· Направление перемещения электронов в системе:


Задание к подразделу 4.4
Рассмотрите коррозию гальванопары, используя потенциалы (табл. П.7), укажите анод и катод соответствующей гальванопары в различной коррозионной среде, рассчитайте ЭДС, напишите уравнения анодного и катодного процессов, молекулярное уравнение реакции коррозии, укажите направление перемещения электронов в системе.
| Номер задания | Коррозионная среда | ||
| а) H2O + O2 | б) NaOH + H2O | в) H2O + Н + | |
| 321. | Fe / Zn | Zn / Al | Pb / Zn |
| 322. | Fe / Ni | Fe / Zn | Al / Cu |
| 323. | Pb / Fe | Cd / Cr | Al / Ni |
| 324. | Cu / Zn | Al / Cu | Sn / Cu |
| 325. | Zn / Fe | Fe / Cr | Co / Al |
| 326. | Zn / Al | Pb / Zn | Cr / Ni |
| 327. | Cr / Cu | Pb / Cr | Bi / Ni |
| 328. | Cu / Al | Cr / Zn | Fe / Mg |
| 329. | Zn / Sn | Mg / Cd | Cr / Bi |
| 330. | Co / Mg | Zn / Fe | Pb / Al |
| 331. | Pb / Zn | Bi / Ni | Cd / Al |
| 332. | Bi / Ni | Cu / Zn | Fe / Ni |
| 333. | Fe / Mg | Fe / Cu | Co / Cd |
| 334. | Sn / Fe | Pb / Zn | Cr / Fe |
| 335. | Cr / Fe | Fe / Mg | Co / Cu |
| 336. | Fe / Cr | Cr / Cu | Cr / Cu |
| 337. | Fe / Cu | Cd/ Zn | Cd/ Zn |
| 338. | Zn / Cu | Cr / Ni | Cr / Cd |
| 339. | Mg / Cu | Cr / Cd | Zn / Al |
| 340. | Sn / Cu | Bi / Ni | Bi / Ni |
Электролиз растворов
Электролиз – это совокупность окислительно-восстановительных процессов, происходящих при прохождении электрического тока через электрохимическую систему, состоящую из двух электродов и электролита.
Электрод, на котором происходит восстановление, называется катодом, он заряжен отрицательно. Электрод, на котором происходит окисление, называется анодом, он заряжен положительно.
При электролизе водных растворов могут протекать процессы, связанные с электролизом воды, т.е. растворителя.
Катодные процессы
На катоде возможно восстановление:
· катионов металла Ме n+ + nē = Me;
· катиона водорода (свободного или в составе молекул воды):
2H + + 2ē = H 2 ( в кислой среде) ;
2H2O + 2 ē =H 2+ 2 OH — ( в нейтральной и щелочной средах).
Для выбора приоритетного процесса следует сравнить стандартные электродные потенциалы металла и водорода (табл. П.6, П.7). Потенциал восстановления катионов водорода необходимо использовать с учетом перенапряжения, 
1. Активные металлы (Li — Al) из-за низкой окислительной способности их ионов на катоде не осаждаются, вместо них идет восстановление ионов водорода.
2. Металлы средней активности (Mn, Zn, Fe, Sn) могут осаждаться на катоде с одновременным выделением водорода.
3. Малоактивные металлы (стоящие в ряду напряжений после водорода) из-за высокой окислительной способности их ионов осаждаются на катоде без выделения водорода.
Анодные процессы
На аноде возможны процессы окисления:
· материала анода Ме — nē = Me n +
Анионы кислородосодержащих кислот, имеющие в своем составе атом
элемента в высшей степени окисления (SO4 2 — , NO3 — и др.), при электролизе водных растворов на аноде не разряжаются.
С учетом перенапряжения величину потенциала выделения кислорода нужно считать равной 1,8 В.
Пример 1. Электролиз водного раствора сульфата калия с инертными электродами:


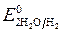
Так как


происходит восстановление воды: 2H2O — 4ē = O2 + 4 H +
среда щелочная среда кислая
Пример 2. Электролиз водного раствора хлорида олова с инертными электродами:
SnCl 2 = Sn 2+ + 2Cl —





Так как


ионов олова: Sn 2+ + 2 ē = S n 2Cl — — 2 ē = Cl 2
Пример 3. Электролиз сульфата меди с медным анодом:

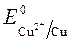



Так как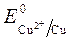

происходит восстановление Так как 
ионов меди:Cu 2+ +2ē = Cu анод растворяется: Cu — 2ē = Cu 2+
Количественные соотношения при электролизе определяют в соответствии с законами, открытыми М. Фарадеем (1834).
Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока:

где m — масса образовавшегося вещества , г;
М — молярная масса вещества, г/ моль;
n — количество электронов, участвующих в электродном процессе;
t — время электролиза, с;
F — константа Фарадея (96500 Кл/моль).
Для газообразных веществ, выделяющихся при электролизе, формулу использют в виде 
где V— объем газа, выделяющегося на электроде; V 0 — объем 1 моль газообразного вещества при нормальных условиях (22,4 л/моль).
Пример 4. Рассчитать массу олова и объем хлора при нормальных условиях, выделившихся при электролизе раствора хлорида олова с инертными электродами в течение 1 часа при силе тока 4А.
Решение.


Задание к подразделу 4.5
Рассмотрите катодные и анодные процессы при электролизе водных растворов веществ. Процессы на электродах обоснуйте значениями потенциалов (табл. П.6,7,8). Составьте схемы электролиза с инертными электродами водных растворов предложенных соединений (отдельно два раствора) с инертными электродами либо растворимым анодом. Рассчитайте массу или объем (при нормальных условиях для газов) продуктов, выделяющихся на электродах при пропускании через раствор в течение 1 часа тока силой 1 А.
- International Institute of Care to Buildings
- Языки
- Вход на сайт
- МИУЗ в соцсетях
- Клининговый поиск
- Сбор новостей
- Коррозия алюминия и его сплавов (док)
- Механизм коррозии алюминия
- Виды коррозии
- Электрохимическая коррозия
- Атмосферная коррозия
- Взаимодействие алюминия и его сплавов с другими металлами и сплавами
- Химическая коррозия
- Химическая стойкость сплавов алюминия
- Неорганические соединения
- Коррозия алюминия
- Коррозия алюминия на воздухе (атмосферная коррозия алюминия)
- Коррозия алюминия в воде
- Коррозия алюминия в кислотах
- Коррозия алюминия в серной кислоте
- Коррозия алюминия в соляной кислоте
- Коррозия алюминия в азотной кислоте
- Коррозия алюминия в уксусной кислоте
- Коррозия алюминия в щелочах
Видео:Электрохимическая коррозия (алюминий — медь)Скачать

International Institute of Care to Buildings
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Языки
Видео:Коррозия металла. Химия – ПростоСкачать

Вход на сайт
Видео:Химическая реакция йода и алюминия.Скачать

МИУЗ в соцсетях
Видео:Электрохимическая коррозияСкачать

Клининговый поиск
Видео:Электролиз. 10 класс.Скачать

Сбор новостей
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Коррозия алюминия и его сплавов (док)
Низкая плотность и механическая прочность в сочетании с удовлетворительной стойкостью к коррозии делают алюминий привлекательным конструкционным материалом, который широко используется в строительстве. Однако с химической точки зрения алюминий — один из наиболее реакционноспособных металлов, который активно взаимодействует не только с кислотами и щелочами, но и с водой! Кажущееся противоречие очень просто объясняется: под воздействием кислорода (или других окислителей) поверхность металлического алюминия покрывается прочной, химически устойчивой оксидной пленкой, предохраняющей металл от разрушения. Это явление называется пассивацией. Металл пассивен в том случае, когда при взаимодействии с потенциальным источником коррозии он не подвергается изменениям, и активен тогда, когда агрессивное вещество его разрушает.
Напомним, что коррозией называется процесс разрушения металлов и их сплавов в результате химического или электрохимического воздействия окружающей среды.
Металл, стойкий к коррозии в одних условиях, может разрушаться в других. Так, например, алюминий стоек к коррозии, вызываемой жидким топливом, и не стоек к действию натриевой щелочи (так называемое явление пассивности и активности).
Окись алюминия создает химически инертный защитный слой, толщина которого составляет 20—100Å. Алюминий, поверхность которого очищена от защитной пленки, может реагировать с водой, выделяя при этом водород. Под влиянием окислителей поверхность алюминия пассивируется, поэтому кислород, содержащийся в воздухе или растворенный в воде, повышает его коррозионную стойкость.
Коррозионная стойкость алюминия в значительной степени зависит от содержания примесей других металлов. Как известно, при контакте двух металлов, погруженных в среду электролита, образуется гальваническая пара, где более активный металл становится анодом, а менее активный — катодом. В результате электрохимической реакции анод разрушается. Большинство примесей (за исключением металлов, более активных, чем алюминий) играют роль катода по отношению к алюминию, т.е. способствуют его разрушению.
По этой причине алюминий высокой чистоты отличается более высокой коррозионной стойкостью, чем технический металл, который, в свою очередь, более устойчив к коррозии, чем сплавы алюминия. Кроме того, коррозионная стойкость алюминия зависит от характеристик окружающей среды и от реакций, вызываемых этой средой в алюминии.
Видео:Опыты по химии. Взаимодействие алюминия с кислотой и щелочьюСкачать

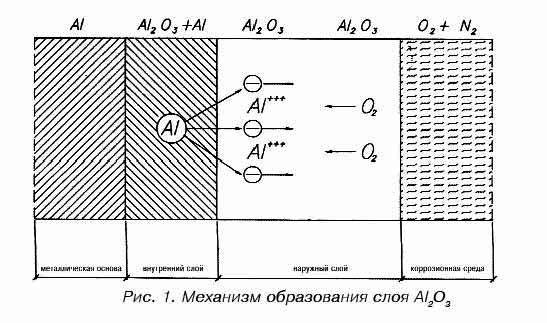
Механизм коррозии алюминия
В присутствии окислителей поверхность алюминия покрывается защитным слоем окиси алюминия.
Защитный слой, в свою очередь, состоит из двух слоев:
Видео:Реакции с алюминиемСкачать

Виды коррозии
Коррозию металлов можно разделить на химическую и электрохимическую.
Электрохимическая коррозия происходит при действии на металл растворов электролитов (т.е. растворов, содержащих носители электрического тока — ионы) и сопровождается возникновением электрического тока.
Химическая коррозия происходит при воздействии на металл сухих газов, пыли, жидких веществ (не электролитов) и не сопровождается возникновением электрического тока.
Разрушающее действие коррозии всегда начинается с поверхности металла. Затем коррозия распространяется в глубину со скоростью, зависящей от вида металла или сплава, его состава, структуры, характеристик, а также состава и характеристик окружающей среды. Этому процессу чаще всего сопутствуют изменения внешнего вида поверхности: она становится матовой, изменяет цвет, появляются точки, пятна, вздутия и т. д.
В результате взаимодействия алюминия с окружающей средой образуются вещества (продукты коррозии), свойства которых в значительной мере влияют на протекание коррозионных процессов. Рассмотрим возможные разновидности такого влияния:
В зависимости от свойств продуктов коррозии можно выделить следующие разновидности последней:
Видео:Взаимодействие алюминия со щёлочью и водойСкачать

Электрохимическая коррозия
В техническом алюминии (или в его сплавах) содержатся примеси металлов в виде отдельных вкраплений (магний, титан, железо, марганец и др.)
Благодаря наличию таких вкраплений сплав, погруженный в электролит, представляет собой совокупность большого количества микроскопических гальванических очагов. В результате электрохимической реакции, возникающей в этих очагах, металл, выступающий в роли анода (а в нашем случае это основной компонент сплава, алюминий), растворяется, в то время как на микрокатодах выделяется водород (рис. 2).
Такие микроисточники коррозии по своей природе являются обычными гальваническими элементами и отличаются:
Процесс электрохимической коррозии не всегда является результатом возникновения микроскопических гальванических элементов. В ряде случаев очаги коррозии имеют «видимые» (макроскопические) размеры.
Механизм электромеханического коррозионного разрушения для разной величины поверхности катода (сталь) и анода (алюминий) представлен на рис. 3.
Видео:Взаимодействие алюминия с кислотамиСкачать

Атмосферная коррозия
Атмосферной коррозией называют процесс разрушения металлов на воздухе в результате происходящих на их поверхности химических и электрохимических реакций. Это наиболее распространенный пример разрушения металлов.
Основной причиной атмосферной коррозии является тонкий слой влаги, который образуется на поверхности металла, если его температура находится ниже точки росы. С понижением температуры или при увеличении содержания водяного пара в воздухе излишек пара оседает в виде капель воды.
Если поверхность негладкая, покрыта пылью и слоями продуктов коррозии, то значительно раньше достижения точки росы во всех углублениях, порах и трещинах конденсируется пар и образуется слой воды.
Некоторые газообразные вещества, содержащиеся в атмосфере, такие как оксиды азота, серы, хлорид водорода и другие, растворяются в конденсированной влаге, образуя кислоты. Поскольку растворимость этих веществ в воде очень высока, они концентрируются в слое воды даже тогда, когда их содержание в воздухе сравнительно невелико.
Скорость коррозии зависит как от характеристик коррозионной среды (внешних факторов), так и от характера самого металла (внутренних факторов).
К внешним факторам относятся:
К внутренним факторам относятся:
Влияние атмосферы на процесс коррозии зависит от климатической зоны, уровня развития промышленности в регионе и загрязненности атмосферы. Наиболее существенными факторами, определяющими коррозионные свойства атмосферы, являются содержание пыли, газов, влажность и температура.
Влиянием этих факторов объясняется различная скорость процесса коррозии в различных точках земного шара. Например, чем ближе к морю, тем больше в воздухе морских солей, ускоряющих коррозию, особенно NaCl. В регионах, где много промышленных объектов, в воздухе много таких соединений, как SO2.
Отметим, что скорость коррозии на воздухе, как правило, значительно ниже, чем в пресной воде или почве. Атмосферную коррозию можно разделить на сухую, влажную и морскую.
Сухая (газовая) атмосферная коррозия проходит в условиях полного отсутствия влаги на поверхности металла. Этот вид коррозии протекает очень медленно. Если в атмосфере содержатся агрессивные газы, то скорость коррозии значительно ускоряется.
Влажная атмосферная коррозия протекает в слое электролита малой толщины. Скорость процесса зависит от влажности воздуха, атмосферных загрязнений и гигроскопичности продуктов коррозии: если эти вещества задерживают влагу на поверхности металла, скорость коррозии возрастает.
Морская атмосферная коррозия. В регионах с морским климатом в состав атмосферы входит большое количество солей, на поверхности металла собираются капли морской воды, соли и другие загрязнения, ускоряющие коррозию.
Видео:Гидролиз солей. 9 класс.Скачать

Взаимодействие алюминия и его сплавов с другими металлами и сплавами
В среде электролита два различных металла, соприкасающиеся между собой или соединенные проводником, образуют гальванический элемент, в котором генерируется электрический ток. Направление движения электронов в гальваническом элементе определяется величинами электродных потенциалов металлов, значения которых приведены в таблице 1. Электроны движутся от металла с более высоким потенциалом (анода) к металлу с низшим потенциалом (катоду). В такой ситуации металл с высоким потенциалом (и большей химической активностью) разрушается.
Таблица 1.
Реакция на
электродах
Стандартный
потенциал
окисления
В таблице 1 представлены значения стандартных электродных потенциалов (электрохимический ряд напряжений) для элементов, которые входят в состав алюминиевых сплавов или металлических соединений, использующихся в алюминиевых конструкциях.
Интенсивность коррозии, возникающей при соединении двух металлов, зависит от их расположения в ряду напряжений (разности потенциалов), от соотношения площади поверхности и уровня их поляризации.
Чем больше разность потенциалов в гальваническом элементе, тем выше напряжение и тем интенсивнее разрушается анод. Значения потенциалов, приведенные в электрохимическом ряде напряжений, определены для стандартных условий (температура 25°С и единичная активность ионов в растворе электролита). Нужно учитывать, что в зависимости от состава электролита эти значения могут меняться. Так, например, в щелочных растворах алюминий корродирует значительно сильнее, чем в кислых.
Цинк, потенциал которого близок к потенциалу алюминия, может использоваться для непосредственного контакта с алюминием. Если такой контакт происходит в нейтральных и кислых средах, цинк выполняет функцию анода и поэтому защищает катодный алюминий от коррозии. Однако в щелочных средах, наоборот, активность алюминия возрастает, поэтому цинк ускоряет коррозию алюминия.
При контакте стальных оцинкованных деталей (шурупов и т.д.) с алюминием слой цинка вначале обеспечивает защиту алюминия, но после стирания цинка стальная поверхность становится открытой, что может привести к коррозии алюминия. В контакте с алюминием рекомендуется применение стали, оцинкованной горячим методом, поскольку в этом случае толщина покрытия больше, чем при электролитической оцинковке.
Ни в коем случае алюминий не должен соединяться с медью и ее сплавами, поскольку это приводит к быстрой коррозии алюминия (так называемой «катастрофической коррозии»). В связи с этим в алюминиевых конструкциях недопустимы всякого рода элементы и дополнения из меди.
По этой же причине не следует допускать влияния на алюминий дождевой воды, которая стекает с медных крыш и труб непосредственно на алюминиевые конструкции, даже тогда, когда она содержит небольшие количества ионов меди.
Следует также избегать контакта с оловом и его соединениями, особенно в атмосфере, загрязненной промышленными отходами. Соли олова, образующиеся в кислой среде, сильно разрушают поверхность алюминия.
Свинцовый сурик, при наличии влаги, содержащей кислоту, проявляет сильную коррозионную активность. Поэтому при контакте с алюминием следует избегать стальных элементов, покрытых свинцовым суриком.
Ртуть и ее соли уже в присутствии следов влаги вызывают сильную коррозию алюминия. В этом случае процесс коррозии усиливается благодаря образованию амальгамы: амальгамированный алюминий интенсивно взаимодействует с водой в даже отсутствие кислот и щелочей! Поэтому при складировании алюминиевых профилей даже пары ртути (из разбитой лампочки) могут привести к мгновенной коррозии.
Соединение алюминия и стали допустимо в сельской местности, но на приморских и промышленных территориях сталь ускоряет коррозию алюминия. Поэтому при контакте стали и алюминия необходимо избегать их непосредственного контакта, например, путем оцинковки стали, покраски алюминия с одновременным использованием изолирующих прокладок из синтетических материалов.
При соединении железа, никеля и хрома с алюминием возникает значительная разность потенциалов, поэтому их не следует соединять непосредственно друг с другом. Кроме того, соли этих металлов (хлориды, сульфаты и т. д.), которые образуются в результате их коррозии, также способствуют разрушению алюминия.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химическая коррозия
Процесс химической коррозии протекает при воздействии сухих газов, жидких неэлектролитов и других материалов (в том числе и строительных) на алюминий.
В результате химической коррозии на поверхности алюминия образуется защитный слой, состоящий из продуктов коррозии и препятствующий взаимодействию агрессивных веществ с металлом. Скорость и вид химической коррозии определяет процесс диффузии агрессивного вещества через защитный слой.
Как мы упоминали ранее, слой окиси алюминия возникает на поверхности в результате окисления металла кислородом воздуха. На воздухе в отсутствие влаги толщина этого слоя в течение нескольких минут достигает 10 Å.
Видео:Электрохимическая коррозия в кислой средеСкачать

Химическая стойкость сплавов алюминия
В дистиллированной воде алюминий проявляет очень хорошие показатели стойкости к коррозии при любой температуре.
Дождевая вода может разрушать алюминий, если в атмосфере содержится значительное количество промышленных газов. Растворяясь в воде, это газы (SO2, NO2, хлороводород и т.д.) образуют кислоты, разрушающие алюминий. Поэтому во избежание коррозии алюминиевые конструкции следует проектировать так, чтобы свести до минимума скапливание дождевой воды на поверхности металла.
Водопроводная вода действует на алюминий по-разному, в зависимости от содержащихся в ней примесей. В кислых или щелочных водах алюминий может подвергаться коррозии. Процесс коррозии ускоряют ионы хлора или тяжелых металлов, содержащиеся в водопроводной воде.
Промышленные сточные воды вызывают очень сильную коррозию, которую ускоряют ионы тяжелых металлов.
Водород, азот и благородные газы (гелий, аргон, неон, криптон, ксенон) не действуют на алюминий даже при повышенных температурах.
Галогены (хлор, бром, йод, фтор) в отсутствие влаги не действуют на алюминий. При взаимодействии с водой они образуют кислоты, агрессивные по отношению к алюминию.
Сухие хлороводород, бромоводород, йодоводород, фтороводород не действуют на алюминий. Но водные растворы этих газов — кислоты, активно разрушающие алюминий.
Сероводород не разрушает алюминий при температуре до 500°С.
Двуокись серы в отсутствие водяного пара не разрушает алюминий (до 400°С), хотя при наличии влаги вызывает коррозию. Аналогично действует и триокись серы.
Аммиак в газообразном состоянии не действует на алюминий даже при высоких температурах.
Оксид углерода СО разрушает алюминий только при температуре свыше 550°С.
Углекислый газ ведет себя аналогично СО. В воде углекислый газ образует угольную кислоту, не вызывающую значительных коррозионных разрушений.
Видео:Грунтовки для защиты алюминия от коррозии. Коррозия алюминия. | Химтэк ЯрославльСкачать

Неорганические соединения
Алюминий не стоек к действию кислот. Исключение составляют концентрированные азотная и серная кислоты — их окислительные свойства настолько сильны, что при контакте с алюминием на его поверхности образуется прочный слой оксида алюминия, препятствующий дальнейшему разрушению металла (поэтому концентрированную азотную или серную кислоту перевозят в алюминиевых цистернах). Разбавленная азотная или серная кислота — более слабый окислитель — энергично реагирует с алюминием.
В кислотах алюминий растворяется тем хуже, чем меньше содержит дополнительных примесей. Следует помнить, что анодное окисление не защищает от воздействия кислот, поскольку они разрушают слой Al2O3. Химическая активность кислот увеличивается с ростом температуры. Например, с возрастанием температуры на 10°С скорость коррозии удваивается. Увеличение концентрации кислоты, как правило, увеличивает скорость коррозии (концентрированные серная и азотная кислоты — исключение).
Соляная кислота вызывает сильную коррозию. Действие этой кислоты нельзя ослабить добавлением ингибиторов.
Фтороводородная кислота оказывает самое сильное влияние на алюминий. Даже непродолжительное взаимодействие разбавленной кислоты ведет к полному растворению алюминия.
Кислородсодержащие кислоты хлора (HClO4, HClO3, HClO) вызывают сильную коррозию алюминия.
Серная кислота вызывает равномерную коррозию алюминия, интенсивность которой зависит от концентрации. Разбавленная кислота средней концентрации при комнатной температуре отличается умеренной агрессивностью. Наиболее агрессивна кислота концентрации 80%. Некоторые вещества, входящие в состав алюминиевых сплавов, а также ионы, содержащиеся в воде (особенно фториды и хлориды), усиливают действие серной кислоты.
Сернистая кислота вызывает локальную коррозию алюминия.
Сера и халькогены (селен и теллур) на алюминий не действуют.
Фосфорная кислота разрушает алюминий умеренно или сильно (в зависимости от концентрации).
Мышьяк при комнатной температуре не действует на алюминий.
Мышьяковая кислота (H3AsO4) и окись мышьяка сильно разрушают алюминий, а мышьяковистая кислота (H3AsO3) без нагревания на него не влияет.
Азотистая кислота (HNO2) при комнатной температуре не действует на алюминий.
Азотная кислота (HNO3) воздействует на алюминий по-разному, в зависимости от концентрации. Разбавленные растворы интенсивно разрушают алюминий. В концентрированных растворах вследствие окислительных процессов поверхность алюминия пассивируется и коррозия замедляется. Наиболее сильную коррозию вызывает кислота концентрацией 10-60%. Действие азотной кислоты приводит к равномерной коррозии. С увеличением чистоты алюминия возрастает его стойкость к коррозии. Наличие в составе слава примесей меди, кремния, магния усиливает воздействие азотной кислоты.
Видео:Химия 9 класс (Урок№23 - Щелочные металлы. Физические и химические свойства. Оксиды и гидроксиды.)Скачать

Коррозия алюминия
Коррозия алюминия – разрушение металла под влиянием окружающей среды.
Для реакции Al 3+ +3e → Al стандартный электродный потенциал алюминия составляет -1,66 В.
Температура плавления алюминия — 660 °C.
Плотность алюминия — 2,6989 г/см 3 (при нормальных условиях).
Алюминий, хоть и является активным металлом, отличается достаточно хорошими коррозионными свойствами. Это можно объяснить способностью пассивироваться во многих агрессивных средах.
Коррозионная стойкость алюминия зависит от многих факторов: чистоты металла, коррозионной среды, концентрации агрессивных примесей в среде, температуры и т.д. Сильное влияние оказывает рН растворов. Оксид алюминия на поверхности металла образуется только в интервале рН от 3 до 9!
Очень сильно влияет на коррозионную стойкость Al его чистота. Для изготовления химических агрегатов, оборудования используют только металл высокой чистоты (без примесей), например алюминий марки АВ1 и АВ2.
Коррозия алюминия не наблюдается только в тех средах, где на поверхности металла образуется защитная оксидная пленка.
При нагревании алюминий может реагировать с некоторыми неметаллами:
2Al + N2 → 2AlN – взаимодействие алюминия и азота с образованием нитрида алюминия;
4Al + 3С → Al4С3 – реакция взаимодействия алюминия с углеродом с образованием карбида алюминия;
2Al + 3S → Al2S3 – взаимодействие алюминия и серы с образованием сульфида алюминия.
Видео:Галилео. Эксперимент. Растворяем алюминийСкачать

Коррозия алюминия на воздухе (атмосферная коррозия алюминия)
Алюминий при взаимодействии с воздухом переходит в пассивное состояние. При соприкосновении чистого металла с воздухом на поверхности алюминия мгновенно появляется тонкая защитная пленка оксида алюминия. Далее рост пленки замедляется. Формула оксида алюминия – Al2O3 либо Al2O3•H2O.
Реакция взаимодействия алюминия с кислородом:
Толщина этой оксидной пленки составляет от 5 до 100 нм (в зависимости от условий эксплуатации). Оксид алюминия обладает хорошим сцеплением с поверхностью, удовлетворяет условию сплошности оксидных пленок. При хранении на складе, толщина оксида алюминия на поверхности металла составляет около 0,01 – 0,02 мкм. При взаимодействии с сухим кислородом – 0,02 – 0,04 мкм. При термической обработке алюминия толщина оксидной пленки может достигать 0,1 мкм.
Алюминий достаточно стоек как на чистом сельском воздухе, так и находясь в промышленной атмосфере (содержащей пары серы, сероводород, газообразный аммиак, сухой хлороводород и т.п.). Т.к. на коррозию алюминия в газовых средах не оказывают никакого влияния сернистые соединения – его применяют для изготовления установок переработки сернистой нефти, аппаратов вулканизации каучука.
Видео:Защитная оксидная плёнка на алюминии 🧪 Опыты по химии ⚗️Скачать

Коррозия алюминия в воде
Коррозия алюминия почти не наблюдается при взаимодействии с чистой пресной, дистиллированной водой. Повышение температуры до 180 °С особого воздействия не оказывает. Горячий водяной пар на коррозию алюминия влияния также не оказывает. Если в воду, даже при комнатной температуре, добавить немного щелочи – скорость коррозии алюминия в такой среде немного увеличится.
Взаимодействие чистого алюминия (не покрытого оксидной пленкой) с водой можно описать при помощи уравнения реакции:
При взаимодействии с морской водой чистый алюминий начинает корродировать, т.к. чувствителен к растворенным солям. Для эксплуатации алюминия в морской воде в его состав вводят небольшое количество магния и кремния. Коррозионная стойкость алюминия и его сплавов, при воздействии морской воды, значительно снижается, если в состав метала будет входить медь.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Коррозия алюминия в кислотах
С повышением чистоты алюминия его стойкость в кислотах увеличивается.
Коррозия алюминия в серной кислоте
Для алюминия и его сплавов очень опасна серная кислота (обладает окислительными свойствами) средних концентраций. Реакция с разбавленной серной кислотой описывается уравнением:
Концентрированная холодная серная кислота не оказывает никакого влияния. А при нагревании алюминий корродирует:
При этом образуется растворимая соль – сульфат алюминия.
Al стоек в олеуме (дымящая серная кислота) при температурах до 200 °С. Благодаря этому его используют для производства хлорсульфоновой кислоты (HSO3Cl) и олеума.
Коррозия алюминия в соляной кислоте
В соляной кислоте алюминий или его сплавы быстро растворяются (особенно при повышении температуры). Уравнение коррозии:
Аналогично действуют растворы бромистоводородной (HBr), плавиковой (HF) кислот.
Коррозия алюминия в азотной кислоте
Концентрированный раствор азотной кислоты отличается высокими окислительными свойствами. Алюминий в азотной кислоте при нормальной температуре исключительно стоек (стойкость выше, чем у нержавеющей стали 12Х18Н9). Его даже используют для производства концентрированной азотной кислоты методом прямого синтеза
При нагревании коррозия алюминия в азотной кислоте проходит по реакции:
Коррозия алюминия в уксусной кислоте
Алюминий обладает достаточно высокой стойкостью к воздействию уксусной кислоты любых концентраций, но только если температура не превышает 65 °С. Его используют для производства формальдегида и уксусной к-ты. При более высоких температурах алюминий растворяется (исключение составляют концентрации кислоты 98 – 99,8%).
В бромовой, слабых растворах хромовой (до10%), фосфорной (до 1%) кислотах при комнатной температуре алюминий устойчив.
Слабое влияние на алюминий и его сплавы оказывают лимонная, масляная, яблочная, винная, пропионовая кислоты, вино, фруктовые соки.
Щавелевая, муравьиная, хлорорганические кислоты разрушают металл.
На коррозионную стойкость алюминия очень сильно влияет парообразная и капельножидкая ртуть. После недолгого контакта металл и его сплавы интенсивно корродируют, образуя амальгамы.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Коррозия алюминия в щелочах
Щелочи легко растворяют защитную оксидную пленку на поверхности алюминия, он начинает реагировать с водой, в результате чего металл растворяется с выделением водорода (коррозия алюминия с водородной деполяризацией).
Также оксидную пленку разрушают соли ртути, меди и ионы хлора.