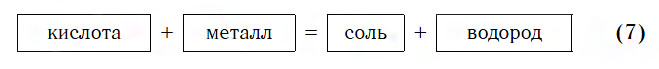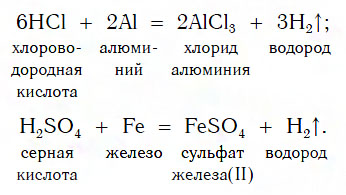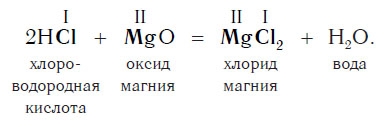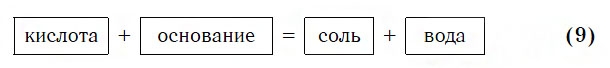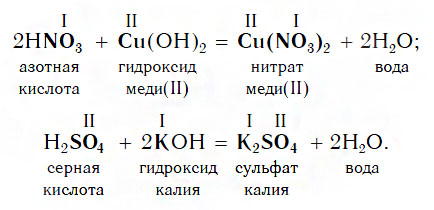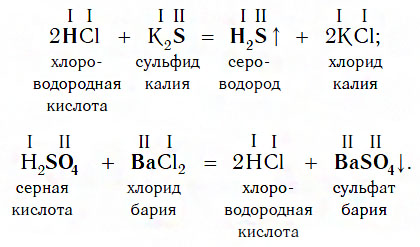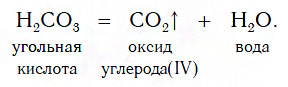Для определения реакции среды используют индикаторы лакмус, метилоранж, фенолфталеин. Как индикаторы реагируют на кислую среду? Приготовим пробирки с раствором соляной кислоты. Лакмус и метилоранж в кислой среде изменяют цвет – растворы становятся соответственно красным и розовым. Фенолфталеин в кислой среде остается бесцветным .
НС I 
Оборудование: пробирки, держатель для пробирок.
Следует соблюдать правила работы с кислотами.
Постановка опыта – Елена Махиненко , текст – Павел Беспалов.
- Cреда водных растворов веществ. Индикаторы
- Среда водных растворов
- Индикаторы
- Растворы кислот и оснований
- Растворы солей
- Добавить комментарий
- Урок 35. Химические свойства кислот
- Изменение окраски индикаторов
- Взаимодействие с металлами
- Реакции с основными оксидами
- Взаимодействие с основаниями
- Взаимодействие с солями
- Разложение кислот на кислотные оксиды и воду
- 💡 Видео
Видео:Действие кислот на индикаторыСкачать

Cреда водных растворов веществ. Индикаторы
Материалы портала onx.distant.ru
Определение характера среды водных растворов веществ. Индикаторы.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Среда водных растворов
Вода и водные растворы окружают нас повсюду. В воде и в водных растворах присутствуют ионы Н + и ОН — . Избыток или недостаток этих ионов определяет среду раствора.
В нейтральном растворе количество ионов водорода Н + равно количеству гидроксид-ионов ОН – .
[ Н + ] = [ ОН – ]
Если количество ионов водорода Н + больше количества гидроксид-ионов ОН – , то среда раствора кислая:
[ Н + ] > [ ОН – ]
Если количество ионов водорода Н + меньше количества гидроксид-ионов ОН – , то среда раствора щелочная:
[ Н + ] ОН – ]
Для характеристики кислотности среды используют водородный показатель рН. Он определяется, как отрицательный десятичный логарифм концентрации ионов водорода. В нейтральной среде рН равен 7, в кислой — меньше 7, в щелочной — больше 7.
| Кислая среда | Нейтральная среда | Щелочная среда |
| [Н + ] > [ОН – ] | [Н + ] = [ОН – ] | [Н + ] – ] |
| pH | pH = 7 | pH > 7 |
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Индикаторы
Для определения среды раствора используют специальные вещества, которые изменяют цвет в зависимости от среды раствора: индикаторы. В зависимости от среды эти вещества могут переходить в разные формы с различной окраской.
Чаще всего используют следующие индикаторы: лакмус, метилоранж, фенолфталеин.
Окраска индикаторов в различных средах:
| Индикатор/среда | Кислая | Нейтральная | Щелочная |
| Лакмус | Красный | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Видео:8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать

Растворы кислот и оснований
Характер среды определяется процессами, которые происходят с веществами в растворе. Кислот, основания и соли в воде диссоциируют на ионы. Кислоты диссоциируют на катионы водорода H + и анионы кислотных остатков:
HA = H + + A –
При этом в растворе возникает избыток катионов водорода Н + , поэтому среда водных растворов кислот — кислая (что вполне логично).
Сильные кислоты диссоциируют в разбавленных растворах практически полностью, поэтому среда разбавленных растворов сильных кислот, как правило, сильно кислотная. Некоторые кислоты (слабые) диссоциируют частично, поэтому среда водных растворов слабых кислот — слабо кислая.
Основания диссоциируют на катионы металлов и гидроксид-анионы ОН – :
МеОH = Ме + + ОН –
При этом в растворе возникает избыток катионов гидроксид-анионов ОН – , поэтому среда водных растворов оснований — щелочная. Сильные основания (щелочи) хорошо растворимы в воде, поэтому среда их водных растворов — сильно щелочная. Нерастворимые основания в воде практически не растворяются, поэтому в водном растворе оказывается лишь небольшое количество ионов ОН – . Среда водного раствора аммиака слабо щелочная.
Видео:Природные кислоты и щелочи. Индикаторы. 7 класс.Скачать

Растворы солей
Среда водных растворов солей определяется не только диссоциацией, но и особенностями взаимодействия катионов металлов и анионов кислотных остатков с водой — гидролизом солей .
Попадая в воду, соли диссоциируют на катионы металлов (или ион аммония NH4 + ) и анионы кислотных остатков.
Катионы металлов, которым соответствуют слабые основания, притягивают из воды ионы ОН – , при этом в воде образуются избыточные катионы водорода Н + . Протекает гидролиз по катиону. Катионы металлов, которым соответствуют сильные основания, с водой таким образом не взаимодействуют.
Например , катионы Fe 3+ подвергаются гидролизу:
Fe 3+ + HOH ↔ FeOH 2+ + H +
Анионы кислотных остатков, которым соответствуют слабые кислоты, притягивают из воды катионы Н + , при этом в воде остаются гидроксид-анионы ОН – . Протекает гидролиз по аниону. Анионы кислотных остатков сильных кислот таким образом с водой не взаимодействуют.
Например , ацетат-ионы (остаток уксусной кислоты CH3COOH) подвергаются гидролизу:
CH3COO — + HOH ↔ CH3COOH + OH —
В зависимости от состава соли водные растворы солей могут иметь кислую, нейтральную или щелочную среду.
Типы гидролиза солей в водных растворах:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Гидролиз не идет | Гидролиз по катиону |
| Анион слабой кислоты | Гидролиз по аниону | Гидролиз по катиону и аниону |
Среда водных растворов солей:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Нейтральная | Кислая |
| Анион слабой кислоты | Щелочна я | Нейтральная* |
* на практике среда водных растворов солей, образованных слабым основанием и слабой кислотой, определяется силой кислоты и основания
Тип гидролиза и среда водных растворов некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, гидролиз не идет, среда нейтральная | (NH4)2CO3 гидролиз по катиону, среда щелочная |
| CO3 2 – | Na2CO3, гидролиз по аниону, среда щелочна я | Na2CO3, гидролиз по катиону и аниону, среда определяется силой кислоты и основания |
Индикаторы будут по-разному окрашиваться в водных растворах таких солей, в зависимости от среды. Таким образом, с помощью индикаторов можно различить водные растворы некоторых солей.
Окраска лакмуса в водных растворах солей, в зависимости от строения соли:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Лакмус фиолетовый | Лакмус красный |
| Анион слабой кислоты | Лакмус синий | Окраска лакмуса зависит от силы кислоты и основания |
Окраска лакмуса в водных растворах некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, лакмус фиолетовый | (NH4)2CO3 лакмус красный |
| CO3 2 – | Na2CO3, лакмус синий | Na2CO3, окраска лакмуса зависит от силы кислоты и основания |
Добавить комментарий
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Видео:Опыты по химии. Реакция нейтрализацииСкачать

Урок 35. Химические свойства кислот
В уроке 35 «Химические свойства кислот» из курса «Химия для чайников» узнаем о всех химических свойствах кислот, рассмотрим с чем они реагируют и что при этом образуется.
В состав молекулы любой кислоты обязательно входят атомы водорода, связанные с различными кислотными остатками. Такое подобие состава молекул обусловливает подобие химических свойств кислот. Оно выражается в том, что кислоты в водных растворах проявляют схожие химические свойства, называемые кислотными свойствами. Знание этих свойств очень важно для дальнейшего изучения химии, поэтому познакомимся с ними более подробно и систематизируем изученный ранее материал.
Видео:Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

Изменение окраски индикаторов
Вы уже знаете, что для доказательства наличия кислоты или щелочи в растворе можно использовать особые вещества — индикаторы.
Вспомните, в какие цвета окрашены растворы индикаторов лакмуса, метилоранжа и фенолфталеина. Как изменяется их окраска в растворах кислот?
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Взаимодействие с металлами
Из материала предыдущих тем вам известно, что в водных растворах многие кислоты реагируют с металлами, расположенными в ряду активности левее Н2 (например, Mg, Al, Zn, Fe). В результате этих реакций образуются сложные вещества — соли и выделяется газообразное простое вещество — водород:
В такие реакции вступают как бескислородные (HCl, HBr), так и кислородсодержащие (H2SO4, H3PO4) кислоты, например:
Реакции этого типа, как вы уже знаете, относятся к реакциям замещения: атомы металлов замещают (вытесняют) атомы водорода из молекул кислот.
Следует помнить, что металлы, расположенные в ряду активности правее Н2 (Сu, Ag, Hg и др.), с указанными кислотами в
водных растворах не реагируют.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакции с основными оксидами
Еще в младших классах, изучая математику, вы узнали, что от перемены мест слагаемых сумма не изменяется: 2 + 3 = 5; 3 + 2 = 5.
Похожее правило есть и в химии: если в уравнении реакции исходные вещества поменять местами, то ее продукты от этого не изменятся. Так, например, изучив ранее химические свойства основных оксидов, вы узнали, что они реагируют с кислотами с образованием солей и воды. Зная это, вы можете теперь смело утверждать, что кислоты реагируют с основными оксидами, образуя те же продукты — соли и воду:
Пример уравнения реакции, протекающей в соответствии с этой схемой:
Как вам уже известно, эти реакции относятся к реакциям обмена, поскольку в процессе взаимодействия исходные сложные вещества обмениваются своими составными частями.
Видео:Химические свойства КИСЛОТ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием кислотСкачать

Взаимодействие с основаниями
Изучая химические свойства оснований, вы узнали, что они реагируют с кислотами с образованием солей и воды. А что же тогда образуется при взаимодействии кислот с основаниями? Правильно, те же самые продукты — соли и вода! Мы еще раз убедились в том, что состав конечных веществ не зависит от того, в каком порядке смешиваются одни и те же исходные вещества. Итак, составим схему, согласно которой кислоты реагируют с основаниями:
Запомните, что в образующейся соли валентность атомов металла такая же, как в исходном основании, а валентность кислотного остатка такая же, как в исходной кислоте.
Кислоты реагируют как с нерастворимыми, так и с растворимыми основаниями, например:
Реакции этого типа, как и предыдущего, относятся к реакциям обмена. Вспомните, как называется реакция, которую отображает последнее уравнение. Почему она так называется?
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Взаимодействие с солями
Еще один класс сложных веществ, с которыми кислоты могут вступать в химическое взаимодействие, — соли. Реакции этого типа идут по общей схеме:
Однако сразу заметим, что кислота реагирует в растворе с солью лишь в том случае, если в результате реакции выделяется газ (↑) или образуется нерастворимое вещество, выпадающее в осадок (↓). Примеры таких реакций:
Очевидно, что реакции этого типа, как и двух предыдущих, относятся к реакциям обмена.
Видео:ИндикаторыСкачать

Разложение кислот на кислотные оксиды и воду
Известно несколько кислот, которые достаточно легко разлагаются на соответствующий кислотный оксид и воду. К таким кислотам, которые называют неустойчивыми, относят угольную (H2CO3), сернистую (H2SO3) и кремниевую (H2SiO3) кислоты. Особенно неустойчива угольная кислота — она разлагается на кислотный оксид CO2 и воду уже при комнатной температуре:
Краткие выводы урока:
- Кислоты в растворах изменяют окраску индикаторов.
- Кислоты реагируют с металлами, основными оксидами, основаниями и солями.
Надеюсь урок 35 «Химические свойства кислот» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
💡 Видео
Что такое ИНДИКАТОРЫ и как их ЗАПОМНИТЬ?Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Опыты по химии. Отношение кислот к металламСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Гидролиз солей. 9 класс.Скачать

КИСЛОТЫ ХИМИЯ // Урок Химии 8 класс: Кислоты, Кислотный Остаток, Классы Неорганических СоединенийСкачать

Химические свойства соляной кислотыСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать