Окисление аммиака кислородом воздуха без катализатора возможно только до N2. На катализаторе между аммиаком и кислородом протекают следующие параллельные реакции:
Одновременно с этими реакциями могут протекать (параллельно и последовательно) побочные реакции:
Приведенные уравнения каталитического окисления аммиака являются суммарными и не отражают истинного механизма процесса.
Из теплового эффекта этих реакций можно видеть, что среди реакций окисления аммиака кислородом наибольшую термодинамическую вероятность имеет реакция (X). Вероятность реакции (IX) с повышением температуры возрастает почти вдвое, а реакции (X) почти не изменяется.
Реакции окисления аммиака сопровождаются значительной убылью свободной энергии, протекают с большой скоростью, практически необратимо (до конца). Теплоты, выделяющейся в результате реакции, вполне достаточно, чтобы процесс протекал автотермично.
Катализаторы, применяемые для окисления аммиака, должны обладать избирательными свойствами, т. е. ускорять только одну из всех возможных реакций, а именно реакцию (IX) окисления аммиака до оксида азота (II). Наиболее селективным и активным катализатором данной реакции оказался платиноидный катализатор, представляющий собой сплав платины с палладием и родием.
Каталитическое окисление аммиака — многостадийный гетерогенно-каталитический процесс, протекающий во внешнедиффузионной области и лимитируемый диффузией аммиака к поверхности катализатора. Ряд гипотез относительно механизма окисления аммиака на платиноидных катализаторах сводится к предположениям об образовании в процессе окисления NH, нестойких промежуточных соединений, которые в результате распада и перегруппировки дают оксид азота (II) и элементарный азот.
Скорость каталитического окисления аммиака по реакции (IX) очень высока. За десятитысячные доли секунды степень превращения аммиака в оксид азота (II) достигает 97—98% при атмосферном давлении.
Окисление оксида азота (II). Нитрозные газы, полученные при окислении аммиака, содержат оксид азота (II), азот, кислород и пары воды. При переработке нитрозных газов в азотную кислоту необходимо окислить оксид азота (II) до диоксида. Реакция окисления
обратима, протекает с уменьшением объема и сопровождается выделением теплоты. Следовательно, в соответствии с принципом Ле Шателье снижение температуры и повышение давления способствуют смещению равновесия реакции вправо, т. е. в сторону образования N02.
Окисление оксида азота (П) — самая медленная стадия производства азотной кислоты. Применение в производстве азотной кислоты воздуха, обогащенного кислородом, или чистого кислорода позволяет получать нитрозные газы с повышенным содержанием оксида азота (II) и увеличить скорость окисления N0 в N02.
Нитрозные газы, поступающие на абсорбцию, содержат N02, N204, NO, N20, N,, N203, пары воды.
Абсорбция диоксида азота.Все оксиды азота, за исключением N0, взаимодействуют с водой с образованием азотной кислоты. Поглощение оксидов азота водой связано с растворением в ней N02, N204, N203 и образованием азотной и азотистой кислот. Азотистая кислота является малоустойчивым соединением и распадается на азотную кислоту, оксид азота (II) и воду. Абсорбция протекает по схеме
3HN02 ↔ HNO3 + 2N0 + Н20 ΔН = 76 кДж. (XVI)
Суммарно взаимодействие N02 с водой можно представить уравнением реакции
которое является исходным для всех расчетов процесса абсорбции.
Степень поглощения диоксида азота водными растворами азотной кислоты определяется температурой, давлением, концентрацией кислоты. С понижением температуры и концентрации кислоты и повышением давления степень превращения диоксида азота растет. При концентрации азотной кислоты выше 65% поглощение почти прекращается.
Видео:Гетерогенный катализ. Каталитическое окисление аммиакаСкачать

Окисление аммиака и его свойства
Одним из важнейших соединений азота является аммиак. По физическим свойствам это — бесцветный газ с резким, удушающим запахом (это запах водного раствора гидроксида аммония NH₃·H₂O). Газ хорошо растворяется в воде. В водном растворе аммоний является слабым основанием. Является одним из важнейших продуктов химической промышленности.
NH₃ — хороший редуктор, как в молекуле аммония, азот имеет самую низкую степень окисления -3. Многие характеристики аммиака определяются парой одиночных электронов в атоме азота – реакции присоединения с аммиаком происходят из-за его присутствия (эта пара одиночек расположена на свободной орбите Протона H⁺).
Видео:Каталитическое окисление аммиака, демонстрация ✨Скачать

Как получить аммиак

Существуют два основных практических метода получения аммиака: один в лаборатории, другой — в промышленности.
Рассмотрим получение аммиака в промышленности. Взаимодействие молекулярного азота и водорода: N₂ + 2H₂ = 2NH₃ (обратимая реакция). Этот метод получения аммиака называется реакцией Хабера. Для молекулярного азота и водорода, которые должны прореагировать, их необходимо нагреть к 500 ᵒC или 932 ᵒF, давлению MPA 25-30 необходимо создаться. Пористый утюг должен присутствовать как катализатор.
Получение в лаборатории – это реакция между хлоридом аммония и гидроксидом кальция: СА(OH)₂ + 2NH₄Cl = CaCl₂ + 2NH₄OH (как NH₄OH — очень слабое соединение, оно сразу же распадается на газообразный аммиак и воду: NH₄OH = NH₃ + H₂O).
Видео:Каталитическое окисление аммиака кислородом воздухаСкачать

Реакция окисления аммиака
Они протекают с изменением состояния окисления азота. Так как аммиак — хороший редуктор, его можно использовать для уменьшения тяжелых металлов от их окисей.
Уменьшение металлов: 2NH₃ + 3CuO = 3Cu + N₂ + 3H₂O (когда меди (II) оксид нагревают в присутствии аммиака, металлическая медь красного цвета уменьшается).
Окисление аммиака в присутствии сильных окислителей (например, галогенов) происходит по уравнению: 2NH₃ + 3Cl₂ = N₂ + 6HCl (для проведения этой окислительно-восстановительной реакции требуется нагрев). При воздействии перманганата калия на аммиак в щелочной среде наблюдается образование молекулярного азота, марганцовокислого калия и воды: 2NH₃ + 6KMnO₄+ 6KOH = 6K₂MnO₄+ N₂ + 6H₂O.
При интенсивном нагревании (до 1200 ° C или 2192 ᵒF) аммиак может распадаться на простые вещества: 2NH₃ = N₂ + 3H₂. На 1000 oC или 1832 аммиак реагирует с метаном CH4:2CH₄ + 2NH₃ + 3O₂ = 2HCN + 6H₂O (синильной кислоты и воды). Путем оксидации аммиака с гипохлоритом натрия гидразин Н₂Х₄ можно получить: 2NH + NaOCl = N2H4 + NaCl + H2O
Видео:Каталитическое окисление аммиакаСкачать

Сжигание аммиака и его каталитическое окисление кислородом
Окисление аммиака кислородом имеет определенные особенности. Существует два различных типа окисления: каталитический (с катализатором), быстрый (горение).
При горении происходит окислительно-восстановительная реакция, продуктами которой являются молекулярный азот и вода: 4NH3 + 2O2 = 2N2 + 6H2O (пламя желто-зеленое, горение начинается при 651 или 103,8 градусов по Фаренгейту, так как это температура самовоспламенения аммиака). Каталитическое окисление кислорода также происходит при нагревании (около 800 ᵒC или 1472 ᵒF), но один из продуктов реакции отличается: 4NH₃ + 5O₂ = 4NO + 6H₂O (в присутствии платины или оксидов железа, марганца, хрома или кобальта в качестве катализатора продуктами окисления являются оксид азота (II) и вода).
Рассмотрим однородное окисление аммиака кислородом. Бесконтрольная однотипная оксидация участка газа аммиака — относительно медленная реакция. О ней не сообщается подробно, но нижний предел воспламеняемости аммиачно-воздушных смесей при 25 оС составляет около 15 % в интервале давлений 1-10 бар и уменьшается по мере повышения начальной температуры газовой смеси.
— это молевая доля NH3 в смеси воздух-аммиак с температурой tmixed (OC), то из данных CNH = 0.15-0 следует, что предел воспламеняемости низкий. Поэтому разумно работать с достаточным запасом прочности ниже нижнего предела воспламеняемости, как правило, данные о смешивании аммиака с воздухом часто далеки от совершенства.
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Химические свойства
Рассмотрим контактное окисление аммиака до оксида азота. Типичные химические реакции с аммиаком без изменения степени окисления азота:
- Реакция с водой: NH₃ + H₂O = NH₄OH = NH₄⁺ + он⁻ (реакция обратима, так как гидроксид аммония NH₄OH — это нестойкое соединение).
- Реакция с кислотами с образованием нормальных и кислых солей: NH₃ + HCl = NH₄Cl (нормальный хлорид аммония соли сформирован);NH₃ + H₂SO₄ = NH₄HSO₄ (в реакции аммиака с холодной концентрированной серной кислотой образуется кислотная соль гидросульфат аммония); 2NH₃ + H₂SO₄ = (NH₄)₂SO₄.
- Реакции с солями тяжелых металлов с образованием комплексов: 2NH₃ + AgCl = [Ag(NH₃)₂]Cl (сложные соединения серебра (I) хлоридные формы диамина).
- Реакция с haloalkanes: NH3 + CH3Cl = [CH3NH3]Cl (формы гидрохлорида метиламмония – это замещенный ион аммония NH4=).
- Реакция со щелочными металлами: 2NH₃ + 2K = 2KNH₂ + H₂ (образуется амид калия KNH₂; азот не изменяет состояние окисления, хотя реакция окислительно-восстановительная). Реакции присоединения происходят в большинстве случаев без изменения состояния окисления (все вышеперечисленные, кроме последней, классифицируются данным типом).
Видео:Уравнивание реакций горения углеводородовСкачать

Заключение
Аммиак — популярное вещество, которое активно используется в промышленности. На сегодняшний день она занимает особое место в нашей жизни, так как большинство продуктов ее деятельности мы используем каждый день. Эта статья будет полезна для прочтения многим, кто захочет узнать о том, что нас окружает.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Каталитическое окисление аммиака
Видео:Аммиак: как образуется и с чем реагирует? #аммиак #химия #видеоурок #егэхимияСкачать

Каталитическое окисление аммиака кислородом

Конец газоотводной трубки 2 вставляют (через U-образную трубку с натронной известью) в реакционную трубку 3, куда предварительно на середину ее введена электронагревательная спираль с катализатором 4 (оксидами хрома, железа, марганца или их смесью). Вместо этих оксидов можно воспользоваться тонкой медной сеткой.
Рис. Установка для каталитического окисления аммиака:
1— колба, 2 — газоотводная трубка, 3 — трубка-реактор, 4 — электроспираль с катализатором, 5 — колба для собирания оксидов азота, 6 — дугообразная трубка.
Тонкую медную сетку в качестве катализатора используют по аналогии с заводским контактным аппаратом, где аммиачно-кислородная смесь проходит через тончайшую платиново-иридиевую cетку в течение доли секунды с почти 100%-ным выходом окси дов азота. Медь менее активный катализатор. Поэтому контакт с ней должен быть продолжительнее, чем в заводских условиях.
Химизм протекающих в лабораторной установке процессов выражается следующими уравнениями химических реакций:
Колба 5 служит для собирания оксидов азота, а дугообразная трубка 6 — для поглощения оксидов азота водой, в нее прибавляют раствор лакмуса синего цвета. Соотношение аммиака и кислорода регулируют путем более или менее глубокого погружения в раствор аммиака левой трубки в колбе 1 и поворотами крана в трубке от газометра с кислородом.
Смесь газов пропускают через катализатор, который нагревают до того момента, когда он начнет раскаливаться, и экзотермический процесс будет протекать самопроизвольно. Затем электронагреватель выключают. Колба 5 заполняется бурым газом, который проходит в дугообразную трубку, вследствие чего синяя окраска находившейся в ней жидкости переходит в красную.
В начале опыта вместо ожидаемого бурого газа может появиться белый дымок нитрата и нитрита аммония. Чтобы уменьшить приток аммиака, следует поднять левую трубку в колбе 1 и немного усилить приток кислорода с помощью крана.
В колбу 5 поступают не только оксиды азота, но и пары во ды. Поэтому на дне колбы образуется жидкость (азотная и азотистая кислоты).
Меры предосторожности
Если смесь газов загорится в трубке с катализатором, необходимо немедленно прекратить доступ в прибор кислорода из газометра, для чего следует приоткрыть проб ку в колбе 1. Чтобы избежать взрыва, раствор аммиака в колбу доливают почти доверху, чтобы пространство для аммиачно-кислородной смеси было небольшим.
Каталитическое окисление аммиака сильно экзотермическая реакция, что может привести к размягчению и ломке обычной стеклянной трубки-реактора. Поэтому необходимо для опыта использовать тугоплавкую трубку (из кварца или стекла «пирекс»).
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
🔍 Видео
Каталитическое окисление аммиакаСкачать

Окисление аммиака в присутствии оксида хромаСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Аммиак и соли аммония. Видеоурок 29-30. Химия 9 классСкачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

8 Окисление аммиака на платинеСкачать

Горение аммиака в кислородеСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

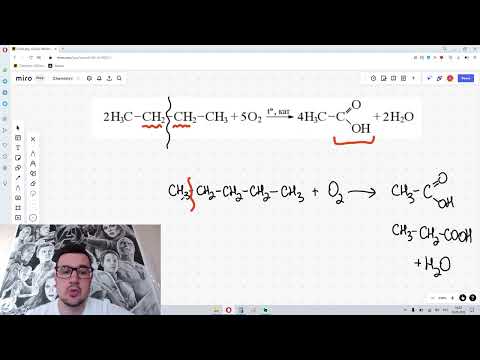
Химические свойства алканов. Реакция окисления алканов (механизм + сложные случаи). ЕГЭ по химии.Скачать
Аммиак. 9 класс.Скачать

Лекция 31 «Быстрые гетерогенно каталитические реакции»Скачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать




