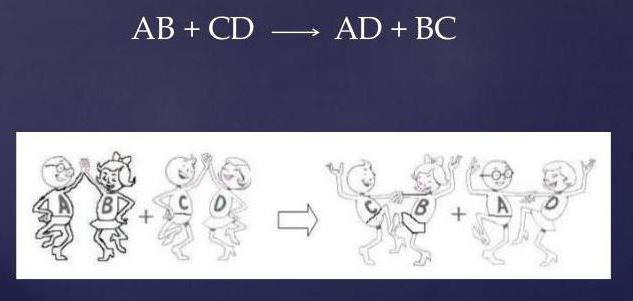
Кальций Ca — это щелочноземельный металл, серебристо-белый, пластичный, достаточно твердый. Реакционноспособный. Сильный восстановитель.
Относительная молекулярная масса Mr = 40,078; относительная плотность для твердого и жидкого состояния d = 1,54; tпл = 842º C; tкип = 1495º C.
Видео:Практическая работа №5. Разбавленная серная кислота и её соли. 9 класс.Скачать

Способ получения
1. В результате электролиза жидкого хлорида кальция образуются кальций и хлор :
2. Хлорид кальция взаимодействует с алюминием при 600 — 700º С образуя кальций и хлорид алюминия:
3CaCl2 + 2Al = 3Ca + 2AlCl3
3. В результате разложения гидрида кальция при температуре выше 1000º С образуется кальций и водород:
4. Оксид кальция взаимодействует с алюминием при 1200º С и образует кальций и алюминат кальция:
4CaO + 2Al = 3Ca + Ca(AlO2)2
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Качественная реакция
Кальций окрашивает пламя газовой горелки в коричнево-красный цвет.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Химические свойства
1. Кальций — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Кальций взаимодействует с азотом при 200 — 450º С образуя нитрид кальция:
1.2. Кальций сгорает в кислороде (воздухе) при выше 300º С с образованием оксида кальция:
2Ca + O2 = 2CaO
1.3. Кальций активно реагирует при температуре 200 — 400º С с хлором, бромом и йодом . При этом образуются соответствующие соли :
1.4. С водородом кальций реагирует при температуре 500 — 700º C с образованием гидрида кальция:
1.5. В результате взаимодействия кальция и фтора при комнатной температуре образуется фторид кальция:
1.6. Кальций взаимодействует с серой при 150º С и образует сульфид кальция:
Ca + S = CaS
1.7. В результате реакции между кальцием и фосфором при 350 — 450º С образуется фосфид кальция:
1.8. Кальций взаимодействует с углеродом (графитом) при 550º С и образует карбид кальция:
Ca + 2C = CaC2
2. Кальций активно взаимодействует со сложными веществами:
2.1. Кальций при комнатной температуре реагирует с водой . Взаимодействие кальция с водой приводит к образованию гидроксида кальция и газа водорода:
2.2. Кальций взаимодействует с кислотами:
2.2.1. Кальций реагирует с разбавленной соляной кислотой, при этом образуются хлорид кальция и водород :
Ca + 2HCl = CaCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой кальций образует нитрат кальция, оксид азота (I) и воду:
если азотную кислоту еще больше разбавить, то образуются нитрат кальция, нитрат аммония и вода:
2.3. Кальций вступает в реакцию с газом аммиаком при 600 — 650º С. В результате данной реакции образуется нитрид кальция и гидрид кальция:
если аммиак будет жидким, то в результате реакции в присутствии катализатора платины образуется амид кальция и водород:
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Реакция взаимодействия CaCl2, H2SO4
Одним из камней преткновения на первых шагах изучения химических закономерностей и основ является написание химических реакций. Поэтому вопросы о взаимодействии CaCl2, H2SO4 встречаются даже не периодически, а систематически. Разберем основные «проблемные» моменты.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Запись молекулярного уравнения
Взаимодействие между хлоридом кальция (соль) и серной кислотой протекает по обменному механизму.
- два соединения на входе (исходные вещества);
- два соединения на выходе (продукты);
- полное отсутствие простых веществ.
Обмениваясь друг с другом реакционными группами, реагенты видоизменяются, а уравнение принимает вид:
CaCl2 + H2SO4 = CaSO4 + 2HCl.
Как видно, два сложных вещества, меняясь ионами, образуют совершенно иные соединения: новую соль (CaSO4) и соляную кислоту (HCl).
Видео:Реакция хлорида кальция с серной кислотойСкачать

Возможность протекания до конца
Ответить на сей вопрос можно запросто, записав для CaCl2, H2SO4 уравнение реакции в молекулярном виде. От вида продуктов и будет всё зависеть. До конца процесс идет в случае образования:
- труднорастворимого вещества (осадка);
- летучего соединения (газа);
- малодиссоциирущего реагента (воды, слабого электролита).
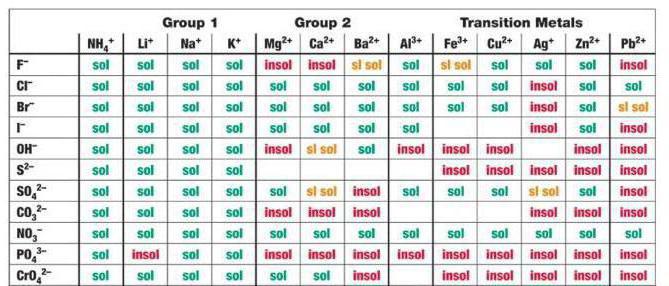
В рассматриваемом для CaCl2, H2SO4 случае среди продуктов реакции имеется сульфат кальция – малорастворимое соединение, выпадающее в осадок, согласно таблице.
Следовательно, обменный процесс пройдет до конца.
Видео:Серная кислота. Химические свойства. Реакции с металлами.Скачать

Сокращенная ионная форма записи между CaCl2, H2SO4
Расписав все растворимые соединения на ионы и сократив повторяющиеся реакционные группы, получим два искомых уравнения:
- полная ионная форма записи между CaCl2, H2SO4
ca 2+ + 2cl — + 2h + + so4 2- = caso4 + 2h + + 2cl —
- сокращенный вид уравнения
Следует помнить, что на ионы расписываются только растворимые соли, кислоты, основания (это легко определяется по специальным таблицам). Слабые электролиты типа угольной или уксусной кислоты всегда пишутся в молекулярной форме.
Теперь вы знаете, как происходит взаимодействие между хлоридом кальция (соль) и серной кислотой.
🎬 Видео
Реакция Оксида Кальция и Серной Кислоты. Реакция CaO и H2SO4.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Серная кислота и ее соли. 9 класс.Скачать

КАЧЕСТВЕННАЯ РЕАКЦИЯ НА ИОН КАЛЬЦИЯ С СЕРНОЙ КИСЛОТОЙ YouTubeСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

8 класс. Составление уравнений химических реакций.Скачать

Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Химия. 7 класс. Реакции разбавленных кислот с карбонатами /02.02.2021/Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать