Калий К — это щелочной металл. Серебристо-белый, мягкий, легкоплавкий.
Относительная молекулярная масса Mr = 39,098; относительная плотность для твердого состояния d = 0,8629; относительная плотность для жидкого состояния d = 0,83; tпл = 63, 51º C; tкип = 760º C.
Видео:Химия. 10 класс. Натрий, калий и их важнейшие соединения: физические и химические свойстваСкачать

Способ получения
1. Калий получают в промышленности путем разложения гидрида калия при температуре 400º С в вакууме, при этом образуются калий и водород :
2KH = 2K + H2
2. В результате электролиза жидкого гидроксида калия образуются калий, кислород и вода :
4KOH → 4K + O2↑ + 2H2O
Видео:Взаимодействие калия и натрия с водойСкачать

Качественная реакция
Качественная реакция на калий — окрашивание пламени солями калия в фиолетовый цвет .
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические свойства
1. Калий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Калий легко реагирует с водородом при 200–350º C образованием гидрида калия:
2K + H2 = 2KH
1.2. Калий сгорает в кислороде с образованием надпероксида калия:
1.3. Калий активно реагирует при комнатной температуре с фтором, хлором, бромом и йодом . При этом образуются фторид калия, хлорид калия, бромид калия, йодид калия :
2K + F2 = 2KF
2K + Cl2 = 2KCl
2K + Br2 = 2KBr
2K + I2 = 2KI
1.4. С серой, теллуром и селеном реагирует при температуре 100–200º C с образованием сульфида калия, селенида калия и теллурид калия :
2K + S = K2S
2K + Se = K2Se
2K + Te = K2Te
1.5. Калий реагирует с фосфором при 200º C в атмосфере аргона с образованием фосфида калия:
3K + P = K3P
2. Калий активно взаимодействует со сложными веществами:
2.1. Калий реагирует с водой . Взаимодействие натрия с водой приводит к образованию щелочи и газа водорода:
2K 0 + 2 H2 O = 2 K + OH + H2 0
2.2. Калий взаимодействует с кислотами . При этом образуются соль и водород.
2.2.1. Ка лий реагирует с разбавленной соляной кислотой, при этом образуются хлорид калия и водород :
2K + 2HCl = 2KCl + H2 ↑
2.2.2. При взаимодействии с разбавленной с ерной кислотой образуется сульфат калия, сероводород и вода:
2.2.3. Реагируя с азотной кислотой калий образует нитрат калия, можно образовать газ оксид азота (II), газ оксид азота (I), газ азот и воду.
2.2.4. В результате реакции насыщенной сероводородной кислоты и калия в бензоле образуется осадок гидросульфид калия и газ водород:
2K + 2H2S = 2KHS↓ + H2↑
2.3. Калий при температуре 65–105º C может реагировать с аммиаком , при этом образуются амид натрия и водород:
2.4. Калий может взаимодействовать с гидроксидами:
Например , Калий взаимодействует с гидроксидом калия при температуре 450º С, при этом образуется оксид калия и водород:
2K + 2KOH = 2K2O + H2
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Please wait.
Видео:Получение хлората калия, бертолетовой соли из отбеливателя (химия)Скачать

We are checking your browser. gomolog.ru
Видео:Химия | Молекулярные и ионные уравненияСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Качественная реакция ионов калия с гидротартратом натрияСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de1f18b0e820bcd • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Реакция лития, натрия и калия с водойСкачать

Калий и натрий
- Краткая характеристика и нахождение в природе.
- История открытия.
- Физические свойства.
- Химические свойства.
- Едкие щелочи. Соли металлов.
- Способы получения и область применения.
- Краткая характеристика и нахождение в природе.
Натрий и калий относятся к числу довольно распространенных элементов.
Содержание натрия в земной коре составляет 2,64%, калия – 2,6%.
В свободном виде калий и натрий в природе не встречаются. Эти щелочные металлы входят в состав различных соединений. Одним из таких соединений является – хлорид натрия NaCl (образует залежи каменной соли — Донбасс, Соликамск, Соль-Илецк и др).
Также хлорид натрия содержится в морской воде и соляных источниках.
Калийные соли также присутствуют в морской воде, но в значительно меньших количествах. Обычно калийные соли содержат верхние слои залежей. Самые большие в мире запасы калийных солей находятся на Урале в районе Соликамска. В Белоруссии (г.Солигорск) открыты крупные залежи калийных солей
Мы не случайно рассматриваем натрий и калий вместе, сходные своими физическими свойствами, они и открыты были одновременно.
В 1807 г. Дэви, путем электролиза слегка увлажненных твердых щелочей, были получены свободные металлы — калий и натрий. В то время они получили названия — потассий (Potassium) и содий (Sodium).
В следующем году Гильберт, издатель известных «Анналов физики»,
предложил именовать новые металлы калием и натронием (Natronium).
Позднее Берцелиус сократил последнее название до «натрий» (Natrium).
Вообще, название «натрий» (англ. и франц. Sodium, нем. Natrium) происходит от древнего слова, распространенного в Египте, у древних греков (vixpov) и римлян и соответствует древнееврейскому нетер (neter).
В древнем Египте натроном, или нитроном называли щелочь, получаемую не только из природных содовых озер, но и из золы растений. Ее употребляли для мытья, изготовления глазурей, при мумификации
трупов. В конце XVIII в. Клапрот ввел для минеральной щелочи
название натрон (Natron), а для растительной — кали (Kali).
Известно, что в начале XIX в. в России натрий называли содием.
Что касается слова калий, то оно происходит от арабского термина
алкали (щелочные вещества, именуемые в средние века “щелочные соли”). В то время их еще не отличали друг от друга и называли именами, имевшими сходное значение: натрон, боракс, варек т. д. Слово кали (qila) впервые встречается в 850 г. у арабских писателей, затем начинает употребляться слово Qali (al-Qali), которое обозначало продукт, получаемый из золы некоторых
растений. В России, в первой четверти XIX в., калий назывался потассий, поташ, а также поташий. В 1828 г. в химической литературе наряду с названием поташ уже встречается название кали (едкое кали, кали соляный и др.).
Название калий стало общепринятым во всем мире после выхода в свет учебника Гесса.
Калий и натрий – серебристо-белые металлы, с плотностью
K = 0,86 г/см3, Na = 0,97г/см3,
Эти металлы очень мягкие, режутся ножом.
Обладают всеми свойствами, присущими веществам с металлической связью, а именно: металлический блеск, пластичность, мягкость, хорошая электрическая проводимость и теплопроводность.
Это обусловлено тем, что в атомах щелочных металлов один внешний электрон приходится на 4 и более свободные орбитали, а энергия ионизации атомов низкая, в следствии чего между атомами металлов возникает металлическая связь.
В природе натрий состоит из одного изотопа
калий – из двух стабильных изотопов
При химическом взаимодействии, атомы калия и натрия легко отдают валентные электроны, переходя в положительно заряженные ионы: K+ и Na+. Оба металла являются сильными восстановителями.
Быстро окисляются на открытом воздухе, поэтому необходимо хранить калий и натрий под слоем керосина.
Реакция с водой — бурная. Эти металлы легко взаимодействуют со многими неметаллами –серой, фосфором, галогенами и др.
Образуют гидриды NaH, KH, взаимодействуя с водородом, при нагревании. Эти гидриды легко разлагаются водой с образованием
соответствующей щелочи и водорода:
NaH + H2O = NaOH + H2
При сгорании натрия в избытке кислорода образуется пероксид натрия Na2O2, который в свою очередь взаимодействует с влажным углекислым газом воздуха, выделяя кислород:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
На этой реакции основано применение пероксида натрия для получения кислорода на
подводных лодках и для регенерации воздуха в закрытых помещениях.
Едкие щелочи. Соли металлов.
Едкими щелочами называются хорошо растворимые в воде гидроксиды. Важнейшие из них NaOH и KOH.
Гидроксид натрия и гидроксид калия – белые, непрозрачные, твердые
кристаллические вещества. В воде хорошо растворяются с выделением большого количества теплоты. В водных растворах практически нацело диссоциированы и являются сильными щелочами. Проявляют все свойства оснований.
Твердые гидроксиды натрия и калия и их водные растворы поглощают оксид углерода (IV):
NaOH + CO2 = NaHCO3
2NaOH + CO2 = Na2CO3 + H2O
или в иной форме:
2OH- + CO2 = CO + H2O
В твердом состоянии на воздухе NaOH и KOH поглощают влагу, благодаря чему используются как осушители газов.
В промышленности гидроксид натрия и гидроксид калия получают электролизом концентрированных растворов соответственно NaCl и KCl. При этом одновременно получаются хлор и водород. Катодом служит железная сетка, анодом – графит.
Схему электролиза (на примере KCl) следует представлять так, KCl полностью диссоциирует на ионы K+ и Cl-. При прохождении электрического тока к катоду подходят ионы K+, к аноду – хлорид-ионы Cl-. Калий в ряду стандартных электродных потенциалов расположен до алюминия, и его ионы восстанавливаются
(присоединяют электроны) гораздо труднее, чем молекулы воды. Ионов же водорода H+ в растворе очень мало. Поэтому на катоде разряжаются молекулы воды с выделением молекулярного водорода:
2H2O + 2e- = H2 + 2OH-
Хлорид-ионы в концентрированном растворе легче отдают электроны (окисляются), чем молекулы воды, поэтому на аноде разряжаются хлорид-ионы:
Общее уравнение электролиза раствора в ионной форме:
2H2O + 2e- = H2 + 2OH- 1
2Cl- + 2H2O электролиз H2 + 2OH- + Cl2
2KCl + 2H2O электролиз H2 + 2KOH + Cl2
Аналогично протекает электролиз раствора NaCl. Раствор, содержащий NaOH и NaCl, подвергается упариванию, в результате чего выпадает в осадок хлорид натрия (он имеет намного меньшую растворимость и она мало изменяется с температурой), который отделяют и используют для дальнейшего электролиза. Гидроксид натрия получают в очень больших количествах. Он является одним из важнейших продуктов основной химической промышленности. Применяют его для очистки нефтяных продуктов – бензина и керосина, для производства мыла, искусственного шелка, бумаги, в текстильной, кожевенной, химической промышленности, а также в быту (каустик,каустическая сода).
Более дорогой продукт – гидроксид калия – применяется реже, чем NaOH.
Соли калия и натрия.
Практически все соли калия и натрия растворимы в воде.
Натрий способен образовывать соли со всеми кислотами.
Наиболее распространенными и используемыми в быту и промышленности являются – хлорид натрия NaCl (поваренная соль), сода и сульфат натрия Na2SO4.
Рассмотрим каждую из них в одельности.
Хлорид натрия NaCl – используется для консервирования пищевых продуктов, в качестве приправы при приготовлении пищи, является сырьем в промышленности при получения гидроксида натрия, хлора, соляной кислоты, соды и др.
Сульфат натрия Na2SO4 – используется в промышленности для приготовления глауберовой соли, путем кристаллизации десятиводного гидрата Na2SO4 * 10H2O.
Глауберова соль применяется в медицине как слабительное.
Соли натрия и калия (ионы натрия и калия), применяются при качественном обнаружении натрия и калия в соединениях.
Соли натрия окрашивают пламя горелки в желтый цвет.
Соли калия окрашивают пламя горелки в фиолетовый цвет.
Это очень чувствительный метод. Единственный его минус то, что в присутствии даже ничтожных количеств натрия в соединениях фиолетовый цвет маскируется желтым. В этом случае используют синее стекло, поглощающее желтые лучи.
Калийные соли используют главным образом как калийные удобрения.
- Получение и область применения.
Натрий получают в процессе электролиза расплавленного хлорида натрия или гидроксида натрия.
При электролизе расплава гидроксида натрия NaOH на катоде выделяется натрий:
а на аноде – вода и кислород:
4OH- — 4e- = 2H2O + O2
При электролизе расплава хлорида натрия NaCl на катоде выделяется натрий:
А на аноде – хлор:
Предпочтительнее, с экономической точки зрения, вследствие дороговизны гидроксида натрия,использовать в качестве основного метода электролиз расплава NaCl.
Также как и натрий, калий можно получить в процессе электролиза хлорида калия KCl и гидроксида калия KOH.
Но этот способ не получил широкого распространения, т.к. в процессе электролиза возник ряд технических трудностей, в том числе, трудность обеспечения техники безопасности.
На сегодняшний день получение калия в промышленности основано на следующих реакциях:
1. KCl + Na Ы NaCl + K
При получении калия этим способом, через расплавленный хлорид калия пропускают пары натрия при 8000С, а выделяющиеся пары калия конденсируют.
2. KOH + Na Ы NaOH + K
Здесь взаимодействие между расплавленным гидроксидом калия и жидким натрием осуществляется противотоком при температуре 4400С в реакционной колонне из никеля.
Также этими способами можно получать сплав калия с натрием. Этот сплав применяется:
в атомных реакторах, как жидкий металлический теплоноситель.
в качестве восстановителя при производстве титана.
Широко используют калий и его соединения в различных отраслях хозяйства:
- при получении некоторых красителей,
- при гидролизе крахмала,
- при производстве пороха,
- при отбелке тканей.
С помощью пероксидов натрия и калия проводится регенерация воздуха в космических кораблях и подводных лодках.
Поташ в больших количествах идет на производство стекла. Используя едкий калий производят самое лучшее — жидкое туалетное мыло.
1. “Пособие по химии для поступающих в вузы”. Г.П.Хомченко. 1976 г.
2. “Основы общей химии”. Ю.Д.Третьяков, Ю.Г.Метлин. Москва “Просвещение” 1980 г.
Ошибка в тексте? Выдели её мышкой и нажми
Остались рефераты, курсовые, презентации? Поделись с нами — загрузи их здесь!
📺 Видео
Взаимодействие перманганата калия с сульфитом натрия в щелочной среде KMnO4 + KOH + Na2SO3Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Обесцвечивание Раствора. Реакция Раствора Люголя (Трииодид калия) и Гидроксида Натрия. KI3+NaOHСкачать

Фтористый Хромил - CrO2F2. Реакция Дихромата Калия, Фторида Натрия и Серной кислоты.Скачать

Решаем два варианта Добротина за 2 часаСкачать

Взрыв калий-натриевого сплава. Эффектные опыты. Спецвыпуск.Скачать

Проклятая химическая реакция 😜 #shortsСкачать

Самая лучшая подборка реакций с хлоратом калия! (химия)Скачать

Тиоцианат Нитрозила - (NO)NCS. Реакция Тиоцианата Калия, Нитрита Натрия и Серной кислоты.Скачать

Реакции ионного обмена. 9 класс.Скачать

🔥 ПОЛУЧЕНИЕ КАЛИЯ И НАТРИЯ В ДОМАШНИХ УСЛОВИЯХ своими рукамиСкачать

ТЕТРАХЛОРМЕТАН и КАЛИЙ-НАТРИЕВЫЙ сплавСкачать


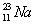 В природе натрий состоит из одного изотопа
В природе натрий состоит из одного изотопа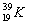 калий – из двух стабильных изотопов
калий – из двух стабильных изотопов