Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание Видео:Фосфор. 9 класс.Скачать  Фосфид калия
Фосфид калия (фосфористый калий) — бинарное неорганическое соединение калия и фосфора с формулой K3P. Зелёные кристаллы. Видео:Химия 9 класс (Урок№16 - Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора(V).)Скачать  СодержаниеВидео:Взрывная реакция, химический опыт (Красный Фосфор + Хлорат Калия) МИТХТ | Chemical experience burstСкачать  Получение
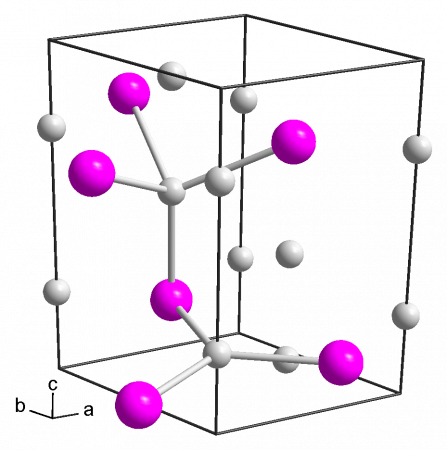
3K + P → 700oC K3P Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Физические свойстваФосфид калия образует кристаллы гексагональной сингонии, пространственная группа P 63/mmc, параметры ячейки a = 0,5691 нм , c = 1,005 нм , Z = 2 . Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать  Химические свойстваСильный восстановитель. Реагирует с водой и влагой воздуха с выделением высокотоксичного и легковоспламеняющегося газообразного фосфина: Видео:8 класс. Составление уравнений химических реакций.Скачать  Калий: способы получения и химические свойстваКалий К — это щелочной металл. Серебристо-белый, мягкий, легкоплавкий. Относительная молекулярная масса Mr = 39,098; относительная плотность для твердого состояния d = 0,8629; относительная плотность для жидкого состояния d = 0,83; tпл = 63, 51º C; tкип = 760º C. Видео:Биология. 7 класс. Дефицит макроэлементов (азот, калий, фосфор) у растенийСкачать  Способ получения1. Калий получают в промышленности путем разложения гидрида калия при температуре 400º С в вакууме, при этом образуются калий и водород : 2KH = 2K + H2 2. В результате электролиза жидкого гидроксида калия образуются калий, кислород и вода : 4KOH → 4K + O2↑ + 2H2O Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  Качественная реакцияКачественная реакция на калий — окрашивание пламени солями калия в фиолетовый цвет . Видео:№ 231. Неорганическая химия. Тема 28. Фосфор и его соединения. Часть 4. Фосфор в продуктах питанияСкачать  Химические свойства1. Калий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами : 1.1. Калий легко реагирует с водородом при 200–350º C образованием гидрида калия: 2K + H2 = 2KH 1.2. Калий сгорает в кислороде с образованием надпероксида калия: 1.3. Калий активно реагирует при комнатной температуре с фтором, хлором, бромом и йодом . При этом образуются фторид калия, хлорид калия, бромид калия, йодид калия : 2K + F2 = 2KF 2K + Cl2 = 2KCl 2K + Br2 = 2KBr 2K + I2 = 2KI 1.4. С серой, теллуром и селеном реагирует при температуре 100–200º C с образованием сульфида калия, селенида калия и теллурид калия : 2K + S = K2S 2K + Se = K2Se 2K + Te = K2Te 1.5. Калий реагирует с фосфором при 200º C в атмосфере аргона с образованием фосфида калия: 3K + P = K3P 2. Калий активно взаимодействует со сложными веществами: 2.1. Калий реагирует с водой . Взаимодействие натрия с водой приводит к образованию щелочи и газа водорода: 2K 0 + 2 H2 O = 2 K + OH + H2 0 2.2. Калий взаимодействует с кислотами . При этом образуются соль и водород. 2.2.1. Ка лий реагирует с разбавленной соляной кислотой, при этом образуются хлорид калия и водород : 2K + 2HCl = 2KCl + H2 ↑ 2.2.2. При взаимодействии с разбавленной с ерной кислотой образуется сульфат калия, сероводород и вода: 2.2.3. Реагируя с азотной кислотой калий образует нитрат калия, можно образовать газ оксид азота (II), газ оксид азота (I), газ азот и воду. 2.2.4. В результате реакции насыщенной сероводородной кислоты и калия в бензоле образуется осадок гидросульфид калия и газ водород: 2K + 2H2S = 2KHS↓ + H2↑ 2.3. Калий при температуре 65–105º C может реагировать с аммиаком , при этом образуются амид натрия и водород: 2.4. Калий может взаимодействовать с гидроксидами: Например , Калий взаимодействует с гидроксидом калия при температуре 450º С, при этом образуется оксид калия и водород: 2K + 2KOH = 2K2O + H2 🎦 ВидеоВзаимодействие хлора с фосфоромСкачать  Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  ФОСФОРНЫЕ экспериментыСкачать  Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать  РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Детонация хлората калия с красным фосфором. Бертолетова соль. (ХК)Скачать  Химия фосфора | Химия ЕГЭ 2022 | УмскулСкачать  Фосфор и его соединения: химические свойства #фосфор #химшкола #неметаллы #егэхимияСкачать  Фосфор - Элемент, ПОДЖИГАЮЩИЙ ВСЕ ВОКРУГ!Скачать  Красный фосфор и бертолетова сольСкачать  Реакции горенияСкачать  | |||||||||||||||||||||||||