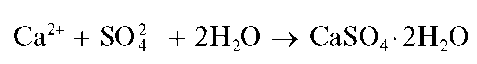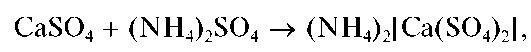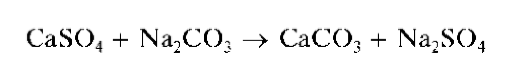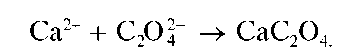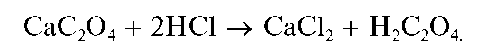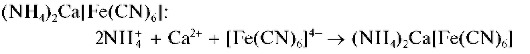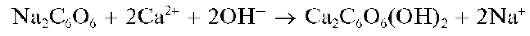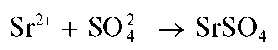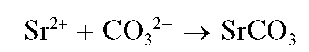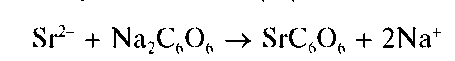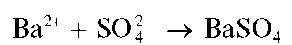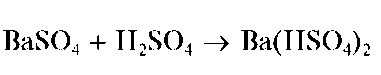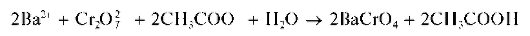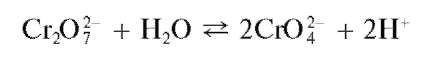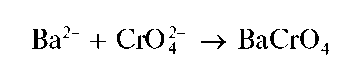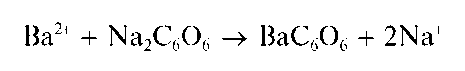III аналитическая группа: Ca 2+ ,Sr 2+ ,Ba 2+
При действии группового реагента (водного раствора серной кислоты ^SO.j) катионы третьей аналитической группы осаждаются в виде малорастворимых в воде сульфатов кальция CaSO4,стронцияSrSO4 и бария BaSO4 (свинец осаждается в виде сульфата PbSO4). Числовые значения произведений растворимости этих сульфатов при комнатной температуре равны: Ks°(CaSO4) = 2,5 10 -5 ,Ks° (SrSO4) = 3,2 10 -7 , Ks°(BaSO4) = 1,110 -10 ,Ks°(PbSO4) = 1,6 10 -8 . При действии группового реагента катионы кальция неполностью осаждаются из водного рас-творавформеосадкасульфата кальция — частьионов Ca 2 + остается в растворе. Для более полного осаждения катионов кальция в форме сульфата кальция при действии группового реагента к анализируемому раствору прибавляют этанол, в присутствии которого растворимость сульфата кальция уменьшается.
Сульфаты кальция, стронция и бария практически нерастворимы в разбавленных кислотах, щелочах. Сульфат бария заметно растворяется в концентрированной серной кислоте с образованием кислой соли Ba(HSO4)2 Сульфат кальция растворим в водном растворе сульфата аммония (NH4)2SO4 с образованием комплекса (NH4)2[Ca(SO4)2]; сульфаты стронция и бария — не растворяются.
Аналитические реакции катиона кальция Ca 2+
Реакция с сульфат-ионами. Катионы кальция образуют с сульфат-ионами SO4 2- белый осадок малорастворимого в воде сульфата кальция, который при медленной кристаллизации выделяется в форме игольчатых кристаллов гипса — дигидрата сульфата кальция-CaSO4*2H2O:
Для увеличения полноты осаждения к раствору прибавляют равный объем этанола — в водно-этанольной среде растворимость сульфата кальция уменьшается по сравнению с растворимостью в чистой воде.
Осадок сульфата кальция нерастворим в кислотах и щелочах, но растворяется в насыщенном водном растворе сульфата аммония с образованием комплекса (NH4)2[Ca(SO4)2]:
что позволяет отделить катионы Ca 2+ от катионов Sr 2+ иBa 2+ .
При нагревании с растворимыми карбонатами, например, с раствором соды Na2CO3, белый осадок сульфата кальция переходит в белый же осадок карбоната кальция:
Карбонат кальция растворим в кислотах, поэтому нагревание CaSO4 с раствором соды с последующим растворением образующегося CaCO3 используют для отделения катионов кальция (вместе с катионами стронция и бария) от других катионов и перевода их в раствор.
Реакцию катионов кальция с сульфат-ионами обычно проводят как микрокристаллоскопическую. Предельное разбавление равно 2,5-10 4 мл/г.
Методика. Каплю раствора хлорида кальция CaCl2 наносят на предметное стекло, прибавляют каплю раствора серной кислоты и слегка упаривают смесь. Под микроскопом наблюдают образовавшиеся игольчатые кристаллы гипса CaSO4•2H2Oв виде красивых сросшихся пучков или звездочек.
Реакция с оксалатом аммония (фармакопейная). Катионы Ca 2+ образуют с оксалатом аммония (NH4)2C2O4 белый кристаллический осадок оксалата кальция CaC2O4:
Реакцию проводят в слабокислой среде (рН = 6-6,5) в присутствии уксусной кислоты, в которой оксалат кальция не растворяется. В конце проведения реакции можно добавить аммиак.
Осадок CaC2O4 нерастворим в растворе аммиака, но растворяется в разбавленных минеральных кислотах с образованием щавелевой кислоты H2C2O4, например:
Открываемый минимум — около 100 мкг, предельное разбавление — 6 10 4 мл/г (подругимданным
Мешают катионы Sr 2+ ,Ba 2+ ,Mg 2+ , дающие аналогичные осадки.
Методика. В пробирку вносят 3 капли раствора CaCl2, прибавляют каплю раствора уксусной кислоты и 3 капли раствора оксалата аммония. Выпадает белый кристаллический осадок оксалата кальция.
Реакция с гексацианоферратом(П) калия. Катионы Ca 2+ образуют с гексацианоферратом(П) калия K4[Fe(CN)6] при нагревании раствора до кипения в присутствии катионов аммония белый кристаллический осадок смешанного гексацианоферрата(П) аммония и кальция Осадок нерастворим в уксусной кислоте.
Открываемый минимум равен 25 мкг, предельное разбавление — 2-10 3 мл/г.
Мешают катионы Ba 2+ и другие катионы, образующие осадки фер-роцианидов.
Методика. В пробирку вносят 3-4 капли насыщенного водного раствора CaCl2, 2-3 капли раствора аммиака. Нагревают раствор до кипения и прибавляют 5-6 капель свежеприготовленного насыщенного раствора K4[Fe(CN)6]. Выпадает белый кристаллический осадок.
Реакция сродизонатом натрия. Катионы Ca 2+ образуют со свежеприготовленным раствором родизоната натрия Na2C6O6 в щелочной среде осадок фиолетового комплекса, состав которого, по-видимому, можно описать формулой Ca2C6O6(OH)2:
Реакция довольно чувствительна: предел обнаружения — 1 мкг, предельное разбавление — 5-10 4 мл/г. Катионы Sr 2+ иBa 2+ не мешают, так как в щелочной среде не образуют осадки с родизонатом натрия.
Реакцию можно проводить капельным методом на фильтровальной бумаге.
Методика. В пробирку вносят 3-4 капли раствора CaCl2,3-4 капли раствора NaOH и
2 капли свежеприготовленного 0,2 % раствора ро-дизоната натрия. Выпадает фиолетовый осадок.
При проведении реакции на фильтровальной бумаге поступают следующим образом. На лист фильтровальной бумаги наносят каплю щелочного раствора CaCl2 и каплю свежеприготовленного 0,2 % раствора Na2C6O6 Образуется пятно (или осадок) фиолетового цвета.
Окрашивание пламени газовой горелки (фармакопейный тест). Соли (или другие соединения) кальция окрашивают пламя газовой горелки в кирпично-красный цвет.
Методика. На кончике платиновой или нихромовой проволоки, смоченной раствором HCl, вносят в пламя газовой горелки несколько кристалликов соли кальция или каплю раствора CaCl2 Пламя окрашивается в кирпично-красный цвет.
Другие реакции катионов кальция. Катионы Ca 2+ образуют также осадки при реакциях в растворах: с растворимыми карбонатами — белый осадок CaCO3 (растворяется в кислотах), с гидрофосфатом натрия
Na2HPO4 — белый CaHPO4 (растворяется в кислотах), с хроматами — желтый CaCrO4, с фторидами — белый студенистый CaF2 (малорастворимый в кислотах и разлагающийся при нагревании с концентрированной серной кислотой).
Аналитические реакции катиона стронция Sr 2+
Реакция с сульфат-ионами. Катионы Sr 2+ образуют с сульфат-ионами белый осадок сульфата стронция SrSO4:
Осадок нерастворим в щелочах, в растворе сульфата аммония (NH4)2SO4 (в отличие от сульфата кальция, который растворяется в этом реагенте).
Осадок сульфата стронция образуется и при прибавлении «гипсовой воды» (насыщенный водный раствор сульфата кальция) к растворам, содержащим соли стронция, поскольку растворимость в воде сульфата стронция ниже растворимости сульфата кальция. Добавление «гипсовой воды» приводит к образованию осадка SrSO4 лишь при нагревании; без нагревания осадок SrSO4 выделяется только при длительном стоянии. Мешают катионы Ba 2+ .
При нагревании осадка SrSO4 с раствором соды он, как и сульфат кальция, переходит в карбонат стронция SrCO3, также нерастворимый в кислотах.
а) Реакция с «гипсовой водой». В пробирку вносят 4 капли раствора хлорида стронция SrCl2, прибавляют 5-6 капель «гипсовой воды», нагревают на водяной бане и оставляют на
10-15 минут. Постепенно выделяется белый осадок сульфата стронция.
б) Реакция с серной кислотой. В пробирку вносят 1-2 капли раствора SrCl2, прибавляют 2-3 капли раствора серной кислоты. Выпадает белый кристаллический осадок сульфата стронция.
Реакция с карбонат-ионами. Катионы Sr 2+ образуют при нагревании с карбонат-ионами CO3 2- белый кристаллический осадок карбоната стронция:
Осадок растворяется в кислотах.
Методика. В пробирку вносят 3-5 капель раствора SrCl2,прибавля-ют столько же капель раствора карбоната аммония (NH4)2CO3 иосто-рожно нагревают пробирку с раствором. Выпадает белый осадок карбоната стронция.
Реакция с родизонатом натрия. Катионы Sr 2+ образуют с родизона-том натрия Na2C6O6 в нейтральной среде бурый осадок родизоната стронция, по-видимому, состава SrC6O6:
Реакцию проводят капельным методом на фильтровальной бумаге. Предел обнаружения — 7 мкг.
Катионы бария также образуют бурый осадок с родизонатом натрия. Однако родизонат стронция, в отличие от родизоната бария, растворим в хлороводородной кислоте, тогда как родизонат бария при взаимодействии с HO превращается в ярко-красный гидрородизонат бария.
Методика. На лист фильтровальной бумаги наносят каплю раствора SrCl2 и каплю свежеприготовленного 0,2 % раствора родизоната натрия. Наблюдается образование красно-бурого пятна.
На пятно наносят каплю раствора HO. Окраска пятна исчезает (в присутствии катионов бария окраска не исчезает, а переходит из бурой в ярко-красную).
Окрашивание пламени газовой горелки. Соли (и другие соединения) стронция при внесении в бесцветное пламя газовой горелки окрашивают пламя в карминово-красный цвет. Методика аналогична описанной выше для теста на другие катионы.
Другие реакции катионов стронция. Катионы Sr 2+ образуют также осадки при реакциях в растворах: c оксалатом аммония (NH4)2C2O4 — белый SrC2O4 (частично растворяется в уксусной кислоте), с гидрофосфатом натрия Na2HPO4 — белый SrHPO4 (растворяется в кислотах), с хроматом калия K2CrO4 — желтый SrCrO4 (растворяется в уксусной кислоте; реакция высокочувствительна: предел обнаружения — 0,8 мкг).
Применяют также довольно чувствительную (предельное разбавление — 10 4 мл/г) микрокристаллоскопическую реакцию образования сине-зеленых кубических кристаллов K2Sr[Cu(NO2)6].
Аналитические реакции катионов бария Ba 2+
Катионы бария Ba 2+ образуют с сульфат-ионами белый кристаллический осадок сульфата бария BaSO4:
Осадок нерастворим в щелочах и кислотах, за исключением концентрированной серной кислоты, в которой он заметно растворяется с образованием гидросульфата бария Ba(HSO4)2:
При нагревании с растворами карбонатов (например, соды Na2CO3) сульфат бария превращается в малорастворимый в воде карбонат бария BaCO3, который растворяется в кислотах.
Предел обнаружения каионов бария данной реакцией составляет 10 мкг. Мешают катионы Ca 2+ ,Sr 2+ ,Pb 2+ .
Методика. В пробирку вносят 2-3 капли раствора BaCl2,прибавля-ют по каплям раствор H2SO4 Выпадает белый мелкокристаллический осадок сульфата бария.
Реакция с дихромат-ионами. Катионы Ba 2+ образуют с дихромат-ионами Cr2O7 2- в присутствии ацетат-ионов желтый осадок хромата бария BaCrO4:
Образование хромата бария BaCrO4, а не дихромата BaCr2O7,вэтой реакции объясняется тем, что хромат бария менее растворим в воде, чем дихромат бария.
В водных растворах дихроматов устанавливается равновесие
В присутствии катионов Ba 2+ образуется и выпадает в осадок малорастворимый хромат BaCrO4,тогда как дихроматBa2Cr2O7 в осадок не выпадает вследствие его более высокой растворимости. В результате равновесие смещается вправо, и в растворе накапливаются ионы водорода, что, однако, препятствует более глубокому смещению равновесия. Поэтому для нейтрализации ионов водорода в раствор вводят ацетат натрия CH3COONa. Ацетат-ионы CH3COO — , образующиеся при электролитической диссоциации ацетата натрия, связывают ионы водорода в малодиссоциированную слабую уксусную кислоту CH3COOH, вследствие чего равновесие образования хромат-ионов из дихромат-ионов смещается вправо. При этом возрастает полнота осаждения хромата бария.
Осадок хромата бария растворяется в сильных кислотах, но не растворяется в уксусной кислоте.
Мешают Ag + ,Pb 2+ ,Cd 2+ ,Co 2+ ,Ni 2+ и другие катионы, дающие осадки хроматов. Катионы Ca 2+ ,Sr 2+ не мешают открытию катионов бария.
Методика. В пробирку вносят 5 капель раствора BaCl2, прибавляют 5 капель раствора дихромата калия K2Cr2O7 и 4-5 капель раствора ацетата натрия CH3COONa. Выпадает желтый кристаллический осадок хромата бария.
Хромат бария образуется также при реакции катионов Ba 2+ с хромат-ионами:
Однако при реакции с дихромат-ионами в присутствии ацетат-ионов катионы бария осаждаются практически количественно.
Реакция с родизонатом натрия. Катионы Ba 2+ реагируют с родизона-том натрия Na2C6O6 в нейтральной среде с образованием красно-бурого осадка родизоната бария:
При прибавлении раствора хлороводородной кислоты красно-бурый осадок родизоната бария превращается в ярко-красный гидроро-дизонат бария Ba (HC6O6)2.
Предел обнаружения — 0,25 мкг. Мешают катионы Pb 2+ .
Реакцию проводят капельным методом на фильтровальной бумаге. Методика аналогична описанной для реакции катионов стронция с родизонатом натрия.
Окрашивание пламени газовой горелки. Соли и другие соединения бария окрашивают пламя газовой горелки в желто-зеленый цвет. Методика — такая же, как и в других вышеописанных случаях.
Другие реакции катионов бария. Катионы Ba 2+ образуют также осадки при реакциях: с растворимыми оксалатами — белый BaC2O4 (растворяется в HCl, HNO3, при нагревании — также и в CH3COOH); с гидрофосфатом натрия Na2HPO4 — белый BaHPO4 (растворяется в кислотах); с растворимыми карбонатами — белый BaCO3 (растворяется в кислотах); с сульфитами — белый BaSO3 (растворяется в кислотах).
Катионы Ba 2+ образуют окрашенные комплексы с некоторыми органическими реагентами, например, с 8-оксихинолином (желто-зеленый), с сульфоназом III (сине-зеленый) и др.
Видео:Реакция Хлорида Кальция - CaCl2, Хлорида Аммония и Гексацианоферата(2) Калия - K4[Fe(CN)6]Скачать
![Реакция Хлорида Кальция - CaCl2, Хлорида Аммония и Гексацианоферата(2) Калия - K4[Fe(CN)6]](https://i.ytimg.com/vi/Z3ofQDq16JE/0.jpg)
Хлорид кальция: способы получения и химические свойства
Хлорид кальция CaCl2 — соль щелочноземельного металла кальция и хлороводородной кислоты. Белый, плавится без разложения. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 110,98; относительная плотность для тв. и ж. состояния d = 2,51; tпл = 782º C; tкип = 1960º C;
Видео:хлорид кальция ; электролизСкачать
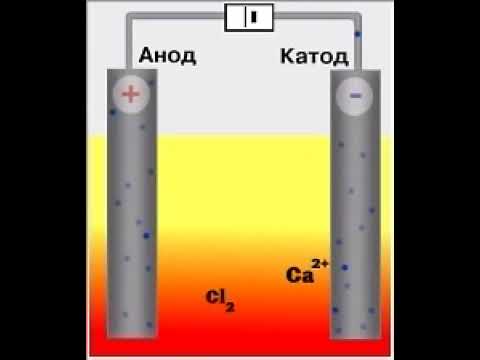
Способ получения
1. Хлорид кальция можно получить путем взаимодействия кальция и хлора :
2. В результате взаимодействия карбоната кальция и соляной кислоты образуется хлорид кальция, углекислый газ и вода:
Видео:NH3 + HCl = NH4Cl | Получение хлорида аммонияСкачать

Качественная реакция
Качественная реакция на хлорид кальция — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид кальция образует нитрат кальция и осадок хлорид серебра:
Видео:Получение ОКСИДА КАЛЬЦИЯ. Разложение КАРБОНАТА КАЛЬЦИЯ ( МЕЛА). Реакция с водой. Опыты по химииСкачать

Химические свойства
1. Хлорид кальция реагирует с простыми веществами:
1.1. В результате реакции между хлоридом кальция и водородом при 600 — 700º С и катализаторах Pt, Fe, Ni образуется гидрид кальция и соляная кислота:
1.2. Хлорид кальция взаимодействует с алюминием при 600 — 700º С и образует на выходе кальций и хлорид алюминия:
3CaCl2 + 2Al = 3Ca + 2AlCl3
2. Хлорид кальция вступает в реакцию со многими сложными веществами :
2.1. Хлорид кальция вступает в реакции с основаниями :
2.1.1. Хлорид кальция взаимодействует с концентрированным раствором гидроксида натрия . При этом образуются гидроксид кальция и хлорид натрия:
CaCl2 + 2NaOH = Ca(OH)2↓ + 2NaCl
2.2. Хлорид кальция реагирует с кислотами:
2.2.1. Твердый хлорид кальция реагирует с концентрированной серной кислотой при кипении , образуя сульфат кальция и газ хлороводород :
2.3. Хлорид кальция вступает в взаимодействие с солями:
2.3.1. В результате реакции между хлоридом кальция и карбонатом натрия образуется карбонат кальция и хлорид натрия:
2.3.2. Хлорид кальция реагирует с фторидом аммония и образует фторид кальция и хлорид аммония:
2.3.3. Хлорид кальция может реагировать с сульфатом калия при 800º С с образованием сульфата кальция и хлорида калия:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Осаждение солей оксалатом аммония
Видео:Термическое разложение хлорида аммония NH4ClСкачать

Уравнения реакции осаждения кристаллогидрата нитрата стронция
Задача 115.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество Sr(NO3)2 . 4Н2О, навеска массой 1,20г; осадитель (NH4)2C2O4, концентрация 7%М.
Решение:
Уравнение реакции осаждения:
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то n1 = n2.
Согласно закону равенства эквивалентов:
Теперь рассчитаем объём раствора (NH4)2C2O4, теоретически необходимый для осаждения 1,20г Sr(NO3)2 . 4Н2О из пропорции:
100 : 7 = х : 0,52;
х = (0,52 . 100)/7 = 7,5см 3 .
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём (NH4)2C2O4, необходимый для осаждения:
Условия осаждения:
Определение осложняется тем, что SrC2O4 склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- при осаждении SrC2O4 к раствору добавляют небольшое количество НСl, что повышает растворимость осадка;
- повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Уравнения реакции осаждения кристаллогидрата хлорида кальция
Задача 116.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество CaCl2 . 6Н2О, навеска массой 0,85г; осадитель (NH4)2C2O4, концентрация 5%.
Решение:
Уравнение реакции осаждения:
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то n1 = n2.
Согласно закону равенства эквивалентов:х :
Теперь рассчитаем объём раствора (NH4)2C2O4, теоретически необходимый для осаждения 0,85г из пропорции:
100 : 5 = х : 0,48;
х = (0,48 . 100)/5 = 9,6см 3 .
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём (NH4)2C2O4, необходимый для осаждения:
Условия осаждения: Определение осложняется тем, что CaC2O4 склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
📹 Видео
Уроки химии с БСК. Урок №2. Хлорид кальцияСкачать

Получение хлорида аммонияСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

хлорид аммония с гидроксидомСкачать

Реакция Дихромата Аммония И Щавелевой Кислоты. Реакция (NH4)2Cr2O7 и H2C2O4Скачать

Качественная реакция на хлорид, бромид, йодид ион.Скачать

Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать

Получение хлората калия, бертолетовой соли из отбеливателя (химия)Скачать

Качественные реакции на ион аммонияСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Получение хлорида аммонияСкачать

Кальция хлорид ампулы - показания, видео инструкция, описание, отзывыСкачать

Триоксалатаферрат(3) Натрия - Na3[Fe(C2O4)3]. Реакция Оксалата Натрия и Оксалата Железа(3).Скачать
![Триоксалатаферрат(3) Натрия - Na3[Fe(C2O4)3]. Реакция Оксалата Натрия и Оксалата Железа(3).](https://i.ytimg.com/vi/5GbvZEAj4f4/0.jpg)
Хлористыи кальции (или хлорид кальция). Зачем нам он в сыроделие.Скачать