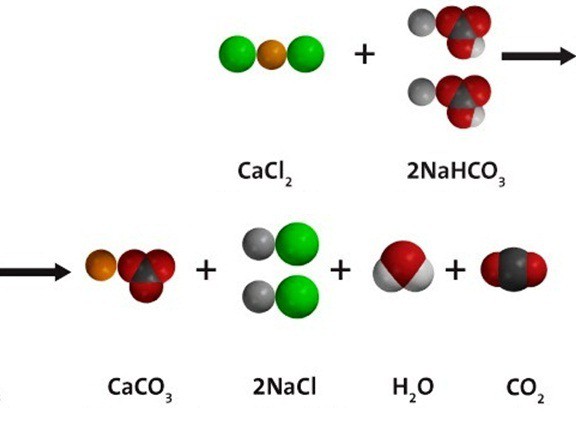
Своеобразным усовершенствованием метода, включающего в себя применение карбоната натрия и гидрокарбоната натрия, стало использование смеси хлорида кальция и гидрокарбоната натрия (см. например, Brockmann & Nilsen, 1995; Balling, 2002). Данная смесь имеет неоспоримое преимущество, поскольку дополнительно с увеличением буферной способности аквариумной воды она способствует повышению концентрации кальция и, таким образом, особенно подходит для аквариумов с кораллами. Смесь, как уже говорилось, состоит из хлорида кальция (СаСl2) и гидрокарбоната натрия (NaHCO3). Из каждой соли производится исходный раствор на основе пресной воды, а затем в аквариум добавляется необходимое количество каждого раствора. Для изготовления исходного раствора хлорида кальция в один литр воды добавляют 73,5 гр дигидрата хлорида кальция (продается в аптеках или в зоомагазинах), а для составления исходного раствора гидрокарбоната натрия на литр воды добавляют 84 гр гидрокарбоната натрия. Очень важно подготавливать растворы в раздельных ёмкостях. Только в этом случае они будут стабильными, и можно приготовить большое количество обоих растворов про запас. Если же смешивать растворы в одном сосуде, то со временем там образуется известь (СаСО3), которая для наших целей бесполезна. Разумеется, эти растворы нельзя добавлять в аквариум «на глазок». Сначала следует определить карбонатную жёсткость и содержание кальция и только потом уже вносить соответствующее количество солей. Проиллюстрирую это положение на коротком примере.
При растворении хлорида кальция (СаСl2) и гидрокарбоната натрия (NaHCO3) в воде происходит следующая реакция.
Перед нами 200-литровый аквариум. В природной морской воде концентрация кальция составляет 420 мг/лг в нашем же аквариуме она упала до 390 мг/л. Сколько миллилитров каждого из исходных растворов нужно добавить, чтобы компенсировать образовавшийся дефицит? В этом аквариуме нам нужны 30 мг кальция на один литр аквариумной воды (420 мг/л — 390 мг/л = 30 мг) или 6000 мг (= 6 гр) на 200 литров (30×200 = 6000 мг). В одном литре исходного раствора хлорида кальция содержится 73,5 гр дигидрата хлорида кальция. Это соответствует 20,04 гр кальция на литр или 20,04 мг кальция на миллилитр. Здесь мы не будем пересчитывать, какая доля в хлориде кальция приходится именно на кальций: заинтересованный читатель узнает об этом больше из статьи Баллинга (Balling, 2002). Важно одно — в исходном растворе, содержащем 73,5 гр дигидрата хлорида кальция, концентрация кальция всегда равна 20,04 гр на один литр. Остальные весовые доли приходятся на хлорид и воду, присоединённую к кристаллам хлорида кальция. Чтобы внести в аквариум 6000 мг кальция, нам понадобится 299 мл основного раствора хлорида кальция (6000:20,04 = 299 мл). Подобные математические действия проводятся и при других концентрациях кальция в воде.
При первой дозировке растворов поступают так: определяется концентрация кальция и значение карбонатной жёсткости, рассчитывается необходимое количество кальция и медленно (!) добавляется соответствующее количество обоих растворов, пока не будут достигнуты требуемые параметры (концентрация кальция 420 мг/л, КН = 7-10 °КН). Очень важно, чтобы в аквариум попали равные объёмы обоих растворов. Только так вы гарантируете, что кальций и гидрокарбонат распределятся по аквариуму 8 равных объёмах, что, в свою очередь, очень важно для химии морской воды и синтеза кальция.
Во время первого добавления растворов карбонатная жёсткость определяется несколько раз. чтобы её значение не перешагнуло отметку 10°КН. Кроме того, следует вливать каждый раствор в разных местах аквариума, в которых, однако, присутствует сильное течение, способствующее быстрому и равномерному распределению жидкостей. При одновременном внесении растворов в одном месте может образоваться известь, которая непригодна ни для увеличения карбонатной жёсткости, ни для повышения концентрации кальция. Спустя 2-3 дня карбонатная жёсткость и содержание кальция замеряются заново, и по результатам тестов вносится соответствующее количество растворов. Ещё через 2-3 дня процедуру нужно повторить. Таким образом, очень скоро вы установите, какое количество кальция и гидрокарбоната потребляют ваши животные и, соответственно, какой объём обоих исходных растворов требуется заливать в аквариум. Владея данной информацией, можно увеличить интервалы замеров (например, каждые 2 или 4 недели), чтобы впоследствии оптимизировать процесс дозирования.
К сожалению, у этого метода есть свои негативные стороны. Если внимательнее рассмотреть уравнение реакции, то выяснится, что в растворе большая доля приходится на поваренную соль (NaCl), а именно — примерно 2,9 гр NaCl на 1 гр кальция. Однако, в отличие от кальция и карбонатов, поваренная соль животными не используется и медленно накапливается в аквариумной воде. Это приводит, с одной стороны, к повышению плотности, а с другой стороны, к смещению ионного равновесия в сторону натрия и хлорида. Повышение плотности можно компенсировать частичными подменами морской воды. А вот со смещением ионного равновесия, которое ещё не изучено наукой и потому может быть связано с некоторыми рисками, всё не так просто. Впрочем, сегодня в продаже имеются соли, не содержащие хлорида натрия, которые вкупе с частичными подменами воды противодействуют этому смещению. При использовании такого рода солей необходимо следовать рекомендациям производителя.
- Внесение хлорида кальция и гидрокарбоната натрия: о главном — коротко
- Хлорид кальция: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Гидрокарбонат натрия: формула, состав, применение
- Отличие кислой соли от средней
- Физические свойства пищевой соды
- Безопасность пищевой соды для человека
- Гидрокарбонат натрия: формула соединения
- Строение вещества
- Растворимость питьевой соды в воде
- Реакция обмена с другими солями
- Взаимодействие питьевой соды с кислотами
- Получение пищевой соды
- Где используется гидрокарбонат натрия? Применение пищевой соды в медицине
- Использование пищевой соды в быту
- 🔥 Видео
Видео:Взаимодействие карбоната натрия с растворами хлорида кальция и уксусной кислотыСкачать

Внесение хлорида кальция и гидрокарбоната натрия: о главном — коротко
Функция: дозировка кальция и карбонатов.
Сфера применения: аквариумы с кораллами.
Регулярные работы:
- регулярное добавление растворов в зависимости от объёма потребления животными кальция и карбонатов;
- регулярное определение концентрации кальция и карбонатной жёсткости.
Что делать, если концентрация кальция в аквариуме очень низкая?
Увеличьте количество растворов хлорида кальция и гидрокарбоната натрия.
Что делать, если концентрация кальция очень высокая?
При использовании смеси хлорида кальция и гидрокарбоната натрия такое возможно только вследствие передозировки этих веществ. Прекратите добавлять растворы до тех пор, пока содержание кальция не опустится до уровня 420 мг/л, а карбонатная жёсткость — до 7-10°КН. Как только оба показателя начнут стабильно снижаться, можно осторожно вносить растворы. Регулярно измеряйте карбонатную жёсткость и концентрацию кальция, чтобы избежать ошибок при дозировке.
Видео:Самый *ПРОСТОЙ* способ ПОЛУЧИТЬ ГИДРОКСИД КАЛИЯСкачать

Хлорид кальция: способы получения и химические свойства
Хлорид кальция CaCl2 — соль щелочноземельного металла кальция и хлороводородной кислоты. Белый, плавится без разложения. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 110,98; относительная плотность для тв. и ж. состояния d = 2,51; tпл = 782º C; tкип = 1960º C;
Видео:Реакция хлорида кальция с серной кислотойСкачать

Способ получения
1. Хлорид кальция можно получить путем взаимодействия кальция и хлора :
2. В результате взаимодействия карбоната кальция и соляной кислоты образуется хлорид кальция, углекислый газ и вода:
Видео:Карбонат натрия из пищевой содыСкачать

Качественная реакция
Качественная реакция на хлорид кальция — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид кальция образует нитрат кальция и осадок хлорид серебра:
Видео:Опыты по химии. Разложение гидрокарбоната натрия при нагреванииСкачать

Химические свойства
1. Хлорид кальция реагирует с простыми веществами:
1.1. В результате реакции между хлоридом кальция и водородом при 600 — 700º С и катализаторах Pt, Fe, Ni образуется гидрид кальция и соляная кислота:
1.2. Хлорид кальция взаимодействует с алюминием при 600 — 700º С и образует на выходе кальций и хлорид алюминия:
3CaCl2 + 2Al = 3Ca + 2AlCl3
2. Хлорид кальция вступает в реакцию со многими сложными веществами :
2.1. Хлорид кальция вступает в реакции с основаниями :
2.1.1. Хлорид кальция взаимодействует с концентрированным раствором гидроксида натрия . При этом образуются гидроксид кальция и хлорид натрия:
CaCl2 + 2NaOH = Ca(OH)2↓ + 2NaCl
2.2. Хлорид кальция реагирует с кислотами:
2.2.1. Твердый хлорид кальция реагирует с концентрированной серной кислотой при кипении , образуя сульфат кальция и газ хлороводород :
2.3. Хлорид кальция вступает в взаимодействие с солями:
2.3.1. В результате реакции между хлоридом кальция и карбонатом натрия образуется карбонат кальция и хлорид натрия:
2.3.2. Хлорид кальция реагирует с фторидом аммония и образует фторид кальция и хлорид аммония:
2.3.3. Хлорид кальция может реагировать с сульфатом калия при 800º С с образованием сульфата кальция и хлорида калия:
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Гидрокарбонат натрия: формула, состав, применение
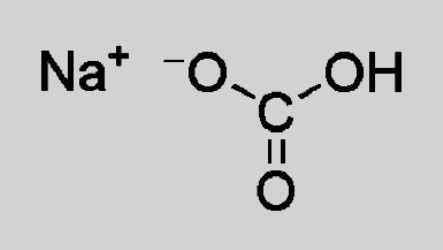
Пищевая, или питьевая сода, — широко известное в медицине, кулинарии и бытовом потреблении соединение. Это кислая соль, молекула которой образована положительно заряженными ионами натрия и водорода, анионом кислотного остатка угольной кислоты. Химическое название соды — бикарбонат или гидрокарбонат натрия. Формула соединения по системе Хилла: CHNaO3 (брутто-формула).
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Отличие кислой соли от средней
Угольная кислота образуют две группы солей — карбонаты (средние) и гидрокарбонаты (кислые). Тривиальное название карбонатов — соды — появилось еще в древности. Следует различать среднюю и кислую соли по названиям, формулам и свойствам.
Na2CO3 — карбонат натрия, динатриевая соль угольной кислоты, кальцинированная стиральная сода. Служит сырьем для получения стекла, бумаги, мыла, используется как моющее средство.
NaHCO3 — натрия гидрокарбонат. Состав подсказывает, что вещество является мононатриевой солью угольной кислоты. Это соединение отличается наличием двух разных положительных ионов — Na + и Н + . Внешне кристаллические белые вещества похожи, их трудно отличить друг от друга.
Вещество NaHCO3 считается питьевой содой не потому, что употребляется внутрь для утоления жажды. Хотя с помощью этого вещества можно приготовить шипучий напиток. Раствор этого гидрокарбоната принимают внутрь при повышенной кислотности желудочного сока. При этом происходит нейтрализация избытка протонов Н + , которые раздражают стенки желудка, вызывают боль и жжение.
Видео:Реакция Хлорида Кальция - CaCl2, Хлорида Аммония и Гексацианоферата(2) Калия - K4[Fe(CN)6]Скачать
![Реакция Хлорида Кальция - CaCl2, Хлорида Аммония и Гексацианоферата(2) Калия - K4[Fe(CN)6]](https://i.ytimg.com/vi/Z3ofQDq16JE/0.jpg)
Физические свойства пищевой соды
Бикарбонат — это белые моноклинные кристаллы. В составе этого соединения присутствуют атомы натрия (Na), водорода (Н), углерода (С) и кислорода. Плотность вещества составляет 2,16 г/см3. Температура плавления — 50–60 °С. Натрия гидрокарбонат — порошок молочно-белого цвета — твердое мелкокристаллическое соединение, растворимое в воде. Питьевая сода не горит, а при нагревании свыше 70 °С разлагается на карбонат натрия, углекислый газ и воду. В производственных условиях чаще применяется гранулированный бикарбонат.
Видео:хлорид бария + сульфат натрияСкачать

Безопасность пищевой соды для человека
Соединение не обладает запахом, его вкус — горько-соленый. Однако не рекомендуется нюхать и пробовать вещество на вкус. Вдыхание гидрокарбоната натрия может вызвать чихание и кашель. Одно из применений основано на способности пищевой соды нейтрализовать пахнущие вещества. Порошком можно обработать спортивную обувь, чтобы избавиться от неприятного запаха.
Питьевая сода (гидрокарбонат натрия) — безвредное вещество при контакте с кожей, но в твердом виде может вызвать раздражение слизистой оболочки глаз и пищевода. В низких концентрациях раствор не токсичен, его можно принимать внутрь.
Видео:Распознавание растворов хлорида натрия, карбоната натрия и сульфата натрияСкачать

Гидрокарбонат натрия: формула соединения
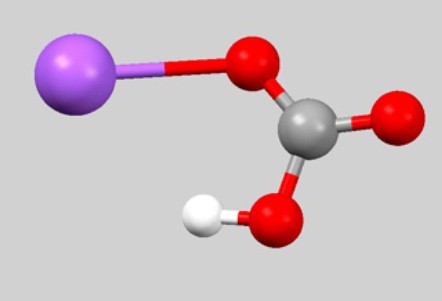
Брутто-формула CHNaO3 редко встречается в уравнениях химических реакций. Дело в том, что она не отображает связь между частицами, которые образуют гидрокарбонат натрия. Формула, обычно используемая для характеристики физических и химических свойств вещества, — NaHCO3. Взаимное расположение атомов отражает шаро-стержневая модель молекулы:
Если узнать из периодической системы значения атомных масс натрия, кислорода, углерода и водорода. то можно подсчитать молярную массу вещества гидрокарбонат натрия (формула NaHCO3):
Ar(Na) — 23;
Ar(O) — 16;
Ar(C) — 12;
Ar(H) — 1;
М (CHNaO3) = 84 г/моль.
Видео:Взаимопревращение карбонатов и гидрокарбонатовСкачать

Строение вещества
Гидрокарбонат натрия — ионное соединение. В состав кристаллической решетки входит катион натрия Na + , замещающий в угольной кислоте один атом водорода. Состав и заряд аниона — НСО3 – . При растворении происходит частичная диссоциация на ионы, которые образуют гидрокарбонат натрия. Формула, отражающая структурные особенности, выглядит так:
Видео:Опыты по химии. Разложение карбоната кальция при нагреванииСкачать

Растворимость питьевой соды в воде
В 100 г воды растворяется 7,8 г гидрокарбоната натрия. Вещество подвергается гидролизу:
NaHCO3 = Na + + НСО3 – ;
Н2О ↔ Н + + ОН – ;
НСО3 – + Н + = Н2О + СО2↑.
При суммировании уравнений выясняется, что в растворе накапливают гидроксид-ионы (слабощелочная реакция). Жидкость окрашивает фенолфталеин в розовый цвет. Окраска универсальных индикаторов в виде бумажных полосок в растворе соды меняется с желто-оранжевой на серую или синюю.
Видео:Получение ОКСИДА КАЛЬЦИЯ. Разложение КАРБОНАТА КАЛЬЦИЯ ( МЕЛА). Реакция с водой. Опыты по химииСкачать

Реакция обмена с другими солями
Водный раствор гидрокарбоната натрия вступает в реакции ионного обмена с другими солями при условии, что одно из вновь получившихся веществ — нерастворимое; либо образуется газ, который удаляется из сферы реакции. При взаимодействии с хлоридом кальция, как показано на схеме ниже по тексту, получается и белый осадок сарбоната кальция, и углекислый газ. В растворе остаются ионы натрия и хлора. Молекулярное уравнение реакции:
Видео:Растворение хлорида кальция в изопропанолеСкачать

Взаимодействие питьевой соды с кислотами
Гидрокарбонат натрия взаимодействует с кислотами. Реакция ионного обмена сопровождается образованием соли и слабой угольной кислоты. В момент получения она разлагается на воду и углекислый газ (улетучивается).
Стенки желудка человека вырабатывают соляную кислоту, существующую в виде ионов
Н + и Cl – . Если принимать внутрь натрия гидрокарбонат, реакции происходят в растворе желудочного сока с участием ионов:
NaHCO3 = Na + + НСО3 – ;
HCl = Н + + Cl – ;
Н2О ↔ Н+ + ОН – ;
НСО3 – + Н + = Н2О + СО2↑.
Врачи не рекомендуют постоянно использовать при повышенной кислотности желудка гидрокарбонат натрия. Инструкция к препаратам перечисляет различные побочные действия ежедневного и длительного приема питьевой соды:
- повышение давления крови;
- отрыжка, тошнота и рвота;
- тревожность, плохой сон;
- снижение аппетита;
- боли в животе.
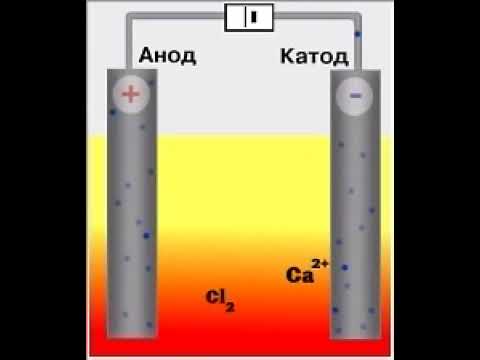
Видео:хлорид кальция ; электролизСкачать
Получение пищевой соды
В лаборатории бикарбонат натрия можно получить из кальцинированной соды. Такой же метод применялся раньше в химическом производстве. Современный промышленный способ основан на взаимодействии аммиака с углекислым газом и слабой растворимости питьевой соды в холодной воде. Через раствор хлорида натрия пропускают аммиак и диоксид углерода (углекислый газ). Образуются хлорид аммония и раствор гидрокарбоната натрия. При охлаждении растворимость питьевой соды понижается, тогда вещество легко отделяется с помощью фильтрования.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Где используется гидрокарбонат натрия? Применение пищевой соды в медицине
Многим известно, что атомы металлического натрия энергично взаимодействуют с водой, даже ее парами в воздухе. Реакция начинается активно и сопровождается выделением большого количества теплоты (горением). В отличие от атомов, ионы натрия — стабильные частицы, не наносящие вреда живому организму. Наоборот, они принимают активное участие в регуляции его функций.
Как используется неядовитое для человека и полезное во многих отношениях вещество — гидрокарбонат натрия? Применение основано на физических и химических свойствах питьевой соды. Важнейшие направления — бытовое потребление, пищевая промышленность, здравоохранение, народная медицина, получение напитков.
Среди основных свойств бикарбоната натрия — нейтрализация повышенной кислотности желудочного сока, кратковременное устранение болевого синдрома при гиперацидности желудочного сока, язвенной болезни желудка и 12-перстной кишки. Антисептическое действие раствора питьевой соды применяется при лечении боли в горле, кашля, интоксикации, морской болезни. Промывают им полости рта и носа, слизистые оболочки глаз.
Широко используются разные лекарственные формы бикарбоната натрия, например порошки, которые растворяют и применяют для инфузий. Назначают растворы для приема пациентами внутрь, промывают ожоги кислотами. Для изготовления таблеток и ректальных суппозиториев также используется гидрокарбонат натрия. Инструкция к препаратам содержит подробное описание фармакологического действия, показаний. Список противопоказаний очень короткий — индивидуальная непереносимость вещества.
Видео:ВСЕГО ОДНО ОПРЫСКИВАНИЕ ТОМАТОВ И ВЕРШИННОЙ ГНИЛИ НА ПОМИДОРАХ НЕ БУДЕТ. Кальция хлорид для помидорСкачать

Использование пищевой соды в быту
Гидрокарбонат натрия — это «скорая помощь» при изжоге и отравлении. С помощью питьевой соды в домашних условиях отбеливают зубы, уменьшают воспаление при угревой болезни, протирают кожу для удаления избытка жирного секрета. Бикарбонат натрия смягчает воду, помогает очистить загрязнения с разных поверхностей.
При ручной стирке вещей из шерстяного трикотажа можно добавить в воду питьевую соду. Это вещество освежает цвет ткани и удаляет запах пота. Нередко при глажении изделий из шелка появляются желтые подпалины от утюга. В таком случае поможет кашица из питьевой соды и воды. Вещества надо как можно быстрее смешать и нанести на пятно. Когда кашица подсохнет, ее следует почистить щеткой, а изделие прополоскать в холодной воде.
В реакции с уксусной кислотой получается ацетат натрия и бурно выделяется углекислый газ, вспенивающий всю массу: NaHCO3 + СН3СООН = Na + + СН3СОО – + Н2О + СО2↑. Этот процесс идет всякий раз, когда при изготовлении шипучих напитков и кондитерских изделий питьевую соду «гасят» уксусом.
Вкус выпечки будет нежнее, если использовать не магазинный синтетический уксус, а сок лимона. На крайний случай можно заменить его смесью 1/2 ч. л. порошка лимонной кислоты и 1 ст. л. воды. Питьевая сода с кислотой добавляется в тесто в числе последних ингредиентов, чтобы можно было сразу ставить выпечку в духовку. Кроме бикарбоната натрия, иногда в качестве разрыхлителя используется гидрокарбонат аммония.
🔥 Видео
Опыты по химии. Превращение гидрокарбоната кальция в карбонат кипячениемСкачать

Реакция хлорида кальция и альгината натрияСкачать

Реакция Силиката Натрия С Солями. Получение Нерастворимых Силикатов.Скачать