Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
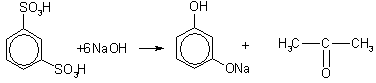
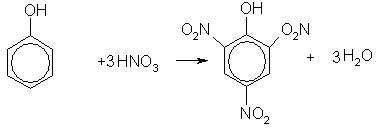
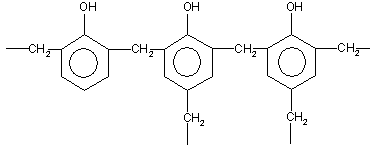
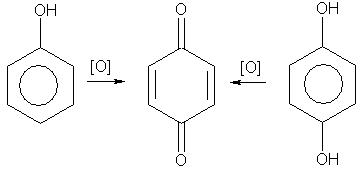
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Уравнение реакции хлорбензола с гидроксидом натрияФенолы – гидроксилпроизводные ароматических углеводородов, в которых группа ОН связана с атомом углерода ароматического ядра. По количеству ароматических ядер в молекуле различают собственно фенолы, а также нафтолы, антролы, фенантролы и др. По числу гидроксильных групп различают одно-, двух-, трех-, многоатомные фенолы. Названия фенолов образуют от названий соответствующих аренов с добавлением суффикса –ол. Простейший фенол – гидроксибензол С6Н5ОН называют просто фенол. При наличии нескольких заместителей начало нумерации определяет гидроксильная группа и эти соединения рассматриваются как производные фенола. Иногда в соединениях сложного строения наличие гидроксильной группы обозначают префиксом гидрокси-. Многие фенолы имеют тривиальные названия. Фенол выделяют из каменноугольной смолы. Существует многочисленные синтетические методы получения фенола, промышленные и лабораторные. 1) Замещение сульфогруппы на гидроксил Наиболее старый промышленный метод получения фенолов заключается в сплавлении щелочных арилсульфонатов с твердым гидроксидом натрия или калия или со сравнительно легкоплавкой смесью этих гидроксидов при 300-350 о С. Для получения самого фенола метод щелочного плавления в настоящее время не используется, но он широко используется для получения 2-нафтола, резорцина, ализарина и других фенолов. 2).Замещение галогена на гидроксил Арилгалогениды, не содержащие активирующих электроноакцепторных заместителей, вступают в реакцию обмена в очень жестких условиях. Фенол получают нагреванием хлорбензола с 15-20%-ным водным раствором гидроксида натрия при 360-390 о С и давлении 280-300 атм. В этих условиях реакция идет по ариновому механизму (см. лек.№24). В присутствии солей меди (II), играющих роль катализатора, ариновый механизм полностью подавляется из-за резкого ускорения прямого замещения галогена по SNAr-механизму. Применение солей меди (II) позволяет проводить региоселективное замещение галогена на гидроксил без примеси какого-либо другого изомерного фенола. Введение в молекулу арилгалогенида электроноакцепторных заместителей в орто— или пара-положения увеличивают скорость обмена галогена на гидроксил в некатализируемой реакции. Для таких реакций предложен SNAr-механизм замещения. 3) Замещение диазогруппы на гидроксил Метод включает диазотирование первичного амина с последующими разложением соли диазония в водном растворе серной кислоты. Замещение диазогруппы на гидроксил протекает по SN1-механизму. Так как промежуточно образующийся арилкатион может реагировать с любым нуклеофилом, имеющимся в реакционной среде, наиболее целесообразно использовать для гидролиза в фенолы гидросульфаты диазония. В качестве побочного продукта при этом образуется эфир ArOSO3H, который легко гидролизуется в фенол. См. также лек. №24 и 43. 4) Получение фенола из гидропероксида кумола Современный промышленный метод получения фенола заключается в кислотно-катализируемом разложении гидропероксида кумола. Исходное вещество для всего цикла превращений — кумол получают алкилированием бензола пропиленом по Фриделю-Крафтсу. Далее кумол окисляют кислородом воздуха при 100-130 о С до гидропероксида кумола. Эта реакция протекает по цепному радикальному механизму с участием кумильного радикала. Разложение гидропероксида кумола до фенола и ацетона проводят в присутствии 1% водной серной кислоты при 50-90 о С. Процесс разложения гидропероксида по своему механизму напоминает перегруппировки карбкатионов. Различие заключается в том, что миграция фенила происходит к положительно заряженному атому кислорода. В целом это очень экономичный способ получения одновременно двух важнейших продуктов — ацетона и фенола. 3. Физические свойства и строение Фенолы – жидкие или кристаллические вещества с сильным характерным запахом. При хранении на воздухе быстро темнеют из-за окисления. Ограниченно растворимы в воде. Гидроксигруппа и ароматическое кольцо образуют сопряженную систему. Гидроксигруппа проявляет электронодонорные свойства за счет +М-эффекта, который превышает по силе –I-эффект. Фенол и его гомологи – полярные соединения. Дипольный момент направлен в сторону бензольного кольца. Взаимодействии неподеленной пары электронов кислорода с p -системой кольца обусловливает электронодонорные свойства этих соединений. Энергия ионизации фенола составляет 8,5-8,6 эВ, что ниже, чем у бензола и спиртов. Введение гидроксильной группы в бензольное кольцо вызывает сдвиг полос поглощения в УФ-спектрах в длинноволновую область и усиливает их: 210 ( e 6200) и 270 ( e 1450) нм. В ИК-спектрах характеристические полосы поглощения валентных колебаний группы ОН лежат в области 3390-3600 см -1 и зависят от растворителя и концентрации. В спектрах ПМР сигнал протонов группы ОН находится в широком диапазоне и зависит от температуры, концентрации, рН и растворителя (в дейтерохлороформе d 4,5-7,5 м.д.) Для фенолов характерны нуклеофильные свойства, которые усиливаются при превращении их в феноксид-анионы в результате ионизации полярной связи О-Н. При этом электрофилы могут реагировать как по атому кислорода, так и по атомам углерода ароматического кольца фенолов или феноксид-анионов. Фенолы являлются слабыми ОН-кислотами, но значительно превосходят по кислотности спирты. Например, фенол в 10 8 раз более сильная ОН-кислота по сравнению с циклогексанолом. Причина более высокой кислотности фенолов состоит в стабилизации феноксид-аниона за счет делокализации отрицательного заряда с участием ароматического кольца. Влияние заместителя в бензольном кольце на кислотность фенолов согласуется с представлениями об их электронных эффектах. Электроноакцепторные заместители, особенно в орто- и пара-положениях, усиливают, а электронодонорные — понижают кислотные свойства фенолов. Величины рКа орто-, мета- и пара-замещенных фенолов в воде при 25 о С Большинство фенолов легко растворяется в водных растворах щелочей МОН с образованием фенолятов ArOM. Получение простых и сложных эфиров фенолов Нуклеофильные свойства атома кислорода фенолов понижены по сравнению со спиртами в результате сопряжения. Как следствие этого ариловые эфиры карбоновых кислот нельзя получать прямой этерификацией фенолов карбоновыми кислотами. Сложные эфиры получают ацилированием фенолов или их Na-и K-солей галогенангидридами или ангидридами кислот. ArOH + RCOX ® RCOOAr + HX ArO — Na + + RCOX ® RCOOAr + NaX Феноляты легко алкилируются , алкилгалогенидами и диалкилсульфатами с образованием простых эфиров. ArO — Na + + RX ® ArOR + NaX Метиловые эфиры фенолов получают также действием диазометана в эфирном растворе. В отличие от спиртов фенолы как более сильные кислоты метилируются диазометаном в отсутствие катализатора. Перегруппировка Кляйзена аллилариловых эфиров Аллиловый эфир фенола при нагревании до 200-220 о С превращается в орто-аллилфенол, т.е. аллильная группа мигрирует в орто-положение бензольного кольца. Если оба орто-положения заняты заместителями, то аллильная группа перемещается в пара-положение: Установлено, что и орто— и пара-перегруппировки являются внутримолекулярными реакциями первого порядка. Миграция в орто-положение сопровождается инверсией аллильной группы, т.е. она присоединяется к бензольному кольцу g -углеродным атомом. Из этого следует, что переходное состояние перегруппировки Кляйзена должно быть циклическим шестизвенным. Такое переходное состояние включает шесть p -электронов и является ароматическим, что составляет движущую силу этой термической перегруппировки. На последней стадии происходит изомеризация циклогексадиенона в о-аллилфенол. Эта стадия аналогична изомеризации кетона в енольную форму. 2,4-Циклогексадиенон является интермедиатом перегруппировки аллилариловых эфиров. Такой интермедиат может быть выделен при перегруппировке аллилового эфира 2,6-диметилфенола, когда аллильная группа мигрирует в пара-положение, поскольку енолизация кетона в фенол в этом случае не может происходить из орто-положения. Конечным результатом двух последовательных миграций аллильной группы является сохранение структуры мигрирующей группы. Кроме того, при проведении перегруппировки в присутствии малеинового ангидрида 2,4-циклогексадиенон улавливается в виде аддукта диенового синтеза. Реакции электрофильного замещения в ароматическом кольце Гидроксильная группа относится к числу групп, активирующих электрофильное замещение в ароматическом кольце и направляющих заместитель в орто— и пара-положения. Фенолы вступают практически во все типичные реакции электрофильного замещения как с сильными, так и со слабыми электрофильными агентами. Галогенирование фенолов не требует катализа кислотами Льюиса и легко осуществляется под действием молекулярного галогена. Галогенирование фенола молекулярным бромом или хлором в полярной среде практически невозможно остановить на стадии моногалогенирования, поскольку реагирующей частицей здесь является фенолят-ион, который содержит очень сильную активирующую группу –O — . Скорость галогенирования фенолят-иона по крайней мере в тысячу раз выше, чем фенола. Галогензамещенный фенол является более сильной кислотой, чем сам фенол, что облегчает введение второго и третьего атома галогена в орто— и пара-положения. Бромирование фенола в воде приводит к образованию нерастворимого 2,4,6-трибромфенола. Эта реакция настолько чувствительна, что позволяет обнаружить фенол в концентрации 10 -5 М в водном растворе. 2,4,6-Трибромфенол взаимодействует еще с одним молем брома с образованием 2,4,4,6-тетрабромциклогекса-2,5-диенона, окрашенного в желтый цвет. При обработке продукта этой реакции раствором гидросульфита натрия или другого слабого восстановителя он легко превращается в исходный 2,4,6-трибромфенол. Аналогичным образом протекает хлорирование фенола хлором в соляной кислоте, но здесь получается значительное количество о-хлорфенола. Моногалогензамещенные производные фенолов удобно получать при галогенировании в неполярной среде, что также исключает диссоциацию фенолов. В качестве галогенирующего агента кроме самих галогенов можно использовать комплексы галогенов с диоксаном, ДМФА. Во всех случаях соотношение пара/орто-изомеров при бромировании и иодировании значительно выше, чем при хлорировании. Нитрование фенолов разбавленной 20-25%-ной азотной кислотой приводит к получению смеси орто- и пара-нитрофенолов. Даже в таких мягких условиях нитрование сопровождается окислением фенола и этот процесс становится доминирующим, если для нитрования использовать концентрированную азотную кислоту. Поэтому для получения 2,4,6-тринитрофенола (пикриновой кислоты) используют видоизмененный способ нитрования. Фенол первоначально сульфируют до 4-гидрокси-1,3-бензолдисульфокислоты, а затем нитруют азотной кислотой. Вторая стадия по существу представляет собой электрофильное ипсо-замещение сульфогруппы на нитрогруппу. Моносульфирование фенола серной кислотой приводит к образованию смеси орто- и пара-изомеров гидроксибензолсульфоксилоты. При 20 о С в реакционной смеси содержится 49% орто-изомера и 51% пара-изомера, тогда как при 120 о С доля пара-изомера возрастает до 96%. Изменение в соотношении продуктов сульфирования обусловлено обратимостью реакций, когда в равновесии преобладает термодинамически более стабильный пара-изомер. Сульфирование в орто-положение протекает с большей скоростью, но орто-гидроксибензолсульфокислота легко гидролизуется на исходные реагенты в отличие от пара-изомера, для которого скорость гидролиза мала. Нитрозирование фенолов осуществляется с помощью азотистой кислоты в воде или уксусной кислоте. Эта реакция отличается очень высокой региоселективностью и замещение идет в пара-положение к гидроксильной группе. Типичное распределение орто— и пара-изомеров при нитрозировании можно проиллюстрировать на примере самого фенола. Алкилирование и ацилирование по Фриделю-Крафтсу Так как фенолы взаимодействуют с галогенидами алюминия и другими кислотами Льюиса с образованием солей типа ArOAlCl2, прямое их алкилирование в условиях реакции Фриделя-Крафтса провести не удается. Фенолы алкилируют алкенами и спиртами в условиях кислотного катализа. В качестве катализаторов предпочитают использовать серную, фтористоводородную, фосфорную кислоты или катиониты КУ-2 и другие катионообменные смолы. Таким образом, из крезола и изобутилена в промышленности получают пространственно затрудненный фенол — 2,6-ди-трет-бутил-4-метилфенол (ионол), который широко применяется для стабилизации полимеров. Аналогично из фенола и изопропилового спирта получается 2,4,6-триизопропилфенол. Ацилирование фенолов в классических условиях реакции Фриделя-Крафтса комплексом ацилгалогенида и хлорида алюминия приводит к неудовлетворительным результатам, так как ацилированию подвергается гидроксильная группа фенола. Более эффективна такая модификация этого метода, когда в качестве ацилирующего агента используется комплекс карбоновой кислоты и трехфтористого бора. Ацильная группа при этом вводится практически исключительно в пара-положение бензольного кольца. Так, например, фенол при взаимодействии с комплексом уксусной кислоты и BF3 дает пара-гидроксиацетофенон с 95%-ным выходом. Наиболее общий метод получения гидроксикетонов ароматического ряда основан на перегруппировке Фриса. Ариловые эфиры карбоновых кислот при нагревании с AlCl3 или AlBr3 перегруппировываются в изомерные орто— и пара-гидроксикетоны. Соотношение орто- и пара-изомеров зависит главным образом от температуры и растворителя. В более жестких условиях преобладает орто-гидроксикетон, а при 20-25 о С — пара-гидроксикетон. Механизм перегруппировки Фриса, по-видимому, заключается в межмолекулярном ацилировании орто- или пара-положения бензольного кольца арилового эфира комплексом второй молекулы сложного эфира и AlCl3 с образованием ацильного производного гидроксикетона и фенола. Перегруппировка завершается межмолекулярным переносом ацильной группы к фенолу. Формилирование – это введение группы СНО (см. лек.35). Синтетически наиболее важными являются формилирование фенолов по Вильсмейеру-Хааку и Реймеру-Тиману. N-Алкиламиды муравьиной кислоты — N,N-диметилформамид (ДМФА) и N-метилформамид в присутствии хлорокиси фосфора являются региоселективными формилирующими агентами. С помощью этих реагентов альдегидная группа вводится в пара-положение по отношению к ОН -группе. Эту реакцию можно также рассматривать как ацилирование, где роль катализатора (кислоты Льюиса) выполняют хлорокись фосфора (POCl3). Наиболее эффективна система ДМФА-POCl3, в которой ДМФА служит и реагентом, и растворителем. Электрофильным агентом в реакции Вильсмейера-Хаака является иминиевая соль, которая образуется при взаимодействии ДМФА и хлорокиси фосфора. Иминиевая соль при необходимости может быть выделена в индивидуальном виде, однако обычно ее не выделяют и используют непосредственно после ее образования. Реакция Вильсмейера-Хаака чрезвычайно проста в экспериментальном отношении и обеспечивает очень высокие выходы ароматических гидроксиальдегидов. Формилирование фенолов по Реймеру-Тиману достигается при нагревании смеси фенола и большого избытка хлороформа с водным раствором гидроксида натрия при 50-70 о С. Выходы альдегидов обычно невелики и редко превышают 30%, однако метод исключительно прост и доступен в практическом отношении. Главное достоинство реакции Реймера-Тимана заключается в преимущественном образовании орто-, а не пара-изомеров, как это имеет место в реакции Вильсмейера-Хаака. Механизм включает образование дихлоркарбена как интермедиата. Дихлоркарбен :CCl2 выполняет роль электрофильного агента по отношению к феноксид-иону, образующемуся в щелочной среде. Предполагаемый механизм реакции Реймера-Тимана может быть представлен следующей последовательностью превращений: Реакция протекает только в сильно щелочной среде при наличии фенольного гидроксила, тогда как простые эфиры фенолов и диалкиланилины не формилируются в этих условиях. Карбоксилирование феноксид-ионов (реакция Кольбе) Будучи сильными нуклеофилами феноксид-анионы способны взаимодействовать с таким слабым электрофильным реагентом как оксид углерода (IV). При нагревании сухих фенолятов натрия или лития с СО2 при повышенном давлении, образуются натриевые или литиевые соли салициловой кислоты. В аналогичных условиях из фенолятов калия, рубидия и цезия получаются только соли пара-гидроксибензойной кислоты. Такое различие в направлении карбоксилирования Na- и К-солей фенола принято объяснять различием в хелатообразовании этих двух катионов с атомом кислорода CO2 в переходном состоянии реакции, приводящем к салициловой кислоте. Катионы натрия и, особенно, лития значительно более эффективны по сравнению с катионом калия в способности к образованию координационной связи с атомом кислорода. Предполагается, что для фенолятов калия, рубидия и цезия электрофильная атака осуществляется исключительно в пара-положение без какой-либо координации катиона по атому кислорода. В отличие от одноатомных фенолов двухатомные и трехатомные фенолы карбоксилируются в более мягких условиях. Так, резорцин карбоксилируется при пропускании СО2 в водный раствор его дикалиевой соли при 50 о С. При этом образуется 2,4-дигидроксибензойная кислота. Конденсация с альдегидами и кетонами Фенолы реагируют с формальдегидом в водном растворе в присутствии основания с образованием полимерного продукта, получившего название феноло-формальдегидной смолы, карболита или бакелита. Взаимодействие феноксид-иона с формальдегидом напоминает альдольную конденсацию с той лишь разницей, что роль нуклеофильного агента вместо енолят-иона выполняет амбидентный феноксид-ион, а карбонильной компонентой является формальдегид. Подобно альдолям, орто— и пара-изомеры гидроксиметилфенола подвергаются дегидратации с образованием хинонметидов — соединений, родственных орто— и пара-хинонам. Последующее присоединение феноксид-иона к хинонметиду представляет собой присоединение амбидентного аниона к a , b -непредельному кетону по Михаэлю. В результате дальнейшей поликонденсации в орто— и пара-положение к гидроксигруппе фенола получается трехмерная структура конечного продукта — бакелита. Бакелит представляет собой прозрачную смолу, в которой линейные звенья связаны «поперечными» связями в пара-положениях. Фенол конденсируется с ацетоном в кислой среде с образованием так называемого бисфенола А. Получено много подобных продуктов конденсации фенолов с кетонами. Они находят применение в качестве антиоксидантов и мономеров для получения эпоксидных смол. Окисление фенолов относится к числу сложных, многостадийных процессов, приводящих к продуктам разного строения. Механизм окисления может сильно меняться в зависимости от строения фенола и природы одно- или двухэлектронного окислителя. Механизм окисления включает стадию образования стабилизированных резонансом ароксильных радикалов. Направление дальнейших превращений зависит от характера заместителей в ароматическом кольце. При окислении большинства фенолов образуется несколько различных форм димеров в результате образования новых связей С-С между орто—орто, орто-пара- и пара-пара-положениями ароксильных радикалов, а также новых С-О связей между атомом кислорода одного радикала и орто- или пара-положением другой радикальной частицы. Всего, таким образом, образуется потенциально не менее пяти различных типов димеров, которые находится в равновесии с исходным ароксильным радикалом. Например, для монозамещенного фенола: Димеры, возникающие в результате рекомбинации радикалов с образованием новой С-С связи, называются хинолидами. Хинолиды далее изомеризуются с образованием изомерных дигидроксибифенилов. Другой тип димеров, содержащих центральную связь С-О, носит название хиноловыхэфиров. Ароксильные радикалы пространственно затрудненных фенолов, содержащие в обоих орто- и пара-положении третичные алкильные группы, мономерны и не проявляют тенденции к образованию димеров в растворе. Например, при окислении 2,4,6-три-трет-бутилфенола гексацианоферратом(III) калия K3Fe(CN)6 в бинарной системе бензол-вода в инертной атмосфере образуется устойчивый радикал одновалентного кислорода — три-трет-бутилфеноксил, окрашенный в синий цвет. Этот радикал находится в мономерной форме в 0,1 молярном растворе в бензоле или эфире, а также в кристаллическом состоянии. Он очень чувствителен к действию кислорода воздуха, оксида азота (IY), оксида азота (II) и других радикальных частиц. Стабильность ароксильных радикалов пространственно затрудненых фенолов обусловливает их антиокислительные свойства. Они выполняют роль ловушек свободных радикалов в процессах пероксидного окисления. Активный свободный радикал, ведущий цепь окисления, быстро взаимодействует с таким фенолом, давая устойчивый ароксильный радикал, что приводит к обрыву цепи. ArOH + RO2 s ® ArO s + ROOH Пространственно затрудненные фенолы (ионол, гальваноксил) используют как антиоксиданты, стабилизирующие синтетические каучуки, пищевые жиры, витамины и др. Видео:Реакция сульфата меди II ( медный купорос) с гидроксидом натрия ( щелочами)Скачать  Получение. Свойства1 . Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол: 2. При каталитическом окислении изопропилбензола (кумола) кислородом воздуха образуются фенол и ацетон: Это — основной промышленный способ получения фенола. 3. Получение из ароматических сульфокислот. Реакция проводится при сплавлении сульфокислот с щелочами. Первоначально образующиеся феноксиды обрабатывают сильными кислотами для получения свободных фенолов. Метод обычно применяют для получения многоатомных фенолов: Химические свойства . В фенолах p -орбиталь атома кислорода образует с ароматическим кольцом единую p -систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О—Н увеличивается, и водород ОН-группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов). 1. Кислотность фенола существенно выше, чем у предельных спиртов; он реагирует как с щелочными металлами: так и с их гидроксидами (отсюда старинное название «карболовая кислота»): Фенол, однако, является очень слабой кислотой. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол; такая реакция доказывает, что фенол — более слабая кислота, чем угольная и сернистая: Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода. 2. Образование сложных эфиров. В отличие от спиртов, фенолы не образуют сложных эфиров при действии на них карбоновых кислот; для этого используются хлорангидриды кислот: 3. Реакции электрофильного замещения в феноле протекают значительно легче, чем в ароматических углеводородах. Поскольку ОН группа является ориентантом I рода, то в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара-положениях (при галогенировании, нитровании, поликонденсации и т.д.). Так, при действии бромной воды на фенол три атома водорода замещаются на бром, и образуется осадок 2,4,6-трибромфенола: Это — качественная реакция на фенол. При нитровании фенола концентрированной азотной кислотой три атома водорода замещаются на нитрогруппу, и образуется 2,4,6-тринитрофенол (пикриновая кислота): При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации, и образуется фенолформальдегидная смола — высокомолекулярное соединение с разветвленной структурой типа: 4. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон: В заключение отметим, что для идентификации фенола очень часто используется его реакция с раствором FeCl 3 ; при этом образуется комплексный ион фиолетового цвета. Наряду с реакцией (2), это — качественная реакция на обнаружение фенола. Применение . Фенол используют как полупродукт при получении фенолформальдегидных смол, синтетических волокон, красителей, лекарственных средств и многих других ценных веществ. Пикриновую кислоту применяют в промышленности в качестве взрывчатого вещества. Крезолы используют как вещества с сильным дезинфицирующим действием. 📹 ВидеоРеакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать  Получение Алюмината Натрия - NaAlO2.Реакция Расплава Гидроксида Натрия и Алюминия. Реакция Al и NaOHСкачать  Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  Гидролиз солей. 9 класс.Скачать  Реакция фенолфталеина на гидроксид натрияСкачать  Электролиз. 10 класс.Скачать  хлорид алюминия и гидроксид натрияСкачать  Реакции нуклеофильног замещения. Галогенпроизводные углеводородовСкачать  Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать  Реакция Йода И Гидроксида Натрия. Реакция I2 и NaOH.Скачать  Взаимодействие калия и натрия с водойСкачать  Получение КУПРАТА Натрия - Na2CuO2. Реакция Гидроксида Меди(2) и Гидроксида Натрия.Скачать  Проклятая химическая реакция 😜 #shortsСкачать  ГИДРОКСИД НАТРИЯ | NaOH | Химические свойства ГИДРОКСИДА НАТРИЯ | Качественные реакции | ХимияСкачать  Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать  Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать  ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  |

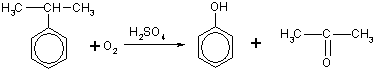 (1)
(1)
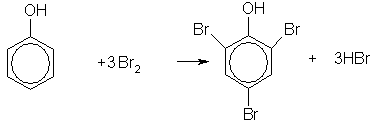 (2)
(2)
 (3)
(3)