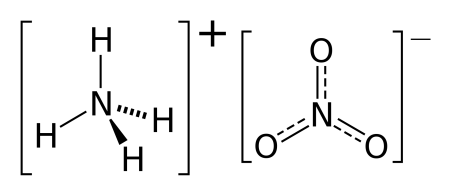- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Нитрат аммония
- Содержание
- Физические свойства
- Растворимость
- Состав
- Методы получения
- Основной метод
- Метод Габера
- Нитрофосфатный метод
- Химические свойства
- Кристаллические состояния нитрата аммония
- Применение
- Удобрения
- Взрывчатые вещества
- Безопасный состав
- Дополнительная информация
- Термическое разложение нитрата аммония, его огне — и взрывоопасность
- 📺 Видео
Видео:Реакция АЛЮМИНИЯ, СЕРЫ и НИТРАТА АММОНИЯ.The reaction of aluminum, sulfur and ammonium nitrateТермитСкачать

We are checking your browser. gomolog.ru
Видео:«Продукты разложения нитрита и нитрата аммония» #умскул_химия #умскул #богданчагинСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Растворение нитрата аммония. Химический опытСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2be85549570b7c • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Разложение нитрата аммония! Ammonium nitrate decomposition (and more)!Скачать

Нитрат аммония
наименование
210 °C
Нитрат аммония (аммонийная (аммиачная) селитра) — химическое соединение NH4NO3, соль азотной кислоты. Впервые получена Глаубером в 1659 году. Используется в качестве компонента взрывчатых веществ и как азотное удобрение.
Видео:ПЕРХЛОРАТ АММОНИЯСкачать

Содержание
- 1 Физические свойства
- 1.1 Растворимость
- 1.2 Состав
- 2 Методы получения
- 2.1 Основной метод
- 2.2 Метод Габера
- 2.3 Нитрофосфатный метод
- 3 Химические свойства
- 4 Кристаллические состояния нитрата аммония
- 5 Применение
- 5.1 Удобрения
- 5.2 Взрывчатые вещества
- 6 Безопасный состав
- 7 Дополнительная информация
Видео:Реакции горенияСкачать

Физические свойства
Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при пониженном давлении — 235 °C. Молекулярная масса 80,04 а. е.м. Скорость детонации 2570 м/с.
Растворимость
Растворимость в воде:
| Температура, °C | Растворимость, г/100мл |
|---|---|
| 0 | 119 |
| 10 | 150 |
| 25 | 212 |
| 50 | 346 |
| 80 | 599 |
| 100 | 1024 |
При растворении происходит сильное поглощение тепла (аналогично нитрату калия), что значительно замедляет растворение. Поэтому для приготовления насыщенных растворов нитрата аммония применяется нагревание, при этом твёрдое вещество засыпается небольшими порциями.
Также соль растворима в аммиаке, пиридине, метаноле, этаноле.
Состав
Содержание элементов в нитрате аммония в массовых процентах:
Видео:Химическая реакция МЕДИ и НИТРАТА АММОНИЯ. Химические опыты дома. Chemical experiment. ЭкспериментыСкачать

Методы получения
Основной метод
В промышленном производстве используется безводный аммиак и концентрированная азотная кислота:
Реакция протекает бурно с выделением большого количества тепла. Проведение такого процесса в кустарных условиях крайне опасно (хотя в условиях большого разбавления водой нитрат аммония может быть легко получен). После образования раствора, обычно с концентрацией 83 %, лишняя вода выпаривается до состояния расплава, в котором содержание нитрата аммония составляет 95—99,5 % в зависимости от сорта готового продукта. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. Цвет гранул варьируется от белого до бесцветного. Нитрат аммония для применения в химии обычно обезвоживается, так как он очень гигроскопичен и процентное количество воды в нём получить практически невозможно.
Метод Габера
По способу Габера из азота и водорода синтезируется аммиак, часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония:
Нитрофосфатный метод
Этот способ также известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс. Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы:
- Природный фосфат кальция (апатит) растворяют в азотной кислоте:
- Ca3(PO4)2 + 6HNO3 ⟶ 2H3PO4 + 3Ca(NO3)2
- Полученную смесь охлаждают до 0 °C, при этом нитрат кальция кристаллизуется в виде тетрагидрата — Ca(NO3)2·4H2O, и его отделяют от фосфорной кислоты.
- На полученный нитрат кальция, не очищенный от фосфорной кислоты, действуют аммиаком, получая в итоге нитрат аммония:
- Ca(NO3)2 + 4H3PO4 + 8NH3 ⟶ CaHPO4↓ + 2NH4NO3 + 3(NH4)2HPO4
А также амфотерный метод.
Видео:Уравнивание реакций горения углеводородовСкачать

Химические свойства
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
Видео:Химическая Реакция. Нитрат Аммония и Марганец.Скачать

Кристаллические состояния нитрата аммония
Изменения кристаллического состояния нитрата аммония под воздействием температуры и давления меняют его физические свойства. Обычно различают следующие состояния:
| Система | Диапазон температур (°C) | Состояние | Изменение объёма (%) | |
|---|---|---|---|---|
| — | > 169.6 | жидкость | ||
| I | 169.6 — 125.2 | кубическая | −2.13 | |
| II | 125.5 — 84.2 | тетрагональная | −1.33 | |
| III | 84.2 — 32.3 | α-ромбическая | +0.8 | |
| IV | 32.3 — −16.8 | β-ромбическая | −3.3 | |
| V | −50 — −16.8 | тетрагональная | +1.65 | |
| VI | существует при высоких давлениях | |||
| VII | 170 | |||
| VIII | существует при высоких давлениях | |||
| IX | существует при высоких давлениях |
Фазовый переход от IV к III при 32,3 °C приносит неприятности производителям удобрений, потому как изменения плотности приводят к разрушению частиц при хранении и применении. Это особенно важно в тропических странах, где нитрат аммония испытывает циклические изменения, приводящие к разрушению гранул, слёживанию, повышенному пылению и риску возникновения взрыва.
Видео:Термит. Термитные составы. Металлотермия. 25+ реакций термитных (и не очень) смесей.Скачать

Применение
Удобрения
Бо́льшая часть нитрата аммония используется либо непосредственно как хорошее азотное удобрение, либо как полупродукт для получения прочих удобрений. Для предотвращения создания взрывчатых веществ на основе нитрата аммония в удобрения, доступные в широкой продаже, добавляют компоненты, снижающие взрывоопасность и детонационные свойства чистого нитрата аммония, такие как мел (карбонат кальция).
В Австралии, Китае, Афганистане, Ирландии и некоторых других странах свободная продажа нитрата аммония даже в виде удобрений запрещена или ограничена. После террористического акта в Оклахома-Сити ограничения на продажу и хранение нитрата аммония были введены в некоторых штатах США.
Взрывчатые вещества
Наиболее широко в промышленности и горном деле применяются смеси аммиачной селитры с различными видами углеводородных горючих материалов, других взрывчатых веществ, а также многокомпонентные смеси:
- составы типа аммиачная селитра/дизельное топливо (АСДТ)
- жидкая смесь аммиачная селитра/гидразин (Астролит)
- водонаполненные промышленные взрывчатые вещества (Акванал, Акванит и др.)
- смеси с другими взрывчатыми веществами (Аммонит, Детонит и др.)
- смесь с алюминиевой пудрой (аммонал)
Аммиачная селитра отличается большой гигроскопичностью, поэтому в качестве взрывчатого вещества не используется, так как в сыром виде взрывчатые свойства утрачиваются.
Видео:Каталитическое разложение нитрата аммонияСкачать

Безопасный состав
В 2013 г. сотрудники Sandia National Laboratories объявили о разработке безопасного и эффективного состава на основе смеси нитрата аммония с сульфатом железа, который не может быть использован для создания на его основе взрывчатых веществ. При разложении состава ион SO4 2− связывается с ионом аммония, а ион железа — с нитрат-ионом, что предотвращает взрыв. Введение в состав удобрения сульфата железа может улучшить и технологические характеристики удобрения, особенно на закисленных почвах. Авторы отказались от защиты формулы удобрения патентом с тем, чтобы этот состав мог получить быстрое распространение в регионах с высокой террористической опасностью.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Дополнительная информация
Мировое производство аммиачной селитры на 1980 год составляло 14 млн т, в пересчёте на азот.
Видео:Химический фонтан из УГЛЯ и НИТРАТА АММОНИЯ.Chemical experiment with ammonium nitrate.Опыты по химииСкачать

Термическое разложение нитрата аммония, его огне — и взрывоопасность
Длительный опыт производства и применения аммиачной селитры показал, что при соблюдении установленных правил аммиачная селитра безопасна 57
66. Чистая аммиачная селитра не чувствительна к толчкам, ударам или трению. Однако при определенных условиях нитрат аммония обладает взрывчатыми свойствами. На этом основании его используют и как сырье в производстве амми — ачно-селитренных взрывчатых веществ. Они взрывают только от детонатора. Взрывы чистой аммиачной селитры могут быть вызваны в основном или воздействием детонаторов, или термическим разложением соли в замкнутом пространстве.
Взрывоопасность нитрата аммония возрастает в присутствии минеральных кислот л легко окисляющихся материалов, таких как органические вещества и некоторые металлы, особенно в порошкообразном состоянии (например, алюминий, цинк, свинец, сурьма, висмут, никель, медь, кадмий). В большинстве случаев в присутствии этих металлов (особенно кадмия и меди) образуется неустойчивый, легко разлагающийся нитрит аммония.
При увеличении размера частиц и повышении влажности взрывоопасность аммиачной селитры значительно уменьшается. Влажная соль, содержащая более 3% воды, не взрывает даже при взрыве детонатора 58’5Э.
При нагревании нитрат аммония начинает разлагаться согласно уравнению:
Это разложение становится заметным выше 150°, но, даже при 165°, потеря в весе аммиачной селитры не превосходит 6% за сутки. При более высоких температурах нитрат аммония разлагается интенсивно по следующим реакциям 67: при 200—270′
(Теплоты этих реакций даны для 18° и для газообразного состояния продуктов реакции.) Последнее уравнение соответствует взрывному разложению NH4N03. Термическое разложение NH4N03 может происходить одновременно по нескольким реакциям, причем одна из них может доминировать над другими. Термический распад азотной кислоты обусловливает появление в газообразных продуктах разложения аммиачной селитры N0 и NO2. По-видимому, выделяющиеся в результате термического распада азотной кислоты N02 и Н20 являются катализаторами дальнейшего разложения NH4NO368. Термическое разложение расплавленной аммиачной селитры ускоряется также в присутствии соединений Сг6+, Сг3+, Сг2+ и др. 69. Таким образом, чистую аммиачную селитру следует безусловно отнести к классу потенциально взрывчатых веществ.
Нитрат аммония, хранящийся в открытых складах, не взрывается даже в случае сильного пожара. Пожары же аммиачной селитры, которые имели место в закрытых помещениях, например, в корабельных трюмах, контейнерах и т. п., кончались, как правило, сильным взрывом. Предполагают, что термическое разложение нитрата аммония при атмосферном давлении протекает иначе, чем под повышенным давлением, при котором скорость разложения может быть большей и быстро образуются большие объемы газообразных продуктов. Было показано 64 существование «предельного» давления (около 6 ат) после достижения которого при соответствующей температуре наступает взрывное разложение аммиачной селитры.
С другой стороны, легкую воспламеняемость и взрываемость аммиачной селитры, находящейся в непроветриваемых закрытых помещениях, можно объяснить не повышением общего давления, что является вторичной причиной, а накоплением продуктов медленного разложения селитры. Самопроизвольное разложение аммиачной селитры в присутствии способных окисляться, например, органических веществ является автокаталитическнм. Такое разложение может привести к воспламенению и взрыву. Автокатализ вызывается главным образом образующейся при разложении NH4N03 двуокисью азота, а также, но в меньшей мере, водяным паром. Последнее обстоятельство указывает на недопустимость тушения воспламенившейся селитры водяным паром.
Стабилизаторами, предотвращающими самопроизвольное разложение аммиачной селитры, могут быть вещества, связывающие образующиеся при ее разложении азотную кислоту и NO2, или выделяющие при взаимодействии с NH4N03 аммиак. Последний нейтрализует азотную кислоту и восстанавливает окислы азота до элементарного азота. Стабилизаторами являются, например, карбамид (0,05—0,1% от веса селитры)70-73, карбонат кальция или магния (5%), хлориды, уротропин и др.67.
Аммиачная селитра является одним из наиболее эффективных азотных удобрений. Впервые в чистом виде в качестве удобрения ее стали применять в СССР. Большое содержание азота позволяет осуществлять ее перевозки на значительные расстояния с меньшими затратами на тонну азота, чем при перевозках других азотных удобрений (за исключением карбамида). Аммиачная селитра дешевле, чем другие азотные удобрения 74-75. Относительная стоимость азота в азотных удобрениях характеризуется следующими условными показателями:
TOC o «1-3» h z В аммиачной селитре. 1
сульфате аммония. 1,3
кальциевой селитре. 1,5
Аммиачная селитра обладает потенциальной (физиологической) кислотностью. Физиологически нейтрализованную аммиачную селитру получают сплавлением ее с известняком, доломитом и другими материалами76. Взрывоопасность и слеживаемость аммиачной селитры сдерживали ее производство в капиталистических странах. Лишь в послевоенный период, на основе успешного опыта СССР, вначале в США, а затем и в других странах использование аммиачной селитры в качестве азотного удобрения получило широкое развитие.
Аммиачную селитру применяют для изготовления взрывчатых веществ — аммонитов (смесей аммиачной селитры с органическими материалами — древесная, жмыховая и другая мука с добавкой нн — тропродуктов), аммоналов (смесей, содержащих алюминиевый порошок) и др. Для этих целей выпускают водоустойчивую селитру 77
Состав аммиачной селитры приведен в табл. 89.
Состав аммиачной селитры (в %)
Нитратного й аммиачного азота в сухом веществе в пересчете:
На NH4NO3, не менее. .
На азот, не менее.
Добавок в сухом веществе:
Фосфатов (Р205), не Менее.
Нлн нитратов Са н Mg (СаО), не менее
Не растворимых веществ:
В воде, не более.
В соляной кислоте, не более.
Мельче 1 мм, не более.
Жирных кислот и парафина.
Кислотность (на HNO3), Не более.
📺 Видео
Составление уравнений реакций горения. 11 класс.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Химический Фейерверк. Смесь Порошка Железа, Нитрата Аммония, Угля.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Взрыв аммиачной селитры в Ливане 4.08.2020Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

аммиачная селитра плюс сахарСкачать