Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
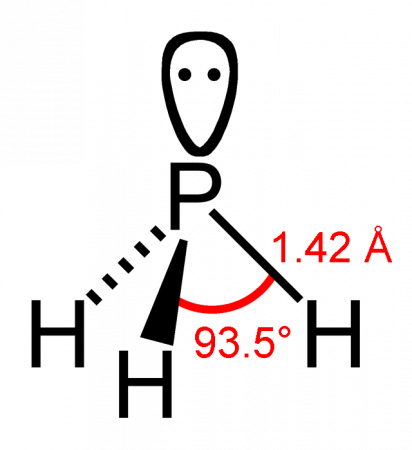
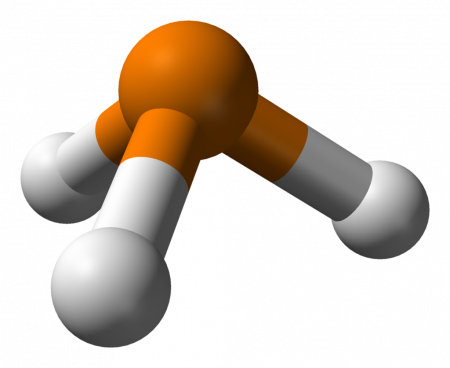
Геометрическая форма молекулы фосфина похожа на структуру аммиака — правильная треугольная пирамида. Но валентный угол H-P-H меньше, чем угол H-N-H в аммиаке и составляет 93,5 о .
У атома фосфора в фосфине на внешнем энергетическом уровне остается неподеленная электронная пара. Эта электронная пара оказывает значительное влияние на свойства фосфина, а также на его структуру. Электронная структура фосфина — тетраэдр , с атомом фосфора в центре.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Видео:Фосфин - PH3. Реакция Фосфида Кальция И Соляной Кислоты. Получение Фосфида Кальция.Скачать

Фосфин
| Фосфин | |||
|---|---|---|---|
| |||
| Систематическое наименование | Фосфин | ||
| Хим. формула | PH3 | ||
| Состояние | газ | ||
| Молярная масса | 34,00 г/моль | ||
| Плотность | 1,379 г/л, газ (25 °C) | ||
| Энергия ионизации | 9,96 ± 0,01 эВ | ||
| Температура | |||
| • плавления | −133,8 °C | ||
| • кипения | −87,8 °C | ||
| Пределы взрываемости | 1,79 ± 0,01 об.% | ||
| Энтальпия | |||
| • образования | 5,4 кДж/моль | ||
| Давление пара | 41,3 ± 0,1 атм | ||
| Растворимость | |||
| • в воде | 31,2 мг/100 мл (17 °C) | ||
| Рег. номер CAS | [7803-51-2] | ||
| PubChem | 24404 | ||
| Рег. номер EINECS | 232-260-8 | ||
| SMILES | |||
| RTECS | SY7525000 | ||
| ChEBI | 30278 | ||
| Номер ООН | 2199 | ||
| ChemSpider | 22814 | ||
| Токсичность | Чрезвычайно токсичен, СДЯВ | ||
| Пиктограммы ECB |   | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фосфин (фосфористый водород, фосфид водорода, гидрид фосфора, по номенклатуре IUPAC — фосфан) PH3 — бесцветный ядовитый газ (при нормальных условиях). Чистый фосфин не имеет запаха, но образцы технического продукта обладают неприятным запахом, похожим на запах тухлой рыбы (чеснока).
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 4 Самовозгорание
- 5 Токсичность
- 6 Применение
Видео:Уравнивание реакций горения углеводородовСкачать

Физические свойства
Бесцветный газ. Плохо растворяется в воде, образует с ней неустойчивый гидрат, который проявляет очень слабые основные свойства. При низких температурах образует твёрдый клатрат 8 PH3·46 H2O. Растворим в бензоле, диэтиловом эфире, сероуглероде. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой.
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v (dPH = 0,142 нм, ∠HPH = 93,5°). Дипольный момент составляет 0,58 Д, существенно ниже, чем у аммиака. Водородная связь между молекулами PH3 практически не проявляется и поэтому по сравнению с аммиаком, фосфин имеет более низкие температуры плавления и кипения.
Видео:Реакции горенияСкачать

Получение
Фосфин получают при взаимодействии белого фосфора с горячей щёлочью, например:
Также его можно получить воздействием воды или кислот на фосфиды:
Хлористый водород при нагревании взаимодействует с белым фосфором:
Разложение йодида фосфония:
Разложение фосфоновой кислоты:
или её восстановление:
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Химические свойства
Фосфин сильно отличается от своего аналога, аммиака. Его химическая активность выше, он плохо растворим в воде, как основание значительно слабее. Последнее объясняется тем, что связи H−P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s 2 ) ниже, чем у азота (2s 2 ) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
На воздухе горит согласно уравнению:
Проявляет сильные восстановительные свойства:
В связи с тем, что:
то возможно протекание следующей реакции:
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4 + (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
Соли фосфония, как и сам фосфин, являются сильными восстановителями.
Видео:29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

Самовозгорание
Абсолютно чистый и сухой фосфин не способен к самовоспламенению на воздухе и загорается только при температуре 100-150°. Однако фосфин, получающийся, например, при взаимодействии фосфидов с водой всегда имеет примесь дифосфина P2H4, который на воздухе самовоспламеняется. В частности, таким образом могут появляться «блуждающие огни».
Видео:Реакция горения гептана. Как уравнять?Скачать

Токсичность
Фосфин очень ядовит. Поражает в первую очередь нервную систему, нарушает обмен веществ; также действует на кровеносные сосуды, органы дыхания, печень, почки. Запах фосфина ощущается при концентрации 2—4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ может привести к летальному исходу. ПДК — 0,1 мг/м³.
При остром отравлении фосфином в лёгких случаях беспокоит боль в области диафрагмы, чувство холода, впоследствии может развиться бронхит. При среднетяжёлом отравлении — чувство страха, озноб, рвота, стеснение в груди, удушье, боль за грудиной. В тяжёлых случаях на первый план выходят неврологические симптомы — оглушение, неверная походка, подёргивания в конечностях, мидриаз; cмерть от паралича дыхания или сердечной мышцы может наступить через нескольно дней, а при высоких концентрациях — мгновенно.
Хроническое отравление может привести к расстройству зрения, походки, речи, пищеварения, бронхиту, болезням крови и жировому перерождению печени.
Видео:Горение. 7 класс.Скачать

Применение
В 2019 году фосфин был предложен в качестве биосигнатурного газа для поиска жизни на землеподобных экзопланетах, поскольку на Земле он производится анаэробными экосистемами. Слабой стороной фосфина для этой цели является его высокая реакционная способность, что требует большой интенсивности производства этого газа для его детектирования. Для его обнаружения в атмосфере экзопланеты потребуются десятки часов наблюдения телескопа «Джеймс Уэбб».
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Фосфин PH3
Фосфин (фосфористый водород) при н.у. является ядовитым бесцветным газом, имеющим запах чеснока.
Фосфин хорошо растворяется в органических растворителях, но малорастворим в воде.
- Молярная масса: 34,00 г/моль
- Плотность: 1,379 г/л (25°C)
- Энергия ионизации: 9,96±0,01 эВ
- tпл.: -133,8°C
- tкип.: -87,8°C
По сравнению с аммиаком, фосфин имеет более низкие температуры кипения и плавления по причине очень слабых водородных связей между молекулами PH3.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Химические свойства фосфина
При растворении в воде фосфин образует очень слабое основание — гидрат (коэффициент диссоциации = 4·10 25 )
PH3+H2O ↔ PH4OH ↔ PH3·H2O ↔ PH4 + +OH —
С сильными кислотами фосфин образует соли (содержат ион PH4 + ) — крайне неустойчивые, легко гидролизующиеся, бесцветные кристаллы, которые, как и сам фосфин, являются сильными восстановителями:
PH3+HCl = PH4Cl (хлорид фосфония)
PH3+HClO4 = PH4ClO4 (перхлорат фосфония)
В окислительно-восстановительных реакциях фосфин является более сильным восстановителем, чем аммиак, что объясняется степенью окисления фосфора (-3), которую он принимает в молекуле фосфина — это самая низкая из возможных степеней окисления для фосфора, которая менее устойчива, чем у азота в молекуле аммиака.
При температуре порядка 150°C фосфин самовоспламеняется на воздухе:
2P -3 H3+4O2 = P2 +5 O5+3H2O
Соли малоактивных металлов фосфин восстанавливает до свободного металла:
P -3 H+8Ag +1 NO3+4H2O = H3P +5 O4+8Ag 0 +8HNO3
Получение фосфина:
- взаимодействием фосфора с водными растворами щелочей в реакциях диспропорционирования:
4P 0 +3KOH+3H2O = P -3 H3↑+3KH2P +1 O2 - действием соляной кислоты на фосфиды металлов:
Zn3P2+6HCl = 2PH3↑+3ZnCl2
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
📸 Видео
Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Алкены. Ч.3-3. Химические свойства. Реакции окисления и горения.Скачать

25. Схема реакции и химическое уравнениеСкачать

3.3. Алкины: Химические свойстваСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Практическая работа «Сравнение реакций горения серы, фосфора, железа в воздухе и кислороде»Скачать

Химия с нуля — Химические свойства АлкеновСкачать