Этанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение этанола
- Водородные связи и физические свойства спиртов
- Изомерия спиртов
- Структурная изомерия
- Химические свойства этанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.1. Внутримолекулярная дегидратация
- 3.2. Межмолекулярная дегидратация
- 4. Окисление этанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение спиртов
- 5. Дегидрирование этанола
- Получение этанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Получение этанола спиртовым брожением глюкозы
- Физико-химические свойства этилового спирта
- Уравнение реакции горения этилового спирта в воздухе
- 📸 Видео
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
Видео:Горение. 7 класс.Скачать

Изомерия спиртов
Видео:Уравнивание реакций горения углеводородовСкачать

Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Видео:Горение этилового спиртаСкачать

Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
Видео:Опыты по химии. Окисление спирта в альдегидСкачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
Видео:Горение спиртовСкачать

Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
Видео:29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |
Видео:Принцип реакции горения спиртовых соединений!Скачать

4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания этанола: |
Видео:Спирты: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этанола образуется этаналь |
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Получение этанола
Видео:Реакции горенияСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол |
Видео:Получение этилового спирта по наукеСкачать

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Видео:Горение нитроцеллюлозыСкачать

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
Видео:Горение изопропилового спиртаСкачать

Видео:Химия 10 класс (Урок№6 - Одноатомные предельные спирты.)Скачать

4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Физико-химические свойства этилового спирта
Этиловый спирт – бесцветная прозрачная жидкость; молярная масса С2Н5ОН 46 г/моль; температура плавления –114,14°С; температура кипения 78,3°С; критическое давление 6,395 МПа; температура вспышки 13°С; температура самовоспламенения 404°С; плотность 0,7893 г/см3; смешивается с водой в любых соотношениях.
Расчет термодинамических величин
2.1. Реакция горения этилового спирта в воздухе:
СnНmOr + 



C2H5OH(Ж) + 3 (O2 + 3,75N2)(г) 
2.2. Табличное значение стандартной энтальпии сгорания этилового спирта 
Следовательно, высшая энтальпия сгорания топлива 


2.3. Высшая теплота сгорания топлива QВ:
Qв 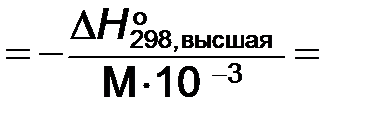
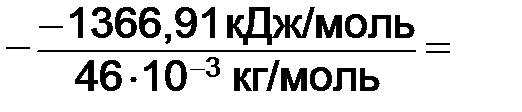
2.4. Низшая энтальпия сгорания топлива 
СnНmOr + 



Для этилового спирта
C2H5OH(Ж) + 3 (O2 + 3,75N2)(г) 
Низшая энтальпия сгорания 




2.5. Низшая теплота сгорания топлива QН:
QН 
2.6. Теоретически необходимое количество воздуха для полного сгорания 1 кг топлива:
= 8,9 кг воздуха/кг топлива.
2.7. Количество топливовоздушной смеси:
М1 = 1топлива + 
2.8. Низшая теплота сгорания топливовоздушной смеси qн, она же калорийность стехиометрической смеси топлива с воздухом:

Сравнительные характеристики (QН, 
Этилового спирта и бензина
| Характеристики | Бензин | Этиловый спирт | |
| Справочные данные | Расчет | ||
| Низшая теплотворная способность, QН (МДж/кг) | 43,3 – 44,0 | 25,0 – 26,8 | 26,85 |
| Низшая теплота сгорания топливовоздушной смеси, qн (кДж/м 3 ) | 3439 − 3910 | ||
Стехиометрическая потребность воздуха в процессе сгорания,  (кг воздуха / кг топлива) (кг воздуха / кг топлива) | 14,9 | 9,0 | 8,9 |
Выводы
Из приведенных данных (табл. 6) следует, что этиловый спирт и бензин имеют близкую по значению теплотворную способность стехиометрической смеси.
Для этилового спирта характерна меньшая теплотворная способность единицы массы топлива и требуется меньшее стехиометрическое количество воздуха, необходимое для сгорания спирта, что обусловлено меньшим содержанием углерода и большим содержанием кислорода в спирте.
Анализ физико-химических свойств этилового спирта и термодинамических расчетов в сравнении со свойствами бензина показывает возможность его использования в качестве топлива для двигателей с искровым зажиганием.
Проблемой, ограничивающей применение этилового спирта в качестве топлива, являются большие затраты энергии на производство спирта по сравнению с энергией, получаемой в процессе его сгорания.
Кроме того, коррозионная активность спиртов, а также их активность по отношению к ряду пластмасс требует пересмотра материалов топливной системы.
Этиловый спирт применяется в настоящее время для питания автомобилей в виде смеси (90% бензина + 10% С2Н5ОН – газойль).
ПРИЛОЖЕНИЕ
Варианты заданий для выполнения курсовой работы
Видео:C4H9OH + 6O2 → 4CO2 + 5H2O | Реакция горения бутанолаСкачать

Уравнение реакции горения этилового спирта в воздухе

Нальем понемногу этилового, бутилового и изоамилового спиртов в фарфоровые чашки. Поднесем к чашкам горящую лучину. Этиловый спирт быстро загорается и горит голубоватым, слабосветящимся пламенем. Бутиловый спирт горит светящимся пламенем. Труднее загорается изоамиловый спирт, он горит коптящим пламенем. С увеличением молекулярной массы одноатомных спиртов повышается температура кипения и возрастает светимость их пламени.
Оборудование: огнезащитная прокладка, фарфоровые чашки, лучина.
Техника безопасности. Соблюдать правила работы с огнеопасными жидкостями.
Постановка опыта и текст – к.п.н. Павел Беспалов.
📸 Видео
Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать






















