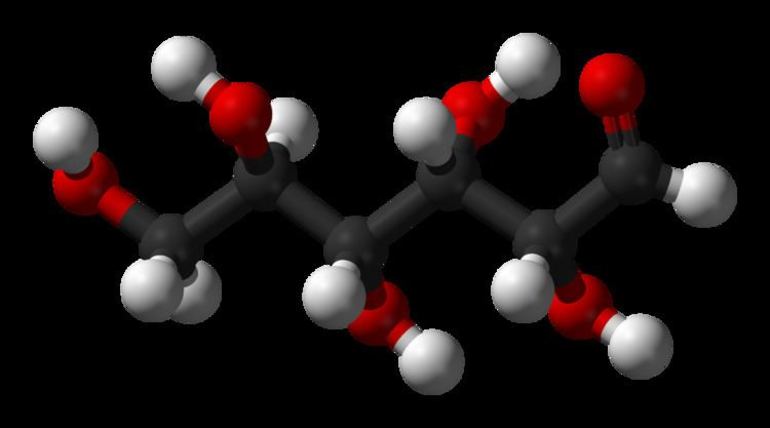
Сахароза — природный углевод, являющийся химическим органическим соединением. Его относят к дисахаридам, так как в его структуре содержится два моносахаридных звена: остатки молекул глюкозы и фруктозы, соединенных через гидроксильную группу. В быту сахарозу называют тростниковым (иногда свекловичным) сахаром.
Видео:Кислотный гидролиз сахарозыСкачать

Общие свойства
Внешне сахароза выглядит как бесцветные мелкие кристаллы. Ее физические свойства:
- в воде, этаноле растворима, однако практически не растворяется в метаноле и диэтиловом эфире;
- температура плавления равна 186 градусов по Цельсию. При застывании расплавленной массы получается аморфное прозрачное вещество, называемое карамелью;
- в природе находится в овощах, фруктах и ягодах.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Получение сахарозы
Получение — довольно сложный и тонкий процесс. Для этого сахарный тростник или свеклу измельчают до мелких опилок и переносят в громадные диффузоры.
В них происходит процесс вымывания сахарозы под действием горячей воды.
Так как совместно с С12Н22О11 в раствор попадают примеси, для отделения данных продуктов через раствор пропускают гидроксид кальция Ca (OH2). После такой процедуры происходит образование почти нерастворимых солей, выпадающих в осадок (CaCO3), и растворимого сахарата кальция С12Н22О11*СаО*2Н2О.
Следующим шагом углекислый газ (СО2) добавляют к получившемуся раствору с целью разделения сахарата кальция.
В результате в осадок выпадает карбонат кальция, который отфильтровывается, а оставшийся раствор выпаривают в специальных вакуумных аппаратах. Далее образующиеся кристаллики разделяются при помощи центрифуги. Оставшийся раствор называется меласса. Он широко применяется для получения лимонной кислоты.
Полученная сахароза подвергается дополнительным очисткам, кристаллизации и упариванию.
Видео:Опыты по химии. Гидролиз сахарозыСкачать

Сферы применения
Сахароза применяется во многих областях:
Видео:Кислотный гидролиз сахарозыСкачать

Химические свойства
Формула — C12H22O11. Она не проявляет восстановительных свойств, а реакции идут обычно по гидроксильным группам:
Гидролиз дисахаридов — химическая реакция, при которой вода вступает в реакцию с другими веществами.
Для дисахаридов характерна данная реакция (среда должна быть кислой либо необходимо присутствие фермента) с образованием моносахаридов, то есть происходит диссоциация. Чтобы гидролизоваться, нужна кислота.
Гидролизация происходит при высокой температуре и в присутствии ионов водорода. В результате она расщепляется до молекулы глюкозы и молекулы фруктозы.
Уравнение реакции гидролиза сахарозы можно написать следующим образом: C12H22O11+H2O=C6H12O6 (глюкоза)+C6H12O6 (фруктоза).
Из моносахаридов можно получить дисахариды обратной реакцией. А также в живых существах данная реакция происходит при участии различных ферментов. Скорость протекания реакции зависит от количества С12Н22О11 в растворе.
Видео:Гидролиз солей. 9 класс.Скачать

Гидролиз сахарозы

Средняя оценка: 4.5
Всего получено оценок: 264.
Средняя оценка: 4.5
Всего получено оценок: 264.
Сахароза – органическое соединение, которое является дисахаридом. Его молекула состоит из остатков d-глюкозы и d-фруктозы. Что представляет собой гидролиз сахарозы, и какие вещества образуются в процессе этой реакции?
Видео:Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

Общая характеристика сахарозы
Сахароза – вещество, входящее в класс углеводов. Она считается дисахаридом, так как состоит из двух моносахаридов: фруктозы и глюкозы.В естественных условиях она встречается во многих фруктах, овощах и ягодах. Особенно ее много в сахарной свекле и сахарном тростнике. По внешнему виду представляет собой бесцветные кристаллы, которые при плавлении превращаются в карамель. Температура плавления составляет 186 градусов. Сахароза хорошо растворяется в воде и этаноле, но плохо – в метаноле, и совершенно не растворима в диэтиловом эфире.
Химическая формула сахарозы выглядит следующим образом: С12H22O11 .
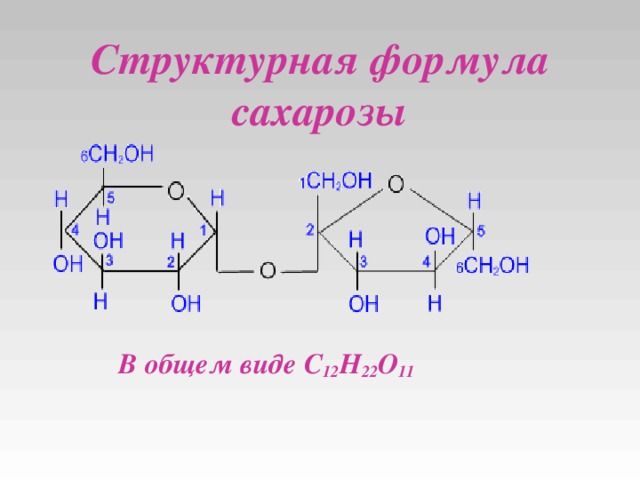
Химическими особенностями сахарозы является то, что она не проявляет восстанавливающих свойств, не проявляет свойств альдегидов и кетонов.
Cахароза имеет несколько названий. Часто это вещество называют свекловичным или тростниковым сахаром.
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Гидролиз сахарозы
Гидролиз – химическая реакция, в процессе которой вода реагирует с каким-либо веществом. Уравнение реакции гидролиза сахарозы выглядит следующим образом:
– в результате этой химической реакции образуются фруктоза и глюкоза.
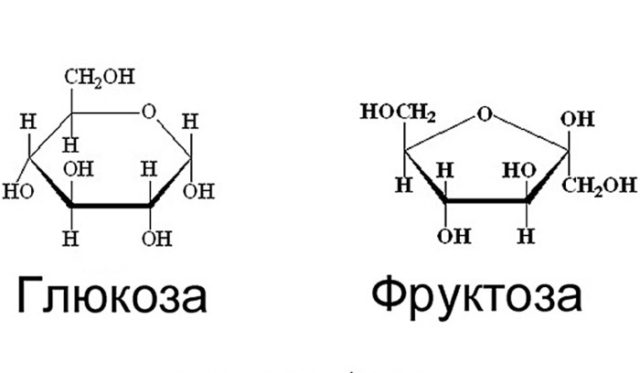
Если раствор сахарозы довести до кипения с небольшим количеством серной или соляной кислоты и добавить щелочь, чтобы нейтрализовать кислоту, а потом снова нагреть получившуюся жидкость, то в результате этой реакции образуются молекулы, которые восстанавливают гидроксид меди до оксида меди.
Cкорость реакции гидролиза сахарозы зависит исключительно от концентрации сахарозы в растворе.
Сахароза является важным элементом, обеспечивающим человеческий организм энергией. Также она стимулирует работу мозга, а также защищает внутренние органы от воздействия токсических веществ. Недостаток вещества может очень пагубно сказаться на работе организма и вызвать апатию, раздражительность, упадок сил и депрессию. Однако избыток также может отрицательно сказаться на организме человека. Это может быть вызвано ожирением, кариесом, высоким риском развития диабета.
Видео:Гидролиз солей. Опыт 1. Окраска индикаторов в различных средахСкачать

Что мы узнали?
Сахароза содержится в большинстве растений и во множестве продуктов. Главным продуктом, который является источником сахарозы, служит обычный сахар. При гидролизе (реакции химического вещества с водой) сахарозы образуются фруктоза и глюкоза.
Видео:Гидролиз солей. Опыт 2. Определение реакции среды в растворах солейСкачать

Гидролиз сахарозы — уравнение реакции, формула и свойства
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Общие свойства
Внешне сахароза выглядит как бесцветные мелкие кристаллы. Ее физические свойства:
- в воде, этаноле растворима, однако практически не растворяется в метаноле и диэтиловом эфире;
- температура плавления равна 186 градусов по Цельсию. При застывании расплавленной массы получается аморфное прозрачное вещество, называемое карамелью;
- в природе находится в овощах, фруктах и ягодах.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Получение сахарозы
Получение — довольно сложный и тонкий процесс. Для этого сахарный тростник или свеклу измельчают до мелких опилок и переносят в громадные диффузоры.
В них происходит процесс вымывания сахарозы под действием горячей воды.
Так как совместно с С12Н22О11 в раствор попадают примеси, для отделения данных продуктов через раствор пропускают гидроксид кальция Ca (OH2). После такой процедуры происходит образование почти нерастворимых солей, выпадающих в осадок (CaCO3), и растворимого сахарата кальция С12Н22О11*СаО*2Н2О.
Следующим шагом углекислый газ (СО2) добавляют к получившемуся раствору с целью разделения сахарата кальция.
В результате в осадок выпадает карбонат кальция, который отфильтровывается, а оставшийся раствор выпаривают в специальных вакуумных аппаратах. Далее образующиеся кристаллики разделяются при помощи центрифуги. Оставшийся раствор называется меласса. Он широко применяется для получения лимонной кислоты.
Полученная сахароза подвергается дополнительным очисткам, кристаллизации и упариванию.
Видео:Дисахариды. Сахароза. 11 класс.Скачать

Сферы применения
Сахароза применяется во многих областях:
- В основном — как самостоятельный продукт в кулинарии, при изготовлении кондитерских изделий, соусов, алкоголя и других различных блюд. В высоких концентрациях применяется как ферментативный элемент-консервант.
- Широко применяется в химической промышленности. С ее помощью получают многие вещества: глицерин, этанол, лимонную кислоту и другое.
- В фармакологии используется для лекарств и таблеток.
- Для человека сахароза является важным энергетическим компонентом, обеспечивающим энергией и стимулирующим работу мозга. Однако как недостаток, так и ее избыток очень вреден. При недостатке возникает слабость, головокружение, падает работоспособность и внимание. А избыток, как и избыток полисахаридов и крахмала, может вызвать ожирение, высокий риск развития диабета и кариеса. Следует приводить потребление сахаров в равновесие.
Видео:Опыты по химии. Гидролиз крахмалаСкачать

Химические свойства
Формула — C12H22O11. Она не проявляет восстановительных свойств, а реакции идут обычно по гидроксильным группам:
- Взаимодействие с двухвалентным гидроксидом меди Cu (OH)2. Данная реакция доказывает наличие гидроксильной группы в молекуле сахарозы. Если гидроксид меди (||) налить к раствору сахарозы, то получается раствор сахарата меди, имеющий яркий голубоватый цвет. Такая реакция является качественной для многоатомных спиртов.
- Окисления. Все дисахариды делятся на восстанавливающиеся и невосстанавливающиеся. Можно легко определить, какой это дисахарид. К восстанавливающимся относятся мальтоза плюс лактоза, а к невосстанавливающимся — сахароза. Это зависит от наличия полуацетального (гликозидного) гидроксила. В молекуле сахарозы он отсутствует.
- Взаимодействие с серной кислотой. Схема реакции с серной кислотой выглядит следующим образом: 2С 12 Н 22 О 11 +2H 2 SO 4 = 23С↓+CO 2 ↑+2SO 2 ↑ +24Н 2 О
Гидролиз дисахаридов — химическая реакция, при которой вода вступает в реакцию с другими веществами.
Для дисахаридов характерна данная реакция (среда должна быть кислой либо необходимо присутствие фермента) с образованием моносахаридов, то есть происходит диссоциация. Чтобы гидролизоваться, нужна кислота.
Гидролизация происходит при высокой температуре и в присутствии ионов водорода. В результате она расщепляется до молекулы глюкозы и молекулы фруктозы.
Уравнение реакции гидролиза сахарозы можно написать следующим образом: C12H22O11+H2O=C6H12O6 (глюкоза)+C6H12O6 (фруктоза).
Из моносахаридов можно получить дисахариды обратной реакцией. А также в живых существах данная реакция происходит при участии различных ферментов. Скорость протекания реакции зависит от количества С12Н22О11 в растворе.
🌟 Видео
11 класс. Гидролиз солей.Скачать

52. Сахароза. Крахмал. Целлюлоза (часть 3)Скачать

Опыты по химии. Взаимодействие сахарозы с гидроксидом меди (II)Скачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Химия. Углеводы. Сахароза.Скачать

Все реакции гидролиза солей для ЕГЭ. Необратимый гидролиз за 4 минутыСкачать