Цикл трикарбоновых кислот впервые был открыт английским биохимиком Г. Кребсом. Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов. В дальнейшем было показано, что цикл трикарбо-новых кислот является тем центром, в котором сходятся практически все метаболические пути. Таким образом, цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль «клеточного топлива»: углеводов, жирных кислот и аминокислот.
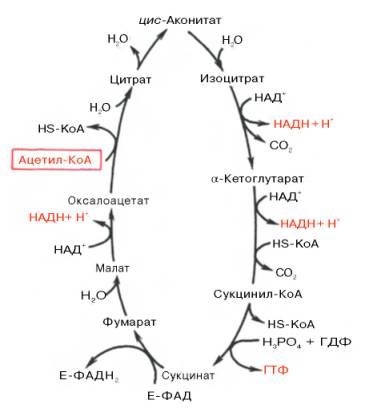
Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций (рис. 10.9). Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двух декарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула окса-лоацетата регенерируется. Рассмотрим все восемь последовательных реакций (этапов) цикла Кребса.
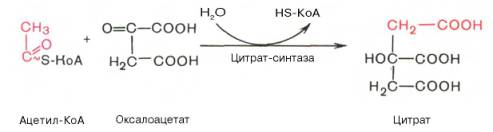
Первая реакция катализируется ферментом цит-рат-синтазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота:
По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментом цитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA.
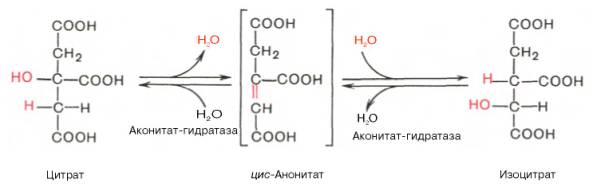
В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратации фермент аконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата:
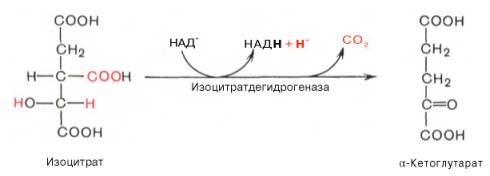
Третья реакция, по-видимому, лимитирует скорость цикла Кребса. Изолимонная кислота дегидрируется в присутствии НАД-зависимой изо-цитратдегидрогеназы.
В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg 2+ или Мn 2+ .
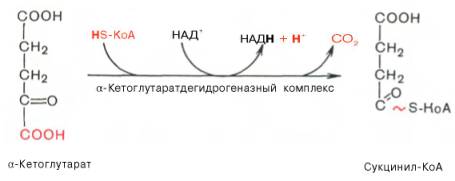
Во время четвертой реакции происходит окислительное декарбокси-лирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. Механизм этой реакции сходен с таковым реакции окислительного декарбоксилирования пирувата до ацетил-КоА, α-кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в реакции принимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS-KoA, ФАД и НАД + .
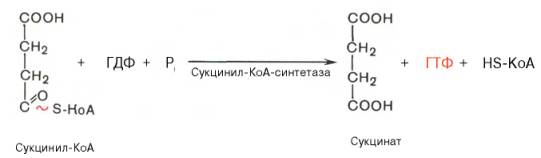
Пятая реакция катализируется ферментом сукцинил-КоА-синтета-зой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА:
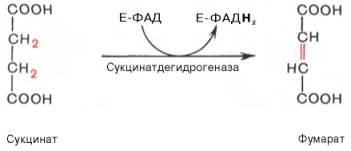
В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД. В свою очередь сукцинатдегидрогеназа прочно связана с внутренней ми-тохондриальной мембраной:
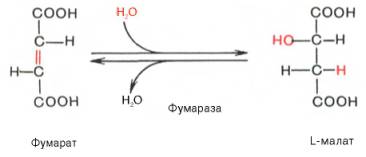
Седьмая реакция осуществляется под влиянием фермента фума-ратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью (см. главу 4) – в ходе реакции образуется L-яблочная кислота:
Наконец, в ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:
Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление («сгорание») одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД + и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов в дыхательной цепи (в цепи дыхательных ферментов), локализованной в мембране митохондрий. Образовавшийся ФАДН2 прочно связан с СДГ, поэтому он передает атомы водорода через KoQ. Освобождающаяся в результате окисления ацетил-КоА энергия в значительной мере сосредоточивается в макроэргических фосфатных связях АТФ. Из 4 пар атомов водорода 3 пары переносят НАДН на систему транспорта электронов; при этом в расчете на каждую пару в системе биологического окисления образуется 3 молекулы АТФ (в процессе сопряженного окислительного фосфорилирования), а всего, следовательно, 9 молекул АТФ (см. главу 9). Одна пара атомов от сукцинатдегидрогеназы-ФАДН2 попадает в систему транспорта электронов через KoQ, в результате образуется только 2 молекулы АТФ. В ходе цикла Кребса синтезируется также одна молекула ГТФ (субстратное фосфорилирование), что равносильно одной молекуле АТФ. Итак, при окислении одной молекулы ацетил-КоА в цикле Кребса и системе окислительного фосфорилирования может образоваться 12 молекул АТФ.
Если подсчитать полный энергетический эффект гликолитического расщепления глюкозы и последующего окисления двух образовавшихся молекул пирувата до СО2 и Н2О, то он окажется значительно большим.
Как отмечалось, одна молекула НАДН (3 молекулы АТФ) образуется при окислительном декарбоксилировании пирувата в ацетил-КоА. При расщеплении одной молекулы глюкозы образуется 2 молекулы пирувата, а при окислении их до 2 молекул ацетил-КоА и последующих 2 оборотов цикла трикарбоновых кислот синтезируется 30 молекул АТФ (следовательно, окисление молекулы пирувата до СО2 и Н2О дает 15 молекул АТФ). К этому количеству надо добавить 2 молекулы АТФ, образующиеся при аэробном гликолизе, и 6 молекул АТФ, синтезирующихся за счет окисления 2 молекул внемитохондриального НАДН, которые образуются при окислении 2 молекул глицеральдегид-3-фосфата в дегидрогеназной реакции гликолиза. Следовательно, при расщеплении в тканях одной молекулы глюкозы по уравнению С6Н12О6 + 6О2 —> 6СО2 + 6Н2О синтезируется 38 молекул АТФ. Несомненно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробный гликолиз.
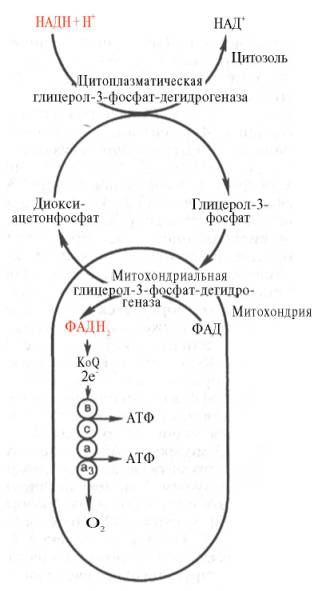
Необходимо отметить, что образовавшиеся в процессе превращения глицеральдегид-3-фосфата 2 молекулы НАДН в дальнейшем при окислении могут давать не 6 молекул АТФ, а только 4. Дело в том, что сами молекулы внемитохондриального НАДН не способны проникать через мембрану внутрь митохондрий. Однако отдаваемые ими электроны могут включаться в митохондриальную цепь биологического окисления с помощью так называемого глицеролфосфатного челночного механизма (рис. 10.10). Ци-топлазматический НАДН сначала реагирует с цитоплазматическим ди-гидроксиацетонфосфатом, образуя глицерол-3-фосфат. Реакция катализи-
Рис. 10.10. Глицеролфосфатный челночный механизм. Объяснение в тексте.
руется НАД-зависимой цитоплазматической глицерол-3-фосфат-дегидроге-назой:
Дигидроксиацетонфосфат + НАДН + Н + Глицерол-3-фосфат + НАД + .
Образовавшийся глицерол-3-фосфат легко проникает через митохонд-риальную мембрану. Внутри митохондрии другая (митохондриальная) глицерол-3-фосфат-дегидрогеназа (флавиновый фермент) снова окисляет глицерол-3-фосфат до диоксиацетонфосфата:
Глицерол-3-фосфат + ФАД Диоксиацетонфосфат + ФАДН2.
Восстановленный флавопротеин (фермент-ФАДН2) вводит на уровне KoQ приобретенные им электроны в цепь биологического окисления и сопряженного с ним окислительного фосфорилирования, а диоксиаце-тонфосфат выходит из митохондрий в цитоплазму и может вновь взаимодействовать с цитоплазматическим НАДН + Н + . Таким образом, пара электронов (из одной молекулы цитоплазматического НАДН + Н + ), вводимая в дыхательную цепь с помощью глицеролфосфатного челночного механизма, дает не 3, а 2 АТФ.
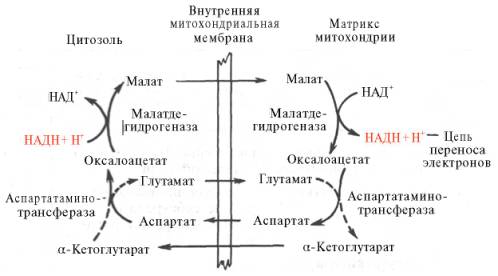
Рис. 10.11. Малат-аспартатная челночная система для переноса восстанавливающих эквивалентов от цитозольного НАДН в митохондриальный матрикс. Объяснение в тексте.
В дальнейшем было показано, что с помощью данного челночного механизма лишь в скелетных мышцах и мозге осуществляется перенос восстановленных эквивалентов от цитозольного НАДН + Н + в митохондрии.
В клетках печени, почек и сердца действует более сложная малат-ас-партатная челночная система. Действие такого челночного механизма становится возможным благодаря присутствию малатдегидрогеназы и ас-партатаминотрансферазы как в цитозоле, так и в митохондриях.
Установлено, что от цитозольного НАДН + Н + восстановленные эквиваленты сначала при участии фермента малатдегидрогеназы (рис. 10.11) переносятся на цитозольный оксалоацетат. В результате образуется малат, который с помощью системы, транспортирующей дикарбоновые кислоты, проходит через внутреннюю мембрану митохондрии в матрикс. Здесь малат окисляется в оксалоацетат, а матриксный НАД + восстанавливается в НАДН + Н + , который может теперь передавать свои электроны в цепь дыхательных ферментов, локализованную на внутренней мембране митохондрии. В свою очередь образовавшийся оксалоацетат в присутствии глутамата и фермента АсАТ вступает в реакцию трансаминирования. Образующиеся аспарат и α-кетоглутарат с помощью специальных транспортных систем способны проходить через мембрану митохондрий.
Транспортирование в цитозоле регенерирует оксалоацетат, что вызывает к действию следующий цикл. В целом процесс включает легкообратимые реакции, происходит без потребления энергии, «движущей силой» его является постоянное восстановление НАД + в цитозоле гли-церальдегид-3-фосфатом, образующимся при катаболизме глюкозы.
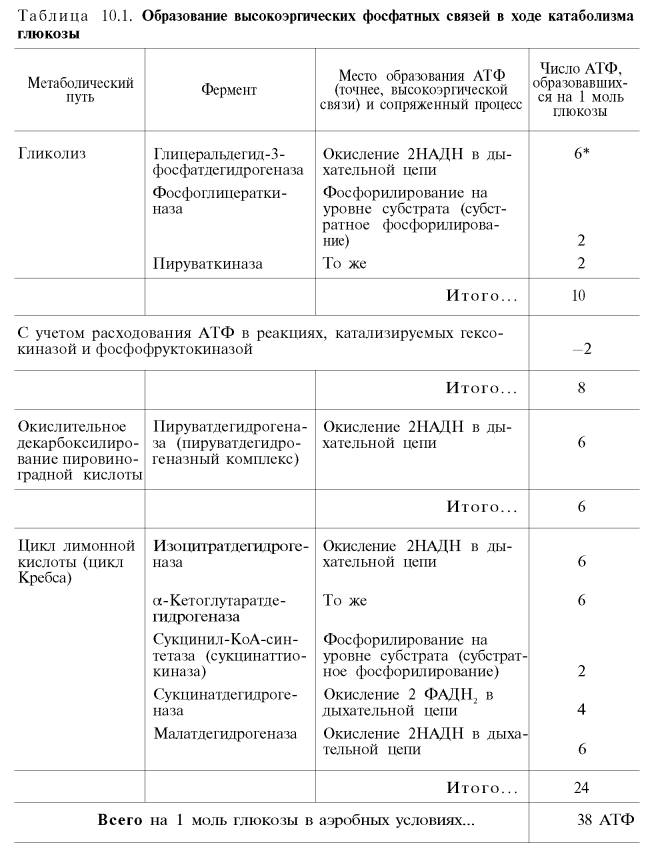
Итак, если функционирует малат-аспартатный механизм, то в результате полного окисления одной молекулы глюкозы может образоваться не 36, а 38 молекул АТФ (табл. 10.1).
В табл. 10.1 приведены реакции, в которых происходит образование высокоэргических фосфатных связей в ходе катаболизма глюкозы, с указанием эффективности процесса в аэробных и анаэробных условиях.
- Суммарное уравнение цикла Кребса
- Цикл трикарбоновых кислот Кребса: последовательность реакций, суммарное уравнение, регуляция работы цикла и его биологическая роль
- Реакции цикла Кребса
- Цикл трикарбоновых кислот
- Цикл Кребса
- Функции цикла Кребса
- Цикл трикарбоновых кислот Кребса реакции (Схема)
- Схема цикл трикарбоновых кислот, цикл Кребса
- Таблица реакции цикла трикарбоновых кислот Кребса
- 🎦 Видео
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Суммарное уравнение цикла Кребса
Видео:65. Что такое реакция гидратации и реакция дегидратацииСкачать

Цикл трикарбоновых кислот Кребса: последовательность реакций, суммарное уравнение, регуляция работы цикла и его биологическая роль
Цикл трикарбоновых кислот Кребса — это высокоорганизованная циклическая система взаимопревращений ди- и трикарбоновых кислот, катализируемых мультиферментным комплексом. Он составляет основу клеточного метаболизма.
Этот метаболический путь является замкнутым его началом считается цитратсинтазная реакция в ходе которой конденсация Ацетил-КоА и оксалоацитата дает цитрат. Далее следует реакция отщепление воды катализируемая ферментом аконитазой продуктом реакции является цис-аконитовая кислота. Этот же фермент (аконитаза) катализирует реакцию гидратации в итоге образуется изомер изоцитрат.
Окислител. реакция кот катализируется ферментом изоцитратдегидрогиназа дает а-кетоглутаровую кислоту. В ходе реакции отщепляется СО2, Е окислительного превращения аккумулируется в восстановленном НАД. Далее а-кетоглютаровая кислота под действием а-кетоглюторатдегидрогиназного комплекса превращается в сукценил-КоА. Сукцинил-КоА-Фермент катализирует реакцию в ходе которой из ГДФ и фосфорной кислоты образуется ГТФ(АТФ)и отщепляется фермент сукцинаттиокиназа.
В итоге образуется янтарная кислота – сукцинат. Сукцинат далее вступает вновь в реакцию окисления с участием фермента сукцинатдегидрогиназы. Это ФАД зависимый фермент. сукцинат окисляется с образованием фумаровой кислоты. Происходит немедленное присоединение воды с участием фермента фумаразы и образуется малат (яблочная кислота).
Малат, с участием малатдегидрогиназы содержащий НАД, окисляется в итоге образуется ЩУК т е происходит регенерация первого продукта ЩУК может снова вступать в реакцию конденсации с ацетил-КоА с образованием лимонной. СНЗ-С + ЗНАД + ФАД + ГДФ + НЗРО4 + 2Н2О -> 2СО2 + ЗНАДН+Н* + ФАДН2 + ГТФ + HSKoA
Главная роль ЦТК – образование большого количества АТФ.
1. ЦТК — главный источник АТФ. Е, образ. большим количеством, АТФ дает полный распад Ацетил-КоА до СО2 и Н2О.
2. ЦТК — это универсальный терминальный этап катаболизма веществ всех классов.
3. ЦТК играет важную роль в процессах анаболизма (промежуточные продукты ЦТК): — из цитрата -> синтез жирных кислот; — из aльфа-кетоглутарата и ЩУК —> синтез аминокислот; — из ЩУК -> синтез углеводов; — из сукцинил-КоА —> синтез гема гемоглобина
Биологическое окисление как главный путь расщепления питательных веществ в организме, его функции в клетке. Особенности биологического окисления в сравнении с окислительными процессами в небиологических объектах. Способы окисления веществ в клетках; ферменты, катализирующие окислительные реакции в организме.
Биол. окисление как главный путь расщепления питательных веществ. Его функции в клетке. Ферменты, катализирующие окислительные реакции в организме.
Биологическое окисление(БО) — это совокупность окислит. процессов в живом организме, протекающих с обязательным участием кислорода. Синоним – тканевое дыхание. Окисление одного вещества невозможно без восстановления другого вещества.
Важнейшей функцией БО является высвобождение Е, заключенной в хим. связях питательных веществ. Выделяющееся Е используется для осущ-ния энергозависимых процессов, протекающ. в клетках, а также для поддержания температуры тела. Второй функцией БО является пластическая: в ходе расщепления питательных веществ образуются низкомолекулярные промежуточные продукты, используемые в дальнейшем для биосинтезов.
Например, при окислительном распаде глюкозы образуется ацетилКоА, который далее может пойти на синтез холестерола или высших жирных кислот. Третьей функцией БО является генерация восстановительных потенциалов, которые в дальнейшем используются в восстановительных биосинтезах.
Главным источником восстановительных потенциалов в биосинтетических реакциях клеточного метаболизма является НАДФН+Н+, образующийся из НАДФ+ за счет атомов водорода, переносимых на него в ходе некоторых реакций дегидрирования. Четвертая функция БО участие в процессах детоксикации,т.е. обезвреживания ядовитых соединений или поступающих из внешней среды, или образующихся в организме.
Различные соединения в клетках могут окисляться тремя способами:
1. путем дегидрирования. Принято различать два вида дегидрирования: аэробное и анаэробное. если первичным акцептором отщепляемых атомов водорода служит кислород, дегидрирование является аэробным; если же первичным акцептором отщепляемых атомов водорода служит какое-либо другое соединение, дегидрирование является анаэробным. Примерами таких соединений акцепторов водорода могут служить НАД , НАДФ , ФМН, ФАД, окисленный глутатион ( ГSSГ ), дегидроаскорбиновая кислота и др.
2. Путем присоединения к молекулам окисляемого вещества кислорода, т.е. путем оксигенирования.
3. Путем отдачи электронов. Все живые организмы принято делить на организмы аэробные и организмы анаэробные. Аэробные организмы нуждаются в кислороде, который ,во-первых, используется в реакциях оксигенирования, во-вторых, служит конечным акцептором атомов водорода, отщепленных от окисляемого субстрата. Причем, около 95% всего поглощаемого кислорода служит конечным акцептором атомов водорода, отщепленных в ходе окисления от различных субстратов, и лишь 5% поглощаемого кислорода участвует в реакциях оксигенации.
Все ферменты, участвующие в катализе ОВР в организме относятся к классу оксидоредуктаз. В свою очередь, все ферменты этого класса могут быть разделены на 4 группы:
1. Ферменты, катализир. реакции дегидрирования или дегидрогеназы.
а). Аэробные дегидрогеназы или оксидазы. б). Анаэробные дегидрогеназы с типовой реакцией:
2.Ферменты, катализир. реакции оксигенирования или оксигеназы. а). Монооксигеназы б). Диоксигеназы
3. Ферменты, катализирующие отщепление электронов от окисляемых субстратов. называются цитохромы. 4.К оксидоредуктазам относится также группа вспомогательных ферментов, таких как каталаза или пероксидаза. Они играют защитную роль в клетке, разрушая перекись водорода или органические гидроперекиси, образующиеся в ходе окислительных процессов и представляющие собой достаточно агрессивные соединения, способные повреждать клеточные структуры.
НАД- и ФАД- зависимые анаэробные дегидрогеназы, их важнейшие субстраты. Главная цепь дыхательных ферментов в митохондриях, ее структурная организация. Разность редокс-потенциалов окисляемых субстратов и кислорода как движущая сила для перемещения электронов в дыхательной цепи. Энергетика переноса электронов в дыхательной цепи.
Главная цепь дыхательных ферментов в митохондриях, ее структурная организация и биологическая роль. Цитохромы, цитохромоксидаза, химическая природа и роль в окислительных процессах.
В ходе многочисленных реакций дегидрирования, происходящих как во второй фазе катаболизма, так и в цикле Кребса, образуются восстановленные формы коферментов:НАДН+Н+ и ФАДН2. Эти реакции катализируются многочисленными пиридинзависимыми и флавинзависимыми дегидрогеназами.
В то же время пул коферментов в клетке ограничен, поэтому восстановленные формы коферментов должны «разряжаться», т.е. передавать полученные атомы водорода на другие соединения с тем, чтобы в конечном итоге они были переданы у аэробных организмов на свой конечный акцептор кислород. Этот процесс «разрядки» или окисления восстановленных НАДН+Н+ и ФАДН2 выполняет метаболический путь, известный под названием главная цепь дыхательных ферментов. Она локализована во внутренней мембране митохондрий.
Главная цепь дыхательных ферментов состоит из 3 сложных надмолекулярнных белковых комплексов, катализирующих последовательную передачу электронов и протонов с восстановленного НАДН+Н на кислород:
Первый надмолекулярный комплекс катализирует перенос 2 электронов и 2 протонов с восстановленного НАДН+Н+ на КоQ с образованием восстановленной формы последнего КоQH2. В состав надмолекулярного комплекса входит около 20 полипептидных цепей, в качестве простетических групп некоторых из них входит молекула фламинмононуклеотида(ФМН) и один или несколько так называемых железосерных центров (FeS)n. Электроны и протоны с НАДН+Н+вначале переносятся на ФМН с образованием ФМНН2, затем электроны с ФМНН2 переносятся через железосерные центры на КоQ, после чего к КоQ присоединяются протоны с образованием его восстановленной формы:
Следующий надмолекулярный комплекс также состоит из нескольких белков: цитохрома b, белка, имеющего в своем составе железосерный центр и цитохрома С1. В состав любого цитохрома входит геминовая группировка с входящим в неё атомом железа элемента с переменной валентностью, способного и принимать электрон, и отдавать его. Начиная с КоQН2 пути электронов и протонов расходятся. Электроны с КоQН2 передаются по цепи цитохромов, причем одновременно по цепи передается по 1 электрону, а протоны с КоQН2 уходят в окружающую среду.
Цитохром С оксидазный комплекс состоит из двух цитохромов:цитохрома а и цитохрома а3. Цитохром а имеет в своем составе геминовую группировку, а цитохром а3 кроме геминовой группировки в своем составе содержит еще и атом Cu. Электрон при участии этого комплекса переносится с цитохрома С на кислород.
НАД+ , КоQ и цитохром С не входят в состав ни одного из описанных комплексов. НАД+ служит коллектором-переносчиком протонов и электронов с большого ряда окисляемых в клетках субстратов. Функцию коллектора электронов и протонов выполняет также КоQ, принимая их с некоторых окисляемых субстратов (например, с сукцината или ацилКоА) и передавая электроны на систему цитохромов с выводом протоны в окружающую среду. Цитохром С также может принимать электроны непосредственно с окисляемых субстратов и передавать их далее на четвертый комплекс ЦДФ. Так, при окислении сукцината работает сукцинат-КоQ-оксидаредуктазный комплекс (Комплекс II), передающий протоны и электроны с сукцината непосредственно на КоQ, минуя НАД+:
Для того, чтобы молекула кислорода превратилась в 2 иона О2, на нее должны быть перенесены 4 электрона. Принято считать, что по цепи переносчиков электронов последовательно переносится 4 электрона с двух молекул НАДН+Н+ и до принятия всех четырех электронов молекула кислорода остается связанной в активном центре цитохрома а3. После принятия 4 электронов два иона О2 связывают по два протона каждый, образуя таким образом 2 молекулы воды.
В цепи дыхательных ферментов используется основная масса поступающего в организм кислорода до 95%. Мерой интенсивности процессов аэробного окисления в той или иной ткани служит дыхательный коэффициент ( QO2 ), который обычно выражается в количестве микролитров кислорода, поглощенных тканью за 1 час в расчете на 1 мг сухого веса ткани ( мкл.час1.мг1 ). Для миокарда он равен 5, для ткани надпочечников 10, для ткани коркового вещества почек 23, для печени 17, для кожи 0,8. Поглощение кислорода тканями сопровождается одновременным образованием в них углекислоты и воды. Этот процесс поглощения тканями О2 с одновременным выделением СО2 получил название тканевое дыхание.
Окислительное фосфорилирование как механизм аккумуляции энергии в клетке. Окислительное фосфорилирование в цепи дыхательных ферментов. Коэффициент Р/О. Окислительное фосфорилирование на уровне субстрата, его значение для клетки. Ксенобиотики-ингибиторы и разобщители окисления и фосфорилирования.
Окислительное фосфорилирование — один из важнейших компонентов клеточного дыхания, приводящего к получению энергии в виде АТФ. Субстратами окислительного фосфорилирования служат продукты расщепления органических соединений — белки, жиры и углеводы.
Однако чащевсего в качестве субстрата используются углеводы. Так, клетки головного мозга не способны использовать для дыхания никакой другой субстрат, кроме углеводов.
Предварительно сложные углеводы расщепляются до простых, вплоть до образования глюкозы. Глюкоза является универсальным субстратом в процессе клеточного дыхания.
Окисление глюкозы подразделяется на 3 этапа:
1.гликолиз;
2.окислительное декарбоксилирование или цикл Кребса;
3.окислительное фосфорилирование.
При этом гликолиз является общей фазой для аэробного и анаэробного дыхания.
Мерой эффективности процесса окислительного фосфорилирования в цепи дыхательных ферментов служит коэффициент Р/О; количество атомов фосфора, включенных из неорганического фосфата в состав АТФ, в расчете на 1 связанный атом кислорода, пошедший на образование воды в ходе работы дыхательной цепи. При окислении НАДН+Н+ он равен 3, при окислении ФАДН2( КоQН2) он составляет 2 и при окислении восстановленного цитохрома С он равен 1.
Ингибиторы окислительного фосфорилирования.Ингибиторы блокируют V комплекс:
1.Олигомицин — блокируют протонные каналы АТФ-синтазы.
2.Атрактилозид, циклофиллин — блокируют транслоказы.
Цикл трикарбоновых кислот впервые был открыт английским биохимиком Кребсом. Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов.
В дальнейшем было показано, что цикл трикарбоновых кислот является «фокусом», в котором сходятся практически все метаболические пути.
Итак, образовавшийся в результате окислительного декарбоксилирования пирувата ацетил-КоА вступает в цикл Кребса. Данный цикл состоит из восьми последовательных реакций (рис.
91). Начинается цикл с конденсации ацетил-КоА с оксалоацетатом и образования лимонной кислоты. (Как будет видно ниже, в цикле окислению подвергается собственно не ацетил-КоА, а более сложное соединение — лимонная кислота (трикарбоновая кислота).)
Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и дскарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса появляется оксалоацетат (четырехуглеродное соединение), т. е. в результате полного оборота цикла молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула оксалоацетата регенерируется. Ниже приводятся все восемь последовательных реакций (этапов) цикла Кребса.
В первой реакции, катализируемой ферментом цитратсинтазой, ацетил-КоА конденсируется с оксалоацетатом.
В результате образуется лимонная кислота:
По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментом цитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA.
Во второй реакции цикла образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту.
Катализирует эти обратимые реакции гидратации-дегидратации фермент аконитат-гидратаза:
В третьей реакции, которая, по-видимому, лимитирует скорость цикла Кребса, изолимонная кислота дегидрируется в присутствии НАД-зависимой изоцитратдегидрогеназы:
(В тканях существует два типа изоцитратдегидрогеназ: НАД- и НАДФ-зависимые.
Установлено, что роль основного катализатора окисления изолимонной кислоты в цикле Кребса выполняет НАД-зависимая изоцитратдегидрогеназа.)
В ходе изоцитратдегидрогеназной реакции изолимонная кислота декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg2+ или Мn2+.
В четвертой реакции происходит окислительное декарбоксилирование α-кетоглутаровой кислоты до сукцинил-КоА. Механизм этой реакции сходен с реакцией окислительного декарбоксилирования пирувата до ацетил-КоА. α-Кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в ходе реакции принимают участие пять коферментов: TДФ, амид липоевой кислоты, HS-KoA, ФАД и НАД.
Суммарно данную реакцию можно написать так:
Пятая реакция катализируется ферментом сукцинил-КоА-синтетазой. В ходе этой реакции сукцинил-КоА при участии ГДФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ1 за счет высокоэргической тиоэфирной связи сукцинил-КоА:
(Образовавшийся ГТФ отдает затем свою концевую фосфатную группу на АДФ, вследствие чего образуется АТФ.
Образование высокоэргического нуклеозидтрифосфата в ходе сукцинил-КоА-синтетазной реакции — пример фосфорилирования на уровне субстрата.)
В шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком ковалентно связан кофермент ФАД:
В седьмой реакции образовавшаяся фумаровая кислота гидратируется под влиянием фермента фумаратгидратазы.
Продуктом данной реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью, — в ходе данной реакции образуется L-яблочная кислота:
Наконец, в восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:
Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление («сгорание») одной молекулы ацетил-КоА.
Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов (или в цепи дыхательных ферментов), локализованной в митохондриях.
Освобождающаяся в результате окисления ацетил-КоА энергия в значительной мере сосредоточивается в макроэргических фосфатных связях АТФ.
Из четырех пар атомов водорода три пары переносятся через НАД на систему транспорта электронов; при этом в расчете на каждую пару в системе биологического окисления образуются три молекулы АТФ (в процессе сопряженного окислительного фосфорилирования), а всего, следовательно, девять молекул АТФ. Одна пара атомов попадает в систему транспорта электронов через ФАД, — в результате образуются 2 молекулы АТФ. В ходе реакций цикла Кребса синтезируется также 1 молекула ГТФ, что равносильно 1 молекуле АТФ.
Итак, при окислении ацетил-КоА в цикле Кребса образуется 12 молекул АТФ.
Если же подсчитать энергетический эффект гликолитического расщепления глюкозы и последующего окисления пирувата до СO2 и Н2O, то он окажется значительно большим.
Как уже отмечалось, 1 молекула НАДН2 (3 молекулы АТФ) образуется при окислительном декарбоксилирова-нии пирувата в ацетил-КоА. Так как при расщеплении одной молекулы глюкозы образуются две молекулы пирувата, то при окислении их до 2 молекул ацетил-КоА и последующих двух оборотов цикла трикарбоновых кислот синтезируется 30 молекул АТФ (следовательно, окисление одной молекулы пирувата до СО2 и Н2O дает 15 молекул АТФ).
К этому надо добавить 2 молекулы АТФ, образующиеся при аэробном гликолизе, и 4 молекулы АТФ, синтезирующихся за счет окисления 2 молекул внемитохондриального НАДН2, которые образуются при окислении 2 молекул глицеральдегид-3-фосфата в дегидрогеназной реакции.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Реакции цикла Кребса
Итого получим, что при расщеплении в тканях 1 молекулы глюкозы по уравнению: C6H1206 + 602 -> 6СO2 + 6Н2O синтезируется 36 молекул АТФ, что способствует накоплению в макроэргических фосфатных связях аденозинтрифосфата 36 X 34,5
1240 кДж (или, по другим данным, 36 Х 38
1430 кДж) свободной энергии.
Другими словами, из всей освобождающейся при аэробном окислении глюкозы свободной энергии (окодо 2840 кДж) до 50% ее аккумулируется в митохондриях в форме, которая может быть использована для выполнения различных физиологических функций.
Несомненно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем гликолиз. Необходимо отметить, что образовавшиеся в процессе превращения глицеральдегид-3-фосфата 2 молекулы НАДН2 в дальнейшем при окислении дают не 6 молекул АТФ, а только 4. Дело в том, что сами молекулы внемитохондриального НАДН2 не способны проникать через мембрану внутрь митохондрий.
Однако отдаваемые ими электроны могут включаться в митохондриальную цепь биологического окисления с помощью так называемого глицерофосфатного челночного механизма (рис. 92). Как видно на рисунке, цитоплазматический НАДН2 сначала реагирует с цитоплазматическим дигидроксиацетонфосфатом, образуя глицерол-3-фосфат. Реакция катализируется НАД-зависимой цитоплазматической глицерол-3-фосфат-дегидрогеназой:
Дигидрооксиацетонфосфат + НАДН2 глицерол-3-фосфат + НАД
Образовавшийся глицерол-3-фосфат легко проникает через митохондриальную мембрану.
Внутри митохондрии другая (митохондриальная) глицерол-3-фосфат-дегидрогеназа (флавиновый фермент) снова окисляет глицерол-3-фосфат до дигидроксиацетонфосфата:
Глицерол-З-фосфат + ФАД Дигидроксиацетонфосфат + фАДН2
Восстановленный флавопротеид (фермент — ФАДН2) вводит, на уровне KoQ приобретенные им электроны в цепь биологического окисления и сопряженного с ним окислительного фосфорилирования, а дигидроксиацетонфосфат выходит из митохондрий в цитоплазму и может вновь взаимодействовать с цитоплазматическим НАДН2.
Таким образом, пара электронов (из одной молекулы цитоплазматического НАДН2), вводимая в дыхательную цепь с помощью глицерофосфатного челночного механизма, дает не 3 АТФ, а 2 АТФ.
В настоящее время четко установлено, что глицерофосфатный челночный механизм имеет место в клетках печени.
Относительно других тканей этот вопрос пока не выяснен.
Если же не считать энергии, затрачиваемой на проникновение НАДН2 в митохондрии, то в результате полного окисления 1 молекулы глюкозы может образоваться 38 молекул АТФ.
Видео:ЛЕКЦИЯ 2. КИСЛОТЫСкачать

Цикл трикарбоновых кислот
Реакции гликолиза идут в цитозоле и в хлоропластах. Есть три этапа гликолиза:
1 — подготовительный (фосфорилирование гексозы и образование двух фосфотриоз);
2 — первое окислительное субстратное фосфорилирование;
3 — второе внутримолекулярное окислительное субстратное фосфорилирование.
Сахара подвергаются метаболическим превращениям в виде сложных эфиров фосфорной кислоты.
Глюкоза предварительно активируется путем фосфорилирования. В АТФ-зависимой реакции, катализируемой гексокиназой, глюкоза превращается в глюкозо-6-фосфат. После изомеризации глюкозо-6-фосфата в фруктозо-6-фосфат последний вновь фосфорилируется с образованием фруктозо-1,6-дифосфата. Фосфофруктокиназа, катализирующая эту стадию, является важным ключевым ферментом гликолиза.
Таким образом, на активацию одной молекулы глюкозы расходуются две молекулы АТФ. Фруктозо-1,6-дифосфат расщепляется альдолазой на два фосфорилированных С3-фрагмента. Эти фрагменты — глицеральдегид-3-фосфат и дигид- роксиацетонфосфат — превращаются один в другой триозофосфатизомеразой.
Глицеральдегид-3-фосфат окисляется глицеральдегид-З-фосфатдегид- рогеназой с образованием НАДН + Н+.
В этой реакции в молекулу включается неорганический фосфат с образованием 1,3-дифосфоглицерата. Такое промежуточное соединение содержит смешанную ангидридную связь, расщепление которой является высокоэкзоэргическим процессом. На следующей стадии, катализируемой фосфоглицераткиназой, гидролиз этого соединения сопряжен с образованием АТФ.
Следующий промежуточный продукт, гидролиз которого может быть сопряжен с синтезом АТФ, образуется в реакции изомеризации 3- фосфоглицерата, полученного в результате реакции окисления 3ФГА, в 2- фосфоглицерат (фермент фосфоглицератмутаза) и последующего отщепления воды (фермент энолаза).
Продукт представляет собой сложный эфир фосфорной кислоты и энольной формы пирувата и потому называется фосфоэнолпируватом (ФЭП). На последней стадии, которая катализируется пируваткиназой, образуются пируват и АТФ.
Наряду со стадией окисления ФГА и тиокиназной реакцией в цитратном цикле это третья реакция, позволяющая клеткам синтезировать АТФ, независимо от дыхательной цепи.
Несмотря на образование АТФ, она высоко-экзоэргична и потому необратима.
В результате гликолиза из одной молекулы глюкозы образуется 2 молекулы пировиноградной кислоты и 4 молекулы АТФ. Поскольку макроэргическая связь формируется прямо на окисляемом субстрате, такой процесс образования АТФ получил название субстратного фосфорилирования.
Две молекулы АТФ покрывают расход на первоначальное активирование субстрата за счет фосфорилирования. Следовательно, накапливаются 2 молекулы АТФ. Кроме того, в ходе гликолиза 2 молекулы НАД восстанавливаются до НАДН. В процессе гликолиза молекула глюкозы деградирует до двух молекул пирувата.
Кроме того, образуется по две молекулы АТФ и НАДН + H+ (аэробный гликолиз).
В анаэробных условиях пируват претерпевает дальнейшие превращения, обеспечивая при этом регенерацию НАД+. При этом образуются продукты брожения, такие, как лактат или этанол (анаэробный гликолиз). В этих условиях гликолиз является единственным способом получения энергии для синтеза АТФ из АДФ и неорганического фосфата. В аэробных условиях образовавшиеся 2 молекулы пировиноградной кислоты вступают в аэробную фазу дыхания.
Видео:Карбоновые кислоты. Химические свойства. Все 25 реакций ЕГЭ.Скачать

Цикл Кребса
Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса.
Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата).
Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двух декарбоксилирований (отщепление CO2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е.
в результате полного оборота цикла одна молекула ацетил-КоА сгорает до CO2 и Н2O , а молекула оксалоацетата регенерируется. В ходе реакций цикла освобождается основное количество энергии, содержащейся в окисляемом субстрате, причем большая часть этой энергии не теряется для организма, а утилизируется при образовании высокоэнергетических конечных фосфатных связей АТФ.
При окислении глюкозы в процессе дыхания при функционировании гликолиза и цикла Кребса в общей сложности образуются 38 молекул АТФ.
У растений существует иной путь переноса электронов на кислород. Этот путь не ингибируется цианидом и поэтому назван цианидустойчивым, или альтернативным. Цианидустойчивое дыхание связано с функционированием в дыхательной цепи помимо цитохромоксидазы альтернативной оксидазы, которая впервые была выделена в 1978 г.
При этом пути дыхания энергия в основном не аккумулируется в АТФ, а рассеивается в виде тепла. Ингибируется цианидустойчивое дыхание салициловой кислотой. У большинства растений цианидустойчивое дыхание составляет 10—25%, но иногда может достигать 100% общего поглощения кислорода. Это зависит от вида и условий произрастания растений. Функции альтернативного дыхания до конца не ясны. Этот путь активируется при высоком содержании АТФ в клетке и ингибировании работы основной цепи транспорта электронов при дыхании.
Предполагают, что цианидустойчивый путь играет роль при действии неблагоприятных условий. Доказано, что альтернативное дыхание принимает участие в образовании тепла. Рассеивание энергии в виде тепла может обеспечивать повышение температуры растительных тканей на 10—15°С выше температуры окружающей среды.
Для объяснения механизма синтеза АТФ, сопряженного с транспортом электронов в ЭТЦ дыхания, были предложены несколько гипотез:
- химическая (по аналогии с субстратным фосфорилированием);
- механохимическая (основанная на способности митохондрий изменять объем);
- хемиосмотическая (постулирующая промежуточную форму трансформации энергии окисления в виде трансмембранного протонного градиента).
Процесс образования АТФ в результате переноса ионов Н через мембрану митохондрии получил название окислительного фосфолирования.
Он осуществляется при участии фермента АТФ-синтетазы. Молекулы АТФ-синтетазы располагаются в виде сферических гранул на внутренней стороне внутренней мембраны митохондрий.
В результате расщепления двух молекул пировиноградной кислоты и переноса ионов водорода через мембрану по специальным каналам синтезируется в целом 36 молекул АТФ (2 молекулы в цикле Кребса и 34 молекулы в результате переноса ионов Н через мембрану).
Суммарное уравнение аэробного дыхания можно выразить следующим образом:
C6H12O6 + O2+ 6H2O + 38АДФ + 38Н3РО4→
6CO2+ 12H2O + 38АТФ
Н+-транслоцирующая АТФ-синтаза состоит из двух частей: встроенного в мембрану протонного канала (F0) из по меньшей мере 13-ти субъединиц и каталитической субъединицы (Fi), выступающей в матрикс.
«Головка» каталитической части образована тремя+ — и тремя- субъединицами, между которыми расположены три активных центра.
«Ствол» структуры образуют полипептиды Fo-части и у-, 5- и s-субъединиц «головки».
Каталитический цикл подразделяется на три фазы, каждая из которых проходит поочередно в трех активных центрах. Вначале идет связывание АДФ (ADP) и Pi, затем образуется фосфоангидридная связь и наконец освобождается конечный продукт реакции.
При каждом переносе протона через белковый канал F0 в матрикс все три активных центра катализируют очередную стадию реакции. Предполагается, что энергия протонного транспорта прежде всего расходуется на повороту -субъединицы, в результате которого циклически изменяются конформации а- и в-субъединиц.
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Функции цикла Кребса
1.Водороддонорная функция. Цикл Кребса поставляет субстраты для дыхательной цепи (НАД-зависимые субстраты: изоцитрат, -кетоглутарат, малат; ФАД-зависимый субстрат – сукцинат).
2.Катаболическая функция. В ходе ЦТК окисляются до конечных продуктов обмена
ацетильные остатки, образовавшиеся из топливных молекул (глюкоза, жирные кислоты, глицерол, аминокислоты).
Субстраты ЦТК являются основой для синтеза многих молекул (кетокислоты — α-кетоглутарат и ЩУК — могут превращаться в аминокислоты глу и асп; ЩУК может превращаться в глюкозу, сукцинил-КоА используется на синтез гема).
4.Анаплеротическая функция. Цикл не прерывается благодаря реакциям анаплероза (пополнения) фонда его субстратов. Важнейшей анаплеротической реакцией является образование ЩУК (молекулы, запускающей цикл) путем карбоксилирования ПВК.
Видео:Химические свойства КИСЛОТ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием кислотСкачать

Цикл трикарбоновых кислот Кребса реакции (Схема)
Цикл трикарбоновых кислот (Цикл Кребса или цикл лимонной кислоты) — центральный процесс метаболизма. Суть процесса состоит в том, что первоначально пировиноградная кислота соединяется со сложным органическим веществом — коэнзимом А. При этом сразу отщепляется СО2, образуется НАД • Н и комплекс СН3СО—5—коэнзим А (ацетил-коэнзим А). Этот комплекс реагирует со щавелево-уксусной кислотой с образованием кислоты лимонной. Коэнзим А освобождается, а лимонная кислота подвергается последовательным превращениям в цикле Кребса (8 реакций). При этом получается 2 молекулы СО2, восстанавливается молекула щавелево-уксусной кислоты, а выделяющаяся энергия запасается в виде АТФ. В пересчете на одну молекулу глюкозы энергетический выход цикла Кребса составляет 30 молекул АТФ. Таким образом, суммарный энергетический выход всего процесса дыхания составляет 38 молекул АТФ на одну молекулу глюкозы. Часть образующейся энергии выделяется в виде тепла (44,6%). Цикл Кребса идет только в присутствии необходимого количества кислорода. Этот цикл открыл Г. Кребс, за которое он в 1953 году получил Нобелевскую премию.
Схема цикл трикарбоновых кислот, цикл Кребса
ATP (АТФ) — это аденозинтрифосфорная кислота, универсальный источник и переносчик энергии
NAD (НАД) — никотинамидадениндинуклеотидфосфата, кофермент
NADH (НАД•Н) — востановленная форма NAD
Ацетил-КоА — сложное органическое вещество ацетил-коэнзим А (СН3СО—S)
Пируват — это соли пировиноградной кислоты
Таблица реакции цикла трикарбоновых кислот Кребса
Цикл Кребса это аэробный процесс (проходит с участием кислорода) и состоит из восьми стадий (процессов).
Реакции цикла трикарбоновых кислот (цикла Кребса)
Описание и ход реакция цикла
Конденсация ацетил-КоА с оксалоацетатом
Конденсация ацетил-СоА с оксалоацетатом, в результате чего образуется цитрат (лимонная кислота), а кофермент А освобождается. Реакция катализируется цитратсинтазой, которая является одним из регуляторных ферментов, лимитирующих скорость цикла Кребса.
Изомеризация цитрата в изоцитрат
Превращение цитрата в изоцитрат (изолимонная кислота) с участием аконитат-гидратазы (сложного фермента, содержащего Fe 2+ и кислотолабильные атомы серы, образующие железо-серные центры) через промежуточную стадию цис-аконитата, связанного с ферментом.
Окислительное декарбоксилирование изоцитрата
Дегидрирование (так называется удаление из молекулы атомов водорода) цитрата с образованием a-кетоглутарата и СO2 при участии изоцитратдегидрогеназы, которая функционирует при наличии Mg 2+ и Мn 2+ .
Окислительное декарбоксилирование а-кетоглутарата
Реакция окислительного декарбоксилирования a-кетоглутарата до высокоэнергетического сукцинил-СоА. Реакция катализируется a-кетоглутаратдегидрогеназным комплексом (Mg 2+ ), который похож на пируватдегидрогеназный комплекс.
коферменты: ТПФ, липоевая кислота, ФАД, HS-KoA, НАД+
На этом этапе цикла Кребса происходит превращение сукцинил-СоА под влиянием сукцинил-СоА-синтетазы в сукцинат (янтарная кислота) с отщеплением СоА. Эта реакция сопряжена с образованием гуанозинтрифосфата (GTP) из GDP и фосфата и также катализируется указанным ферментом.
Катализируемое сукцинатдегидрогеназой, содержащей ковалентно связанный FAD и два железо-серных центра, дегидрирование сукцината с образованием фумарата (фумаровая кислота).
Эта реакция цикла трикарбоновых кислот представляет обратимую гидратацию фумарата с образованием L-малата (яблочная кислота), катализируемая фумарат-гидратазой или фумаразой.
Катализируемое NAD-зависимой L-малатдегидрогеназой дегидрирование L-малата с образованием оксалоацетата. Эта реакция замыкает цикл Кребса и поставляет оксалоацетат (щавелевоянтарная кислота) для нового цикла. Большинство реакций цикла Кребса обратимы.
_______________
Источник информации:
1. Биология для поступающих в вузы / Г.Л. Билич, В.А. Крыжановский. — 2008.
2. Биохимия в схемах и таблицах / И. В. Семак — Минск — 2011.
🎦 Видео
11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать

Органика. Механизм реакции этерификации (карбоновая кислота + спирт)Скачать

Гидролиз за 15 секунд!🔥❤️🔥#химия #егэ. [ChemToday]Скачать
![Гидролиз за 15 секунд!🔥❤️🔥#химия #егэ. [ChemToday]](https://i.ytimg.com/vi/IqQ8azfmTGs/0.jpg)
РЕАКЦИЯ ЭТЕРИФИКАЦИИСкачать

Льем воду в кислоту. Шок контент. Химия – ПростоСкачать

25. Схема реакции и химическое уравнениеСкачать

Гидролиз примерСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

ЛЕКЦИЯ 1.2. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ. КИСЛОТНОСТЬ-ОСНОВНОСТЬСкачать
78. Что такое реакции полимеризацииСкачать

СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Щелочной гидролиз дигалогеналканов 🫣 #егэ2023 #химия #соткаСкачать

Реакции кислот-окислителей со сложными веществами: как понять? | Химия ЕГЭ 2022 | УмскулСкачать