Фторид натрия — соль щелочного металла натрия и плавиковой кислоты. Белое вещество, плавится без разложения. Умеренно растворяется в воде (гидролиз по аниону), растворимость мало зависит от температуры.
Относительная молекулярная масса Mr = 41,99; относительная плотность тв. и ж. вещества d = 2,558; tпл = 997º C;
Видео:Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Способ получения
1. Фторид натрия можно получить путем взаимодействия при комнатой температуре натрия и фтора:
2Na + F2 = 2NaF
2. В результате взаимодействия разбавленной плавиковой кислоты и гидроксида натрия, образуется фторид натрия и вода:
NaOH + HF = NaF + H2O
Видео:Опыты по химии. Реакция нейтрализацииСкачать

Качественная реакция
Качественная реакция на фторид натрия — взаимодействие его с хлоридом кальция, в результате реакции происходит выпадение белого осадка:
1. При взаимодействии с хлоридом кальция , фторид натрия образует фторид кальция и хлорид натрия:
2NaF + CaCl2 → 2NaCl + CaF2↓
Видео:Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

Химические свойства
1. Фторид натрия вступает в реакцию со сложными веществами :
1.1. Фторид натрия вступает во взаимодействие с концентрированными кислотами .
При кипении в результате взаимодействия с концентрированной серной кислотой фторид натрия образует сульфат натрия и газ фтороводород:
1.2. В реакции с насыщенным гидроксидом лития фторид натрия образует гидроксид натрия и фторид лития:
Видео:Распознавание растворов хлорида бария, сульфата натрия и серной кислотыСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Химимческие и физические свойства фтороводорода и фторидов металловЗадача 819. В растворе плавиковой кислоты выделения фторида кремния не происходит, так как он взаимодействует с молекулами HF c образованием хорошо растворимой комплексной кремнефтороводородной кислоты: или уравнение реакции в общем виде: Ввиду того, что Фтороводород разрушает стекло, поэтому в лаборатории его хранят в сосудах из свинца или стеклянных сосудах, покрытых изнутри слоем парафина, а также в сосудах из специальных сортов пластмасс. Задача 820. NaF ↔ Na + + F — ; или в молекулярной форме: NaF + H2O ↔ F + NaOH В результате гидролиза в растворе появляется некоторый избыток ионов ОН-, которые придают раствору щелочную реакцию, рН > 7. б) Фторид натрия NH4F – соль слабого основания (NH4OH) и слабой кислоты (HF) гидролизуется как по катиону, так и по аниону: NH4F ↔ NH4 + + F — ; или в молекулярной форме: NaF + H2O ↔ HF + NaOH В процессе гидролиза NH4F в растворе образуются слабые электролиты (NH4OH и HF), а также ионы Н + и ионы ОН — , которые соединяясь образуют воду Так как KD(NH4OH) = 1,79 . 10 -8 . 10 -4 , то гидролиз катиона NH4 + будет преобладать над гидролизом аниона F — , значит, в растворе соли будет наблюдаться некоторый избыток ионов водорода Н + , что придаст раствору слабокислотную среду, (рН > 7 или рН = 7). в) Фторид кремния SiF4 в водных растворах подвергается гидролизу, в результате которого образуется фтористоводородная кислота (НF) и кремниевая кислота (H2SiO3): Образующийся фтороводород взаимодействует SiF4. При этом получается гексафторкремниевая (или кремнефтористоводородная) кислота: Суммарный процесс можно выразить уравнением: В результате гидролиза фторида кремния образуются кислоты, поэтому реакция раствора будет кислой, рН Задача 821. Электронные уравнения полуреакций: Zn 0 + 2H + ↔ Zn 2+ + H2O; К реакциям, в которых галогеноводороды играют роль окислителя, относятся реакции термической диссоциации: Задача 822. б) В бромате калия KBrO3 степень окисления брома равна +5, поэтому он будет играть роль окислителя. Значит, электродный потенциал галогена, который вытеснит бром из бромата калия, должен быть меньше. Так как электродные потенциалы системы Г2 + 10 🔍 ВидеоСоставление уравнений химических реакций. 1 часть. 8 класс.Скачать  Реакция Концентрированной Серной Кислоты и Хлората Натрия. Реакция H2SO4 и NaClO3. Выделение ClO2.Скачать  Синтез БРОМОВОДОРОДНОЙ КИСЛОТЫ HBr. Реакция БРОМИДА НАТРИЯ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. ОпытыСкачать  хлорид натрия и серная кислотаСкачать  Реакция СУЛЬФИТА НАТРИЯ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Простые опыты по химии.Скачать  Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Получение ТРИФТОРИДА БОРА. Реакция Фторида Натрия, Тетрабората Натрия и Серной Кислоты.Скачать  Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать  Взаимодействие твердого нитрита натрия с концентрированной серной кислотой - 9 - 11 классСкачать  Практическая работа № 2. Опыт 3. Реакция нейтрализации (в присутствии фенолфталеина).Скачать  Химия | Молекулярные и ионные уравненияСкачать  Взаимодействие натрия с соляной кислотойСкачать  ПОЛУЧЕНИЕ БРОМОВОДОРОДА. Реакция Бромида Натрия и Серной Кислоты. Реакция NaBr и H2SO4.Скачать  Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать  |

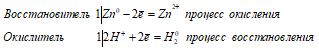
 = 2Br — равен 1,07 В (
= 2Br — равен 1,07 В (  0 (Red.) ).
0 (Red.) ).