| Фторид меди (II) | |
|---|---|
   | |
| Систематическое наименование | меди (II) фторид |
| Сокращения | фторомедь (II) |
| Традиционные названия | дифторид меди |
| Хим. формула | CuF2 |
| Состояние | |
| Молярная масса | |
| Температура | |
| • плавления | (безводный) 950 °C, (дигидрат) 130 |
| • кипения | (безводный) 1676 °C |
| Мол. теплоёмк. | (при 298,15 K) 65.815 Дж/(моль·К) |
| Энтальпия | |
| • образования | −538.9 ± 1.3 кДж/моль |
| Растворимость | |
| • в воде | в хол. воде 0,08 г/100 мл |
| • в других веществах | растворяется в аммиаке, фтороводородной, хлороводородной и азотной кислотах; пиридине, этилацетате |
| Рег. номер CAS | 7789-19-7, 13454-88-1 (дигидрат) |
| PubChem | 522688 |
| Рег. номер EINECS | 232-147-3 |
| SMILES | |
| ChemSpider | 74214 и 455944 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фторид меди (II) — это неорганическое бинарное химическое соединение. Химическая формула CuF2.
- Содержание
- Физические свойства
- Получение
- Химические свойства
- Применение
- Acetyl
- Реакция термического разложения фторида меди (II)
- Реакция термического разложения фторида меди (II)
- Реакция взаимодействия гидросульфита натрия и цинка
- Реакция взаимодействия оксида молибдена (VI), серной кислоты и воды
- Реакция термического разложения тетрагидрата ортофосфата цинка
- Выбрать язык
- Популярные записи
- Предупреждение.
- 📺 Видео
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 4 Применение
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Физические свойства
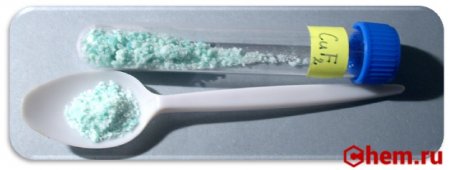
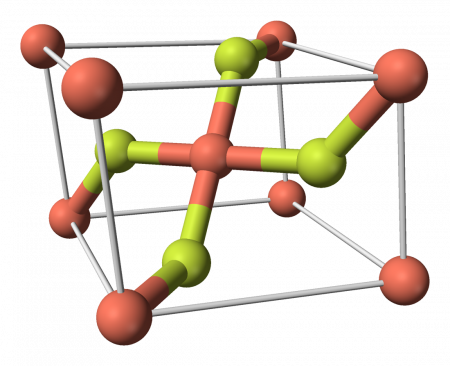
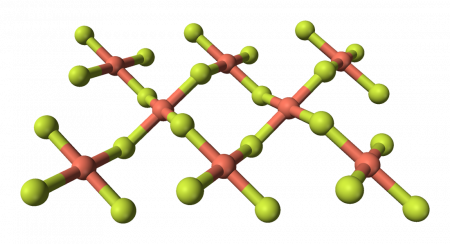
Безводный фторид меди это белые гигроскопические кристаллы кубической сингонии, пространственная группа Fm3m, a = 0,5417 нм, Z=4, структура типа CaF2.
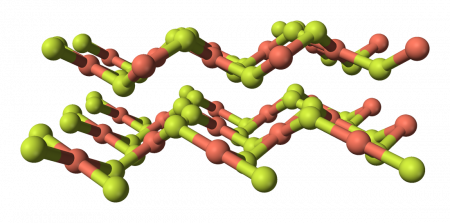
Образует кристаллогидрат CuF2·2H2O — светло-голубые кристаллы, при нагревании плавится в собственной воде.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Получение
Фторид меди (II) можно получить из гидроокиси меди:
Фторид меди(I) при нагревании диспропорционирует:
2CuF → to CuF2 + Cu
Фторид меди (II) можно синтезировать непосредственно из элементов:
При температуре в 400 °C фтор вытесняет из хлорида меди (II) хлор:
При температуре в 375 °C фторид азота (III) с медью реагирует с образованием тетрафторгидразина и фторида меди (II):
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические свойства
Восстанавливается до меди водородом:
Разлагается парами воды.
Взаимодействует с щелочами:
Соединение теряет фтор будучи расплавленным в температурах выше 950 °C:
В растворах, содержащих фторид-ион F − , образует комплексные анионы, например, CuF3 − , CuF4 2− и CuF6 4− :
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Применение
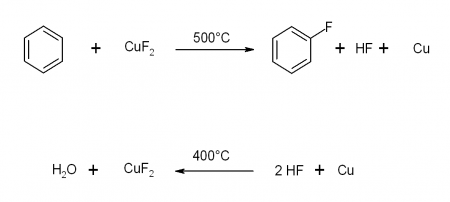
Было выяснено, что ароматические углеводороды реагируют со фторидом меди (II) в кислородсодержащей атмосфере при температурах выше 450 °C, образуя фторированные ароматические углеводороды.
Данная реакция, показанная на рисунке слева, является более простой, чем реакция Сандмайера, но применима только для соединений, которые являются достаточно стабильными при высоких температурах.
Применяется в качестве инсектицида и в производстве керамики.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Реакция термического разложения фторида меди (II)Видео:Уравнивание реакций горения углеводородовСкачать  Реакция термического разложения фторида меди (II)Уравнение реакции термического разложения фторида меди (II): Реакция термического разложения фторида меди (II). В результате реакции образуются медь и фтор. Реакция протекает при условии: при температуре выше 950 °C. Формула поиска по сайту: CuF2 → Cu + F2. Реакция взаимодействия гидросульфита натрия и цинкаРеакция взаимодействия оксида молибдена (VI), серной кислоты и водыРеакция термического разложения тетрагидрата ортофосфата цинкаВыбрать языкПопулярные записиПредупреждение.Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций. Химические реакции и информация на сайте 📺 ВидеоВсе реакции по теме «Хром» для ЕГЭ по химии | Екатерина СтрогановаСкачать  Реакция цезия со фторомСкачать  Качественная реакция на ион двухвалентной медиСкачать  С кем взаимодействует медь?Скачать  ОВР с соединениями марганца, хрома железа и меди | Химия с Юлией ВишневскойСкачать  ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  Все об ОВР за 5 часов | Химия ЕГЭ 2023 | УмскулСкачать  Качественная реакция на оксид медиСкачать  11 класс. Медь.Часть 1.Скачать  Взаимодействие железа с сульфатом медиСкачать  Замещения меди железомСкачать  Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать  |