| Трифторид алюминия | |||
|---|---|---|---|
| |||
| Традиционные названия | трифторид алюминия, фторид алюминия, алюминия трифторид | ||
| Хим. формула | AlF3 | ||
| Состояние | белое твердое кристаллическое вещество без запаха | ||
| Молярная масса | (тригидрат) 138.023 г/моль | ||
| Плотность | 2,88 г/см³ | ||
| Температура | |||
| • плавления | 1291 °C | ||
| Мол. теплоёмк. | 75,10 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −1510 кДж/моль | ||
| Удельная теплота испарения | (возгонка) 272 Дж/кг | ||
| Растворимость | |||
| • в воде | (при 0 °C) 0.56 (при 100 °C) 1.72 г/100 мл | ||
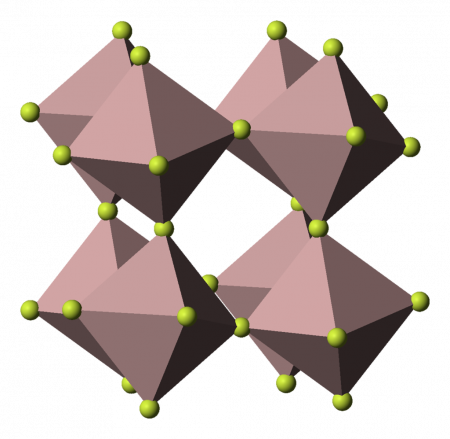
| Кристаллическая структура | ромбоэдрическая | ||
| Рег. номер CAS | |||
| PubChem | 2124 | ||
| Рег. номер EINECS | 232-051-1 (ангидрид) | ||
| SMILES | |||
| RTECS | BD0725000 | ||
| ChEBI | 49464 | ||
| ChemSpider | 2039 | ||
| Предельная концентрация | 2 мг/м3 | ||
| ЛД50 | 100 мг/кг (крысы, орально) | ||
| Пиктограммы ECB |    | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фторид алюминия — неорганическое бинарное соединение алюминия и фтора. Химическая формула AlF3.
- Содержание
- Физические свойства
- Получение
- Химические свойства
- Реакция взаимодействия алюминия и фтора
- Реакция взаимодействия алюминия и фтора
- Реакции алюминия
- Реакция взаимодействия свинца и кислорода
- Реакция взаимодействия алюминия и углерода
- Реакция взаимодействия фторида галлия (III) и гидроксида натрия
- Выбрать язык
- Популярные записи
- Предупреждение.
- Алюминий. Химия алюминия и его соединений
- Алюминий
- Положение в периодической системе химических элементов
- Электронное строение алюминия и свойства
- Физические свойства
- Нахождение в природе
- Способы получения
- Качественные реакции
- Химические свойства
- 📽️ Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 5 Токсичность
Видео:Уравнивание реакций горения углеводородовСкачать

Физические свойства
Фторид алюминия представляет собой бесцветное или белое кристаллическое вещество. При сильном нагревании возгоняется без разложения. При обычных условиях устойчива α-модификация с тригональной решеткой (а = 0,5039 нм, α = 58,50°, z = 2, пространственная группа R32), плотность 2,882 г/см³. При нагревании до
700 °C переходит в γ-модификацию с тетрагональной решеткой (а = 0,354 нм, с = 0,600 нм).
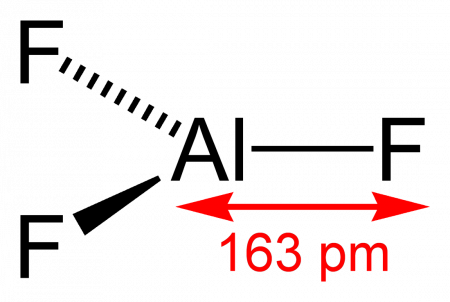
Длина связи Al—F составляет 0,163 нм. В газовой фазе, при температуре около 1000 °C, трифторид алюминия существует в виде молекул тригональной симметрии D3h.
Фторид алюминия плохо растворим в воде (0,41 % по массе при 25 °C), лучше — в растворах HF, не растворим в органических растворителях.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Получение
Взаимодействием Аl2O3 или Аl(ОН)3 с раствором HF с последующим выделением, сушкой и прокаливанием при 500-600 °C образовавшегося кристаллогидрата AlF3·3H2O:
Действием на Аl2O3 газообразного HF при 450-600 °C:
с последующем выделением, сушкой и прокаливанием гидрата.
При температуре в 700 °C гексафторсиликат натрия с алюминием дают на выходе чистый кремний, гексафторалюминат натрия и трифторид алюминия:
Самым легким путём получения трифторида алюминия является прямой контакт фтора с алюминием при температуре 600 °C:
2 Al + 3 F2 → 600oC 2 AlF3
Нагрев до температуры примерно 175 °C моногидрат трифторида алюминия получим воду и трифторид алюминия:
Для получения чистого безводного трифторида алюминия нужно гексафторалюминат аммония нагреть и получится трифторид алюминия с фторидом аммония:
В основном трифторид алюминия получают при обработке оксида алюминия гексафторсиликоновой кислотой, где на выходе получается оксид кремния IV, трифторид алюминия и вода:
Кроме того, он изготавливается путём термического разложения аммония гексафторалюмината.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Химические свойства
Образует кристаллогидраты с 1, 3 и 9 молекулами воды, которые легко разрушаются при нагревании:
При нагревании гидролизуется парами воды:
Медленно взаимодействует с концентрированной серной кислотой H2SO4:
Разлагается растворами и расплавами щелочей.
С фторидами щелочных металлов AlF3 образует фтороалюминаты, например, гексафтороалюминат натрия Na3[AlF6]:
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Реакция взаимодействия алюминия и фтора
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Реакция взаимодействия алюминия и фтора
Уравнение реакции взаимодействия алюминия и фтора:
Реакция взаимодействия алюминия и фтора.
В результате реакции образуется фторид алюминия.
Реакция протекает при условии: при температуре около 600 °C.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Реакции алюминия
Реакции алюминия с веществами:
Формула поиска по сайту: 2Al + 3F2 → 2AlF3.
Реакция взаимодействия свинца и кислорода
Реакция взаимодействия алюминия и углерода
Реакция взаимодействия фторида галлия (III) и гидроксида натрия
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Алюминий. Химия алюминия и его соединений
Бинарные соединения алюминия
Алюминий
Положение в периодической системе химических элементов
Алюминий расположен в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 



Электронная конфигурация алюминия в возбужденном состоянии :
+13Al * 1s 2 2s 2 2p 6 3s 1 3p 2 1s 



Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.
Температура плавления 660 о С, температура кипения 1450 о С, плотность алюминия 2,7 г/см 3 .
Алюминий — один из наиболее ценных цветных металлов для вторичной переработки. На протяжении последних лет, цена на лом алюминия в пунктах приема непреклонно растет. По ссылке можно узнать о том, как сдать лом алюминия.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.
Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970 о С) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
На катоде происходит восстановление ионов алюминия:
Катод: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов:
Суммарное уравнение электролиза расплава оксида алюминия:
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → Al + 3KCl
Качественные реакции
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами . При этом образуется белый аморфный осадок гидроксида алюминия.
Например , хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
Обратите внимание , если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также в ыпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al 3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4 +
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
Химические свойства
1. Алюминий – сильный восстановитель . Поэтому он реагирует со многими неметаллами .
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
1.2. Алюминий реагирует с серой с образованием сульфидов:
1.3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000 о С с образованием нитрида:
2Al + N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему: из-за образования оксидной пленки . А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al 0 + 6 H2 + O → 2 Al +3 ( OH)3 + 3 H2 0
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути ( II ):
3HgCl2 + 2Al → 2AlCl3 + 3Hg
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль и водород.
Например , алюминий бурно реагирует с соляной кислотой :
2Al + 6HCl = 2AlCl3 + 3H2↑
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами . При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑
Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → 2NaAlO2 + 3H2↑ + 2Na2O
2.6. Алюминий восстанавливает менее активные металлы из оксидов . Процесс восстановления металлов из оксидов называется алюмотермия .
Например , алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al2O3
Еще пример : алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
📽️ Видео
Составление уравнений реакций горения. 11 класс.Скачать

Химия| Элементарные частицы. Протоны. Нейтроны. Электроны.Скачать

Реакции горенияСкачать

68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

ПОЛНЫЙ разбор ВАРИАНТА №4 из сборника Добротина! | Химия ЕГЭ УМСКУЛСкачать

Горение. 7 класс.Скачать

Химия 9 класс (Урок№16 - Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора(V).)Скачать

Электролиз. 10 класс.Скачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Характеристика элемента по положению в Периодической системе и строению атома. 1 часть. 8 класс.Скачать