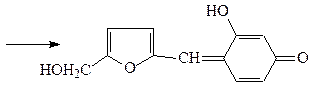Принцип метода. При нагревании пробы с фруктозой в присутствии резорцина и соляной кислоты до 80 о С через некоторое время в пробирке с фруктозой появляется ярко-красное окрашивание.
При нагревании пробы с фруктозой в присутствии резорцина и соляной кислоты появляется вишнево-красное окрашивание. Проба также применима для обнаружения других кетоз. Альдозы в этих же условиях взаимодействуют медленнее и дают бледно-розовую окраску или вообще не взаимодействуют. Открыта Ф. Ф. Селивановым в 1887 году.
Применяется при анализе мочи. Проба положительная при фруктозурии обменного или транспортного генеза. В 13 % случаев проба положительная при пищевой нагрузке фруктами и мёдом. Хим. формула фруктозы – C6H12O6
Циклическая формула фруктозы
Ациклическая форма
Порядок выполнения работы.
В две пробирки наливают по 2 мл: в одну – 1%-ный раствор глюкозы, в другую – 1%-ный раствор фруктозы. В обе пробирки вносят по 2 мл реактива Селиванова: 0,05 г резорцина растворяют в 100 мл 20 %-ной соляной кислоты. Обе пробирки осторожно нагревают до 80 о С (до начала кипения). Появляется красное окрашивание.
Выводы: результаты опыта и уравнение реакции записывают в тетрадь.
- Открытие кетоз реакцией Селиванова
- Исследование колориметрической реакции фруктозы с резорцином в зависимости от условий ее проведения Текст научной статьи по специальности « Химические науки»
- Аннотация научной статьи по химическим наукам, автор научной работы — Олейников Д. Н., Танхаева Л. М.
- Похожие темы научных работ по химическим наукам , автор научной работы — Олейников Д. Н., Танхаева Л. М.
- Текст научной работы на тему «Исследование колориметрической реакции фруктозы с резорцином в зависимости от условий ее проведения»
- 📽️ Видео
Видео:Пентозофосфатный путь, метаболизм фруктозы и галактозыСкачать

Открытие кетоз реакцией Селиванова
Эта качественная реакция позволяет отличить кетозы от альдоз. Она обусловлена образованием окрашенных продуктов конденсации резорцина с гидроксиметилфурфуролом, который получается при нагревании с соляной кислотой из кетоз (например, фруктозы) в 15- 20 раз быстрее, чемиз альдоз. Дисахариды, содержащие фрагмент кетозы, (например, сахароза) под действием кислоты гидролизуются до моносахаридов и также дают эту реакцию.
Реактивы: резорцин; растворы D-глюкозы и D-фруктозы; соляная кислота.
В две пробирки помещают по несколько кристалликов резорцина и по 3 капли концентрированной соляной кислоты. В первую пробирку прибавляют 2 капли 1%-ного водного раствора D-фруктозы, а во вторую — раствора D-глюкозы (0,01 г углевода растворить в 1 мл воды). Обе пробирки нагревают до начала кипения. В первой пробирке (с кетозой) появляется малиново-красное окрашивание раствора, во второй (с альдозой) наблюдается лишь светло-желтая окраска. Аналогично проводят опыт с неизвестными веществами.
Идентификация моно- и дисахаридов
Фруктоза
Данная кетогексоза дает положительную реакцию на моно-сахариды со щелочью (см. 1.2.2), положительную реакцию Троммера на альдозы и кетозы (см. 1.2.3) и открывается реакцией Селиванова на кетозы (см. 1.2.4, рис. 3).
Ксилоза
Эта альдопентоза идентифицируется по образованию красного продукта конденсации в реакции анилина с фурфуролом, в который превращается ксилоза при нагревании в кислой среде.
Реактивы: анилин; уксусная кислота; соляная кислота.
На узкую полоску фильтровальной бумаги наносят в одну точку 2 капли воды, 1 каплю уксусной кислоты и 2 капли анилина. Отдельно в пробирке растворяют примерно 0,02 г моносахарида в 1 мл воды, добавляют 1 мл концентрированной соляной кислоты и нагревают смесь до кипения. Затем каплю реакционной смеси наносят в ту же точку подготовленной ранее полоски бумаги. В присутствии ксилозы на бумаге появляется розово-красное пятно.
Глюкоза
При действии минеральных кислот глюкоза (и другие гексозы) превращается в гидроксиметилфурфурол, который в условияхопыта распадается на муравьиную и левулиновую кислоты. Левулиновая кислота(СН3-СО-СН2СН2-СООН) обнаруживается иодоформной пробой благодаря наличию СН3-СО-группировки. Мальтоза и сахароза также дают эту реакцию (почему?).
Пентозы не дают этой реакции, так как образуют устойчивый в этих условиях фурфурол (см. 1.3.2).
Реактивы: 2%-ный раствор иода; 5%-ный NaОН; соляная кислота.
В пробирке растворяют примерно 0,05 г углевода в 1 мл воды, добавляют 2мл концентрированной соляной кислоты и смесь кипятят в течение 1-2 мин, при этом реакционная смесь темнеет. В другую пробирку помещают 0,5 мл полученного раствора и приливают 10 мл воды, после чего добавляют сначала 3 капли раствора иода, затем по каплям 5%-ный водный раствор натрий-гидроксида до щелочной среды и исчезновения желтой окраски иода. При наличии левулиновой кислоты, полученной из глюкозы, образуется желтая муть с характерным «больничным» запахом (иодоформ).
Видео:Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

Исследование колориметрической реакции фруктозы с резорцином в зависимости от условий ее проведения Текст научной статьи по специальности « Химические науки»
Видео:25. Схема реакции и химическое уравнениеСкачать

Аннотация научной статьи по химическим наукам, автор научной работы — Олейников Д. Н., Танхаева Л. М.
Изучены условия проведения реакции фруктозы с резорцином и выявлены оптимальные параметры ее проведения. Разработана методика количественного определения фруктозы в препарате «левулоза». Относительная ошибка определения не превышает 3%. Сокращения: АсОН кислота уксусная, Аrа арабиноза, ЕЮН спирт этиловый, Frc фруктоза , Gal галактоза, GalUA -галакгуроновая кислота, Glc глюкоза, НС1 кислота хлористоводородная, Man манноза, Rha рамноза, Xyl ксилоза.
Видео:51. Углеводы. Глюкоза. Фруктоза (чась 2)Скачать

Похожие темы научных работ по химическим наукам , автор научной работы — Олейников Д. Н., Танхаева Л. М.
Видео:Фруктоза: враг или друг?Скачать

Текст научной работы на тему «Исследование колориметрической реакции фруктозы с резорцином в зависимости от условий ее проведения»
ИССЛЕДОВАНИЕ КОЛОРИМЕТРИЧЕСКОЙ РЕАКЦИИ ФРУКТОЗЫ С РЕЗОРЦИНОМ В ЗАВИСИМОСТИ ОТ УСЛОВИЙ ЕЕ ПРОВЕДЕНИЯ
© Д.Н. Оленников , Л.М. Танхаева
Институт общей и экспериментальной биологии СО РАН, ул. Сахьяновой, б, Улан-Удэ, 670047 (Россия). E-mail: oldaniil@rambler.ru
изучены условия проведения реакции фруктозы с резорцином и выявлены оптимальные параметры ее проведения. Разработана методика количественного определения фруктозы в препарате «левулоза». Относительная ошибка определения не превышает 3%.
Сокращения: AcOH — кислота уксусная, Ara — арабиноза, EtOH — спирт этиловый, Frc — фруктоза, Gal — галактоза, GalUA -галактуроновая кислота, Glc — глюкоза, HCl — кислота хлористоводородная, Man — манноза, Rha — рамноза, Xyl — ксилоза. Ключевые слова: фруктоза, резорцин, методика определения.
В доступной литературе имеются данные по количественному определению фруктозы в растениях, животных тканях, биологических средах и фармацевтических препаратах фотоколориметрическим и спектрофотометрическим методами, в которых используется реакция Селиванова. Условия проведения наиболее часто используемых вариантов представлены в таблице 1. Как видно из приведенных данных, условия реакции отличны, окрашенные растворы фотометрируются в широком диапазоне длин волн. При количественном анализе Frc с использованием упомянутых методик установлено, что окраска цветного комплекса неустойчива, вследствие этого наблюдается недостаточная воспроизводимость результатов анализа и значительная величина относительной ошибки (табл. 1). Вопрос о влиянии концентрации спирта этилового (EtOH) и кислоты хлористоводородной (HCl), а также других параметров на интенсивность и стабильность окраски остается открытым.
Цель настоящей работы — изучение влияния концентрации HCl и EtOH и ряда других параметров на реакцию Frc с резорцином, а также разработка методики количественного определения Frc в препарате «Левулоза».
Таблица 1. Условия проведения наиболее часто используемых вариантов проведения реакции Селиванова
Метод, Резорцин HCl EtOH Нагрев
модификация, источник Раство- ритель с, % с, % с, % Т, °С t, мин X, нм E, %*
Селиванова [1] EtOH 0,033 12,17 31,67 80 8 486 7,03
Роэ [2] EtOH 0,020 18,00 19,00 80 8 520 3,88
Бэкона-Бэла [3] EtOH 0,056 13,69 35,63 80 10 520 8,04
Роэ-Эпштейна-Гольдштейна [4] AcOH 0,010 21,00 0,00 80 10 520 4,21
Кулька [5] EtOH 0,019 13,69 36,63 80 40 480 6,27
Мак-Рери-Слаттери [6] EtOH 0,200 18,00 19,00 80 20 540 5,47
Хана [7] HCl 0,022 (0,031) 16,22 (22,46) 0,00 100 20 480 (398) 10,52 (9,14)
относительная ошибка определения
Автор, с которым следует вести переписку.
Для регистрации спектров поглощения применяли спектрофотометры Cecil CE 2011 и Agilent 8453E UV-Vis.
В качестве стандартных образцов использовали глюкозу (Roquette, >99%), фруктозу, арабинозу, галактозу, маннозу (Acros Organics, >99%), галактуроновую кислоту (Fluka BioChemica, >93%), ксилозу (Реахим), рамнозу (Диа М), инулин (Merck), «левулозу» (Hemofarm).
Эксперимент по определению оптимального соотношения HCl-EtOH проводили по следующей схеме. Конечный объем реакционной смеси — 20 мл. В составе реакционных проб неизменными оставались объемы стандартных растворов резорцина и Frc — по 1 мл, объемы H2O, HCl и EtOH изменялись, как описано ниже:
1 группа: VH2O = 0 мл, VEtOH : VHCl = 20:0, 19:1 . 0:20;
2 группа: VH2O = 1 мл, VEtOH : VHC[ = 19:0, 18:1 . 0:19;
20 группа: Vmo = 19 мл, VEtoH : Vhci = 1:0, 0:1.
После составления пробы ее нагревали на кипящей водяной бане в течение 8 мин, переносили в мерную колбу вместимостью 100 мл и доводили объем до метки водой. Оптическую плотность проб определяли при длине волны 480 нм относительно раствора сравнения. По результатам эксперимента строили проекции поверхностей в координатах cHa-cEtOH.
Методика количественного определения Frc в препарате «левулоза». 1 мл 5% препарата переносят в мерную колбу вместимостью 50 мл (для 10% раствора 100 мл) и доводят объем раствора до метки водой (раствор А). 1 мл раствора А переносят в пробирку вместимостью 25 мл, приливают 1 мл 1% спиртового раствора резорцина, 8 мл 95% спирта этилового, 1 мл 1% спиртового раствора тиомочевины, 9 мл кислоты хлористоводородной концентрированной, нагревают на кипящей водяной бане в течение 8 мин. После охлаждения реакционную смесь переносят в мерную колбу вместимостью 100 мл и доводят объем раствора до метки водой (раствор Б). Оптическую плотность раствора Б определяют при длине волны 480 нм.
Содержание Frc (Х) в препарате в % вычисляют по формуле:
где с — содержание Frc, определенное по градуировочному графику, мкг/мл; К — коэффициент разбавления (1250 и 2500, соответственно для 5 и 10% растворов); V — объем препарата, мл; 106 — коэффициент пересчета мкг в г.
Метрологическую обработку результатов проводили согласно рекомендациям [8, 9]. Регрессионный анализ выполняли с применением пакета программ Advanced Grapher ver. 2.07 (Alentum Software Inc.).
Анализ спектров поглощения показал, что комплекс Frc с резорцином обладает двумя экстремумами в видимой области — 400 и 480 нм (рис. 1).
При определении оптимального соотношения HCl-EtOH установлено, что область максимальных оптических плотностей для окрашенного комплекса имеет состав: HCl 15-21%, EtOH 28-49% (рис. 2). Окончательный выбор состава, при котором учитывались величина оптической плотности и метрологические характеристики показал, что вариант состава 8 позволяет добиться максимальной оптической плотности при минимальной относительной ошибке (табл. 2).
Таблица 2. Выбор состава реакционной смеси (n = 6)
Вариант сшь % ^»EtOH % А480, опт.ед. SJ-10° E, %
1 20 29 0,316 5,48 2,42
2 20 32 0,334 6,84 2,60
3 20 38 0,377 17,82 3,71
4 18 32 0,336 8,00 2,79
5 18 38 0,365 4,74 2,98
6 18 43 0,378 13,60 3,24
7 16 43 0,387 8,48 2,50
8 16 48 0,421 6,62 2,03
Рис. 1. Спектры поглощения: 1 — раствора сравнения; 2 — резорцина; 3 — тиомочевины; комплекса фруктозы с резорцином: 4 — без тиомочевины относительно раствора сравнения; 5 — в присутствии тиомочевины относительно раствора сравнения; 6 — в присутствии тиомочевины относительно воды
Рис. 2. Поверхность отклика условий реакции Бге-резорцин
В результате определения времени нагрева реакционной смеси установлено, что наибольшая оптическая плотность при длине волны 480 нм развивается через 7-8 мин (рис. 3). Дальнейшее нагревание нецелесообразно по причине занижения результатов. Оптимальная концентрация резорцина — 0,05%.
При исследовании устойчивости окрашенного комплекса во времени установлено, что оптическая плотность растворов постепенно снижается, не выходя на прямолинейный участок (рис. 4). Для устранения этого недостатка нами изучена возможность стабилизации за счет введения различных веществ (тиомочевина, РеС13, РеКН4(804)2, кислота аскорбиновая), в результате чего выбрана тиомочевина, которую вводили непосредственно в реакционную смесь до и после нагрева пробы. Установлено, что введение тиомочевины после нагрева не оказывает положительного влияния на процесс стабилизации, понижая интенсивность окраски цветного комплекса. Введение тиомочевины до нагрева вызывает повышение оптической плотности, стабилизируя окраску (рис. 4); оптимальной является концентрация 0,01%, при которой наблюдается наибольшая оптическая плотность и устойчивость окрашенного комплекса (до 1,5 ч).
При исследовании влияния температуры на интенсивность колориметрической реакции установлено, что наибольшие значения достигаются в диапазоне 96-100 °С.
Линейность оптической плотности в диапазоне 0,2-0,7 отн. ед. наблюдается для растворов Бге с концентрациями 4,5-16,5 мкг/мл. Градуировочный график описывается уравнением А = 0,042 • с — 0,001, где с -концентрация Бге, мкг/мл (г2 = 0,9990, s2 = 8,48-10-3), предел обнаружения (З^-критерий) равен 0,24 мкг/мл.
Рис. 3. Влияние времени нагрева на колориметрическую реакцию Ргс-резорцин
Рис. 4. Устойчивость окрашенного комплекса Бге с резорцином без (□) и в присутствии тиомочевины при ее введении в пробу до (■) и после (▲) нагрева
Для оптимизации условий проведения анализа изучено влияние различных моносахаридов на результаты определения Бгс (табл. 3). Установлено, что до соотношения Бгс : углевод 1 : 1 ни одно из исследуемых соединений не влияет на величину оптической плотности. Дальнейшее увеличение концентрации моносахаридов заметно сказывается на результатах. Наименьшее влияние оказывает примесь Ага и ИИа. При анализе Бго, инулина и инулинсодержащих растений содержание примесей других моносахаридов обычно не превышает 3-5%, поэтому их присутствие не окажет влияния на результаты определения.
С применением метода варьирования величины пробы установлено, что разработанная методика содержит систематическую погрешность, которая уменьшается с увеличением навески анализируемой пробы. В области рабочих концентраций величина относительной ошибки методики не превышает 5%. Наименьшая систематическая ошибка наблюдается для растворов Бге с концентрациями 4 мкг/мл. При исследовании методики способом «введено-найдено» установлено, что относительная ошибка определения не превышает 4%.
В эксперименте со стандартным образцом Бге установлено, что относительная ошибка единичного измерения находится в интервале 0,10-3,90% и может быть как положительной, так и отрицательной. Средняя ошибка из трех параллельных определений для трех образцов находится в достаточно узких пределах 1,402,11%. Отклонение от среднего в серии из трех независимых определений не превышает 3%, что свидетельствует об удовлетворительной воспроизводимости методики. Анализируемый компонент определяется с достаточной точностью, и результаты анализа можно считать правильными.
Предложенная методика апробирована на препарате «левулоза», представляющий собой инфузионный раствор Бге. Результаты приведены в таблице 4. Относительная ошибка определения не превышает 2,5%.
Таблица 3. Влияние моносахаридов на величину оптической плотности растворов Бге. Завышение результатов, %
Еге : М Ага Ху1 01с Оа1 Мап КЬа ОаЮА
50 : 1 0 0 0 0 0 0 0
10 : 1 0 0 0 0 0 0 0
1 : 1 0 0 0 0 0 0 0
1 : 10 3 12 23 7 18 0 0
1 : 50 10 106 91 86 147 14 32
1 : 100 35 253 210 129 332 19 76
1 : 200 80 401 372 273 555 71 165
Таблица 4. Метрологические характеристики методики количественного определения Бгс в препарате «левулеза» (п = 7, ґ (р, А) = 2,45, Р = 0,95)
Должно быть Егс, % Найдено Егс, % 52 я* ±Дх, % Е, %
5,00 5,04 1,75-10-3 1,58-10-2 0,04 0,77
10,00 10,02 6,20-10-2 9,3910-2 0,23 2,30
При исследовании колориметрической реакции фруктозы с резорцином выявлены оптимальные условия ее проведения. Установлено, что в присутствии 16% кислоты хлористоводородной и 48% спирта этилового достигается максимальная оптическая плотность при минимальной относительной ошибке определения (2,03%). Для стабилизации окрашенного комплекса фруктозы с резорцином предложено введение в реакционную смесь тиомочевины. Изучение влияния посторонних моносахаридов на интенсивность оптической плотности растворов фруктозы в выбранных условиях показало, что наименьшее воздействие оказывают арабиноза и рамноза. Разработана методика количественного определения фруктозы в фармацевтическом препарате «левулеза» с относительно ошибкой определения не более 3%.
1. Селиванов Ф.Ф. // Журнал русского физико-химического общества. 1888. Т. 20. С. 267 (цит. по: Коренман И.М. Методы определения органических соединений. М., 1975. 359 с.).
2. Roe J.H. A colorimetric method for the determination of fructose in blood and urine // Journal of Biological Chemistry. 1934. V. 107. P. 15-22.
3. Bacon J.S.D., Bell D.J. Fructose and glucose in the blood of the foetal sheep // Biochemical Journal. 1948. V. 42. P. 397-405.
4. Roe J.H., Epstein J.H., Goldstein N.P. A photometric method for the determination of inulin in plasma and urine // Journal of Biological Chemistry. 1949. V. 178. P. 839-845.
5. Kulka R.G. Colorimetric estimation of ketopentoses and ketohexoses // Biochemical Journal. 1956. V. 63. P. 542-548.
6. Методы биохимического исследования растений. Л., 1987. 430 с.
7. Khan M.A., Iqbal Z., Jan M.R., Shan J., Ahmad W., Haq Z.U. Obaidulla Spectrophotometric method for the quantitative determination of lactulose in pharmaceutical preparations // Журнал аналитической химии. 2006. Т. 61, №1.
8. Александров Ю.И., Беляков В.И. Погрешность и неопределенность результата химического анализа // Журнал аналитической химии. 2002. Т. 57, №2. С. 118-129.
9. Смагунова А.Н. Способы оценки правильности результатов анализа // Журнал аналитической химии. 1997. Т. 52, №10. С. 1022-1029.
📽️ Видео
Биохимия. Лекция 48. Углеводы. Превращение фруктозы и галактозы в глюкозу. Гликогенез. Гликогенолиз.Скачать

Патогенез катаракты при галактоземии. Метаболизм фруктозы и галактозы.Скачать

Обмен Галактозы и Фруктозы(Часть 10)Скачать

Общие свойства углеводов. Реактив Фелинга, Фруктоза, Сахароза, Крахмал.Скачать

Моносахариды. Глюкоза. 11 класс.Скачать

Химия 10 класс (Урок№10 - Углеводы. Глюкоза. Олигосахариды. Сахароза.)Скачать

Фруктоземия, галактоземияСкачать

Молекулярная структура фруктозы (видео 4) | Макромолекулы | БиологияСкачать

97. Глюкоза (структурные формулы)Скачать

Моносахариды: глюкоза и фруктоза.Скачать

МОНОСАХАРИДЫ. ГОТОВИМСЯ К МИКРОКОНТРОЛЮСкачать
Биохимия легко: метаболизм фруктозы. Решаем и разбираем задачуСкачать

Чем отличается глюкоза от фруктозы?Скачать

ГЛЮКОЗА цикло-оксо-формыСкачать

Качественная реакция глюкозы с гидроксидом меди (II)Скачать