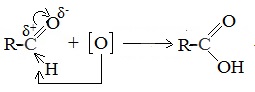
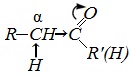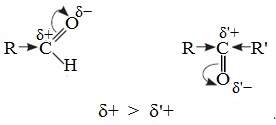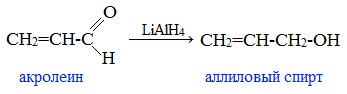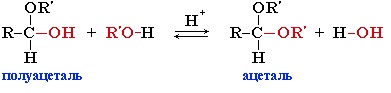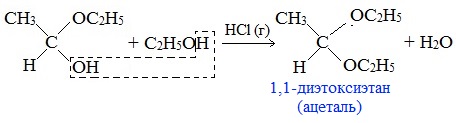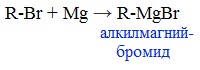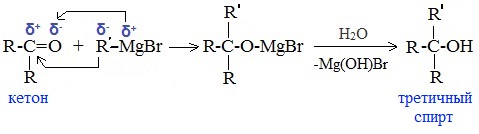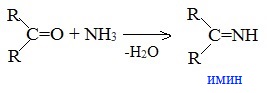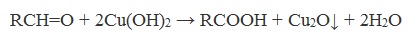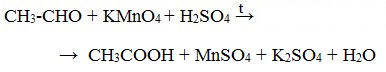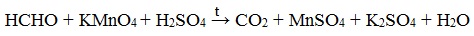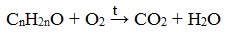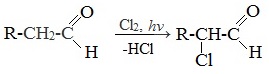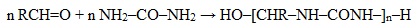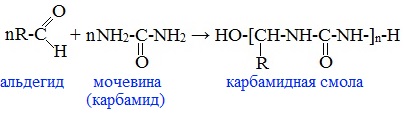Химические свойства альдегидов и кетонов определяются тем, что в состав их молекул входит карбонильная группа с полярной двойной связью >C=O.
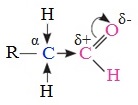
1. Высокая полярность связи С=О вызывает на карбонильном атоме углерода значительный дефицит электронной плотности (C δ+ ), и по этому атому углерода возможна нуклеофильная атака. При этом, взаимодействие с нуклеофилами приводит к разрыву π-связи и образованию более прочной σ-связи.
2. Высокая полярность связи С=О вызывает на атоме углерода, соседнем с карбонильной группой (α-углеродном атоме), повышенную полярность связи С-Н α-углеродного атома. Это характеризует данные соединения как СН-кислоты.
Для альдегидов и кетонов наиболее характерны реакции, протекающие по механизму нуклеофильного присоединения (AN).
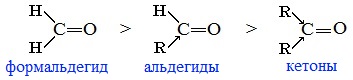
Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам:
Самый активный из альдегидов – формальдегид Н2СО.
Сравнение реакционной способности альдегидов и кетонов
При сравнении реакционной способности альдегидов и кетонов необходимо учесть 2 фактора: электронный и пространственный.
Альдегиды более реакционноспособны, чем кетоны. Кетоны реагируют обычно в более жестких условиях, чем альдегиды, а в некоторые реакции даже и не вступают.
Электронный фактор связан с величиной положительного заряда на карбонильном атоме углерода и влиянием на него электронодонорных эффектов заместителей R и R’.
В молекулах кетонов на карбонильный атом углерода действуют индуктивные эффекты двух углеводородных радикалов R и R’, а в молекулах альдегидов одного радикала R, поэтому в случае кетонов величина положительного заряда на этом атоме меньше.
Следовательно, взаимодействие кетонов с нуклеофилами протекает труднее.
Пространственный фактор связан с доступностью реакционного центра (C δ+ ) для нуклеофильной атаки, а это зависит от размеров заместителей R и R’.
В молекулах альдегидов (содержат один радикал R) карбонильный атом углерода оказывается более доступен по сравнению с кетонами, поэтому нуклеофильные реакции для альдегидов протекают легче, чем для кетонов.
Реакционная способность карбонильных соединений определяется величиной частичного положительного заряда δ + на атоме углерода в карбонильной группе. Чем этот заряд больше, тем выше химическая активность карбонильного соединения.
- Углеводородные радикалы у группы С=О увеличивают пространственные препятствия присоединению к карбонильному атому углерода новых атомов или атомных групп.
- Углеводородные радикалы за счет +I-эффекта уменьшают положительный заряд на атоме углерода карбонильной группы, что затрудняет присоединение нуклеофильного реагента.
Для карбонильных соединений характерны реакции:
- присоединение по карбонильной группе;
- реакции замещения у α-углеродного атома;
- полимеризация;
- поликонденсация;
- окисление.
- Реакции присоединения
- Реакции окисления
- Реакции замещения
- Реакции поликонденсации
- Реакции диспропорционирования
- Присоединение гидросульфита натрия
- Готовые работы на аналогичную тему
- Применение гидросульфитных производных карбонильных соединений
- Присоединение гидрид-аниона
- Присоединение галогенид-ионов
- Acetyl
- 📸 Видео
Реакции присоединения
Присоединение большинства реагентов по двойной связи С=О происходит как ионная реакция по механизму нуклеофильного присоединения AN.
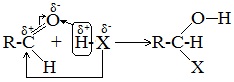
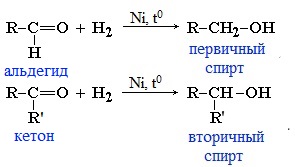
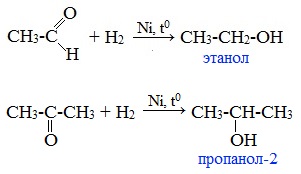
1. Гидрирование (восстановление)
Реакцию восстановления альдегидов и кетонов широко используют для получения спиртов. Присоединение водорода по кратной связи С=О происходит при нагревании в присутствии катализаторов (Ni, Pt, Pd).
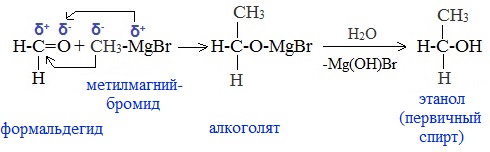
В результате образуются спирты соответствующего строения. Гидрирование альдегидов приводит к образованию первичных спиртов, гидрирование кетонов – ко вторичным.
Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, а при гидрировании ацетона – пропанол-2:
В лабораторных условиях для восстановления альдегидов и кетонов используется алюмогидрид лития (тетрагидроалюминат лития) LiAlH4:
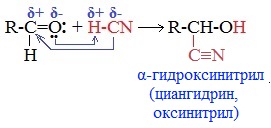
2. Присоединение циановодородной (синильной) кислоты НСN
Альдегиды и кетоны, взаимодействуя с синильной кислотой, образуют циангидрины – органические соединения, молекулы которых содержат две функциональные группы: циано-группу 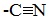
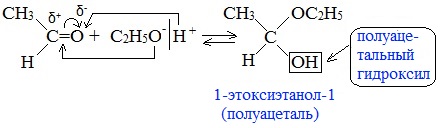
Присоединение идет в соответствии с распределением электронной плотности в молекулах:
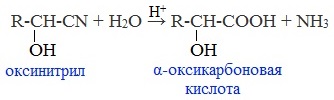
Образовавшееся соединение содержит на один атом углерода больше, чем исходный альдегид или кетон, поэтому подобные реакции используют для удлинения углеродной цепи. А также для получения α-гидроксикислот R-CH (COOH) OH:
Циангидрин CH3— CH(CN) — OH — яд! Он содержится в ядрах косточек вишен, слив, персика.
Циангидрины используют как промежуточные соединения в синтезах окси- и аминокислот. Некоторые циангидрины встречаются в растениях. Употребление таких растений в пищу может привести к тяжелым отравлениям вследствие высвобождения синильной кислоты в организме.
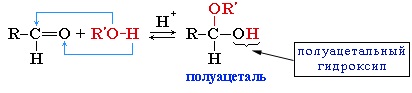
3. Взаимодействие со спиртами (в присутствии кислоты или основания как катализатора)
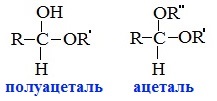
Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя соответственно полуацетали или ацетали.
Полуацетали — соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную (ОR) группы.
Ацетали – это соединения, содержащие при одном атоме углерода две алкоксильные группы.
Присоединение спиртов с образованием полуацеталей:
Гидроксильная группа полуацеталей (полуацетальный гидроксил) очень реакционноспособна. Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
Ацетали обладают приятным цветочным ароматом. Именно образованием ацеталей обусловлен букет выдержанных вин.
Ацеталь, полученный из масляного альдегида и поливинилового спирта, используется в качестве клея при изготовлении безосколочных стекол.
Кетоны в этих условиях кетали не образуют.
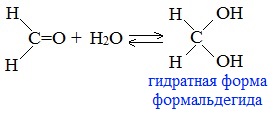
4. Гидратация (присоединение воды)
Альдегиды в водных растворах существуют в виде гидратных форм, образующихся в результате присоединения воды к карбонильной группе:
Эта реакция возможна только для формальдегида и уксусного альдегида.
Кетоны не реагируют с водой.
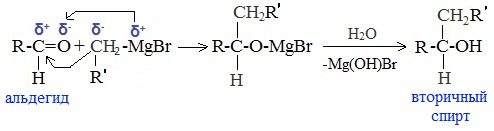
5. Присоединение реактива Гриньяра — образование спиртов
При добавлении раствора галогеналкана в диэтиловом эфире к магниевой стружке легко происходит экзотермическая реакция, магний переходит в раствор и образуется реактив Гриньяра.
а) Взаимодействием реактива Гриньяра с формальдегидом можно получить первичный спирт (кроме метанола). Для этого продукт присоединения реактива Гриньяра гидролизуют с водой:
б) При использовании любых других алифатических альдегидов могут быть получены вторичные спирты:
в) Взаимодействием реактивов Гриньяра с кетонами получают третичные спирты:
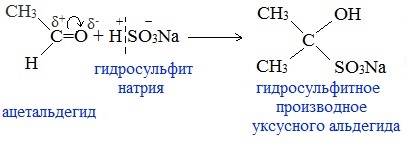
6. Присоединение гидросульфита натрия NaHSO3 с образованием гидросульфитных производных альдегидов
Качественная реакция на альдегидную группу!
Альдегиды при встряхивании с концентрированным раствором гидросульфита натрия образуют кристаллические соединения:
С помощью этой реакции выделяют альдегиды из смесей с другими веществами и для получения их в чистом виде.
7. Взаимодействие с аммиаком
При взаимодействии с аммиаком образуются имины:
Реакции окисления
В молекулах альдегидов атом углерода карбонильной группы, имеющий избыточный положительный заряд, притягивает к себе электроны связи С-Н. Вследствие этого атом водорода приобретает большую реакционную активность, что проявляется в способности альдегидов к окислению.
Альдегиды легко окисляются в соответствующие карбоновые кислоты под действием таких мягких окислителей, как оксид серебра и гидроксид меди (II). Окисление происходит по связи С-Н в альдегидной группе –СН=О, которая превращается при этом в карбоксильную группу –С(ОН)=О.
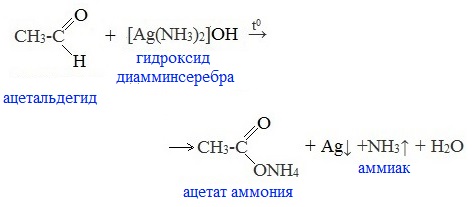
1. Реакция «серебряного зеркала» — окисление аммиачным раствором оксида серебра (реактив Толленса)
Качественная реакция на альдегидную группу!
Металлическое серебро осаждается на стенках пробирки в виде тонкого слоя, образуя зеркальную поверхность.
Видеоопыт «Реакция «серебряного зеркала»
Реакцию «серебряного зеркала» широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
Кетоны не вступают в эту реакцию.
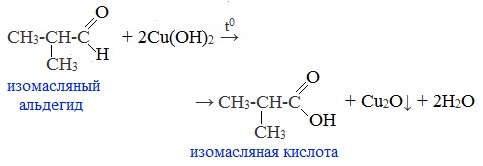
2. Окисление гидроксидом меди (II)
Качественная реакция на альдегидную группу!
Для реакции используют свежеприготовленный Cu (ОН)2, образующийся при взаимодействии растворимой соли меди (II) со щелочью.
Голубая суспензия гидроксида меди (II) при нагревании с альдегидом приобретает окраску оранжево-красного осадка оксида меди (I):
Альдегид окисляется до соответствующей ему карбоновой кислоты.
Видеоопыт «Качественная реакция на альдегиды с гидроксидом меди (II)»
Кетоны в эту реакцию не вступают.
3. Реакция на альдегиды с фуксиносернистой кислотой
Качественная реакция на альдегидную группу!
Краситель красного цвета — фуксин, при насыщении его раствора газообразным сернистым ангидридом (SO2) образует бесцветный раствор фуксиносернистой кислоты. Этот реактив при взаимодействии с альдегидами дает красно-фиолетовое окрашивание, что является качественной реакцией на альдегидную группу.
Видеоопыт «Качественная реакция на альдегиды с фуксинсернистой кислотой»
Кетоны не вступают в эту реакцию.
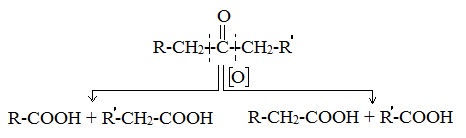
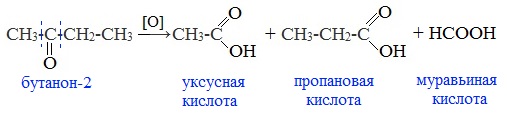
Кетоны окисляются с трудом лишь при действии более сильных окислителей и повышенной температуре. При этом происходит разрыв С–С-связей (соседних с карбонилом) и образование смеси карбоновых кислот с более короткой углеродной цепью:
4. Окисление перманганатом калия
Альдегиды можно окислить подкисленным раствором перманганат калия КMnO4 при нагревании:
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, т.е. альдегид окисляется до соответствующей ему карбоновой кислоты.
Муравьиный альдегид (формальдегид) окисляется до углекислого газа, потому что соответствующая ему муравьиная кислота неустойчива к действию сильных окислителей:
Для кетонов эта реакция не имеет практического значения, так как происходит разрушение молекулы и в результате получается смесь продуктов.
5. Горение (полное окисление)
Альдегиды и кетоны сгорают до углекислого газа и воды:
Реакции замещения
1. α -Галогенирование
Альдегиды и кетоны легко вступают в реакцию с галогенами (Cl2, Br2, I2) с образованием ɑ-галогенпроизводных.
Такой эффект наблюдается только для ɑ-атома углерода, т.е атома, следующего за альдегидной группой, независимо от длины углеродного радикала.
Галогенопроизводные альдегидов и кетонов проявляют слезоточивое действие и называются лакриматорами.
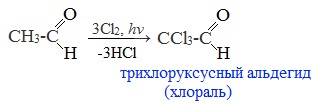
При избытке галогена замещению подвергаются все атомы водорода при ɑ-углеродном атоме:
Хлораль обладает снотворным действием. На основе хлораля получают средства борьбы с насекомыми (инсектициды), в том числе хлорофос, а также различные гербициды.
При растворении хлораля в воде образуется хлоралгидрат ССl3CH (OH)2.
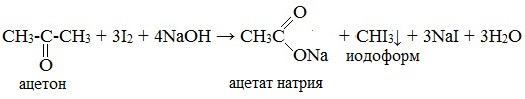
2. Галоформная реакция (иодоформная реакция, или проба Люголя)
Качественная реакция на метилкетоны и ацетальдегид!
Иодоформная реакция – обработка карбонильного соединения избытком иода в присутствии щелочи. Выпадение желтого осадка иодоформа указывает на наличие в исходном соединении метильной группы, связанной с карбонилом:
Иодоформ широко используется как антисептик в медицине и ветеринарии.
Реакции полимеризации
Полимеризация — частный случай реакций присоединения — характерна в основном для альдегидов.
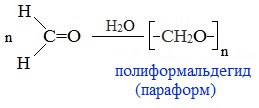
1. Линейная полимеризация
При испарении или длительном стоянии 40% водного раствора формальдегида (формалина) образуется полимер формальдегида в виде белого осадка с невысокой молекулярной массой – параформ:
Параформ используют для изготовления волокон, пленок и других изделий.
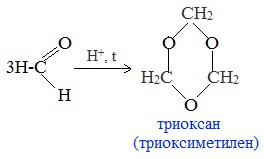
2. Циклическая полимеризация (тримеризация, тетрамеризация)
При взаимодействии молекул альдегидов возможно также образование циклических соединений.
а) Тример метаналя получается при перегонке подкисленного раствора формальдегида:
Триоксан используется для получения полиформальдегида (полиоксиметилена) с высокой молекулярной массой, обладающего повышенной стабильностью и механической прочностью.
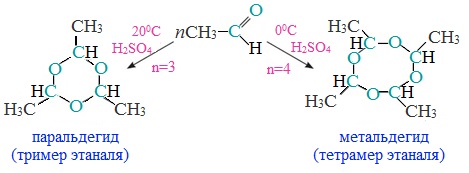
б) Полимеризация ацетальдегида в присутствии следов серной кислоты приводит к образованию в зависимости от условий двух циклических продуктов — паральдегида и метальдегида. Паральдегид образуется, если реакцию проводить при 20 0 С, а метальдегид — при 0 0 С:
Паральдегид — жидкость (т. кип. 128 0 С), метальдегид — твердое вещество, используется в быту как сухое горючее под названием «сухой спирт».
Реакции поликонденсации
Конденсацией называется реакция, приводящая к усложнению углеродного скелета и возникновению новой углеродной связи, причем из двух или более относительно простых молекул образуется новая, более сложная молекула. Обычно в результате реакции конденсации выделяется молекула воды или другого вещества.
Конденсация, приводящая к образованию высокомолекулярных соединений, называется реакцией поликонденсации.
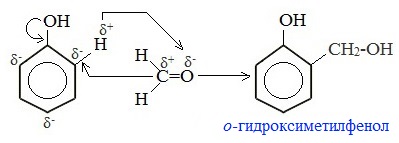
1. Конденсация с фенолами
Практическое значение имеет реакция формальдегида с фенолом (катализаторы — кислоты или основания).
Вначале в присутствии катализатора происходит взаимодействие между молекулой формальдегида и молекулой фенола с образованием фенолспирта:
Для фенола эта реакция электрофильного замещения (SE), а для формальдегида – нуклеофильного присоединения (АN).
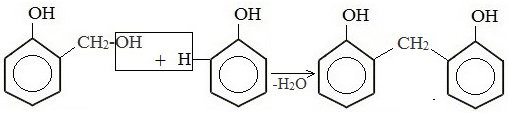
Образовавшееся соединение взаимодействует далее с фенолом с выделением молекулы воды:
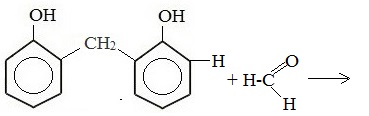
Новое соединение взаимодействует с формальдегидом:
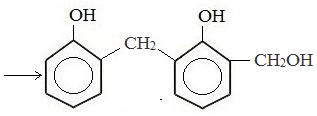
Это соединение конденсируется с фенолом, затем снова с формальдегидом и т.д.
В результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолформальдегидные смолы, из которых получают пластмассы – фенопласты.
Фенопласты – важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготавливают большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали.
2. Конденсация альдегидов с карбамидом (мочевиной) (NH2)2C=O — получение карбамидных (мочевино-формальдегидных) смол
Видеоопыт «Поликонденсация формальдегида и мочевины (получение пенопласта)»
3. Конденсация формальдегида с меламином С3Н6N6 (меламино-формальдегидные смолы)
Меламино-формальдегидные смолы применяют для пропитки бумаги, картона и тканей с целью придания им водостойкости, несминаемости и снижения усадки.
Важно! Посуда, изготовленная из меламино-формальдегидных полимеров (неправильно называемых «меламином»), обычно ярко оформлена, токсична и очень опасна для здоровья.
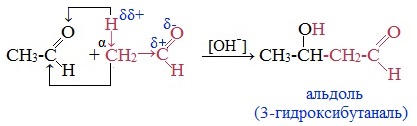
4. Альдольно-кротоновая конденсация
При альдольной конденсации происходит присоединение одной молекулы карбонильного соединения к другой молекуле, образуется альдегидоспирт (альдоль) или кетоноспирт (кетол).
Например, уксусный альдегид на холоду при действии разбавленных растворов щелочей превращается в альдоль:
Альдольная конденсация широко используется в промышленности для получения синтетических каучуков, смол, лаков и различных душистых веществ.
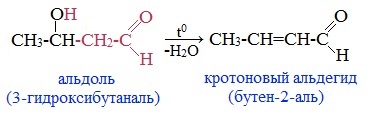
При кротоновой конденсации образуется молекула непредельного альдегида или кетона. Химическая реакция сопровождается выделением молекулы воды.
Реакция проводится в более жестких условиях (при нагревании или в присутствии кислоты) альдоль дегидратируется с образованием кротонового альдегида:
Легкое отщепление воды от альдоля объясняется подвижностью водородного атома в α-звене, на которое действует –I-эффекты двух групп (ОН и С=О).
Соединения, содержащие третичный углеродный атом возле карбонильной группы не вступают в реакцию альдольной конденсации.
Впервые эти конденсации осуществили одновременно (1872 г.) и независимо друг от друга А.П. Бородин и Ш.А. Вюрц.
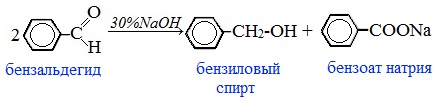
Реакции диспропорционирования
Реакция Канниццаро
Важной в промышленности реакцией самоокисления-самовосстановления является реакция Канниццаро.
Альдегиды, не содержащие атом водорода у α-углеродного атома, в щелочной среде способны вступать в окислительно-восстановительную реакцию (диспропорционирования):
Одна молекула альдегида при этом окисляется до карбоновой кислоты, а другая молекула восстанавливается до спирта.
Видео:Дегидрирование Дихлорметана Раствором Гидроксида Натрия. Получение Формальдегида.Скачать

Присоединение гидросульфита натрия
Вы будете перенаправлены на Автор24
К карбонильной группе в качестве нуклеофильной частицы могут такжк присоединятся гидросульфит-ионы в результате чего образуются $alpha$-оксипроизводные сульфокислот:
Атом серы имеет большую нуклеофильность, чем атом кислорода, и карбонильный электрофильный центр атакуется серой сульфит-иона $^$, который всегда присутствует в системе и является более активным по сравнению с гидросульфит-ионом $HSO_$:
Реакция присоединения гидросульфита общая как для альдегидов, так и для метилкетонов. Однако кетоны с более длинными радикалами, чем метильный, не могут присоединять гидросульфит-ионы из-за пространственного препятствия для нуклеофильных атак этим нуклеофилом. Присоединение гидросульфита по месту карбонильной группы, подобно многим реакциям, обратимый процесс, и для выхода целевого продукта присоединения следует использовать большой избыток 40%-го водного раствора гидросульфита:
В кислых или наоборот щелочных средах происходит обратная реакция, которая позволяет выделять карбонильные соединения при их идентификации:
Готовые работы на аналогичную тему
Видео:10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать

Применение гидросульфитных производных карбонильных соединений
Так как гидросульфитные производные карбонильных соединений представляют собой кристаллические вещества, то реакцию присоединения гидросульфита к ним часто используют для выделения этих карбонильных соединений из реакционной смеси. Исходные вещества могут быть легко получены при обработке гидросульфитных производных кислотами или основаниями, или например, карбонатом натрия. Из-за этого гидросульфитные производные карбонильных соединений часто используют для так называемой «консервации» карбоксильной группы, чтобы предохранить её от окисления или альдольной конденсации. Гидросульфитные производные также применяют и для получения цианогидринов при взаимодействии их с цианидом калия:
Видео:Качественная реакция на альдегиды с гидроксидом медиСкачать

Присоединение гидрид-аниона
При применении соединений типа тетрагидроалюмината лития $LiAlH_4$ или тетрагидробората лития $LiBH_4$ ($N$-нуклеофилы) реакция присоединения происходит с перемещением гидридного аниона. В ней могут участвовать все четыре атома водорода аниона $[AlH_4]^-$:
К реакциям такого типа относят реакцию Меервейна-Понндорфа-Верлея (1926-1929 гг.) — cелективное восстановление карбонильных соединений с помощью триизопропилата алюминия в качестве донора гидрид-анионов:
В процессе восстановления образуется промежуточный комплекс между молекулами реагирующих компонентов, в котором происходит перемещение гидрид-иона от фрагмента изопропилового спирта к карбокатиону карбонильного соединения, который восстанавливается, с последующим расщеплением связи $O-A1$ и образованием молекулы спирта:
В процессе реакции одна изопропокси-группа триизопропилата алюминия окисляется до ацетона.
Видео:Реакция Тетрабората Натрия С Солями Щелочноземельных Металлов. Реакция Na2B4O7 с MgCl2, CaCl2.Скачать

Присоединение галогенид-ионов
Прямого взаимодействия карбонильной группы с галогеном не происходит, но при воздействии сильных электрофилов вроде $PCl_5$ или $SF_4$, реакция проходит с начальной активацией карбонильной группы и последующей ее взаимодействием с галогенид-ионом:
Аналогично кетоны образуют геминальные галогенопроизводные:
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 24 02 2022
Видео:Уравнивание реакции диссоциации (на примере сульфата натрия). Ручка, бумага.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 📸 ВидеоРеакция ФТОРИДА НАТРИЯ и ГИДРОКСИДА КАЛЬЦИЯ. Химические опыты.Preparation CALCIUM FLUORIDE.ChemistryСкачать  Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать  Гидроксид натрия.Цветные реакции с едким натром.Получение щелочи и опыты.Сульфид,сульфит из натрия!Скачать  Как получить ФОРМАЛЬДЕГИД из УРОТРОПИНА?Скачать  Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать  25. Схема реакции и химическое уравнениеСкачать  Качественная реакция ионов алюминия с гидрофосфатом натрияСкачать  Получение Йодоформа. Реакция Ацетона, Йода и Гидрооксида Натрия. Реакция C3H6O, I2 и NaOH.Скачать  Все химические свойства альдегидов | Химия ЕГЭ для 10 класса | УмскулСкачать  Реакция фенолфталеина на гидроксид натрияСкачать  Электролиз. 10 класс.Скачать  Реакции металлов с кислородом и водой. 8 класс.Скачать  Реакция Хлората Натрия и Соляной Кислоты. Реакция NaClO3 и HCl. Выделение Хлора.Скачать  Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать  Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать  |