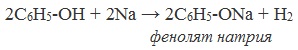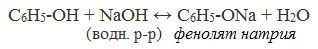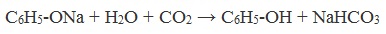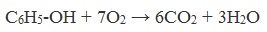Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
- I. Реакции с участием гидроксильной группы
- II . Реакции, с участием бензольного кольца
- III. Реакция окисления
- IV. Качественная реакция! — обнаружение фенола
- Фенолы
- Классификация фенолов
- По числу гидроксильных групп:
- Строение фенолов
- Химические свойства фенолов
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции фенола по бензольному кольцу
- 2.1. Галогенирование
- 2.2. Нитрование
- 3. Поликонденсация фенола с формальдегидом
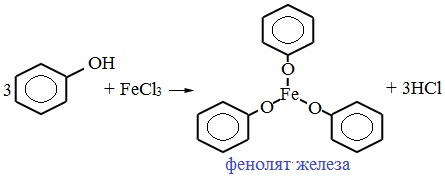
- 4. Взаимодействие с хлоридом железа (III)
- 5. Гидрирование (восстановление) фенола
- Получение фенолов
- 1. Взаимодействие хлорбензола с щелочами
- 2. Кумольный способ
- 3. Замещение сульфогруппы в бензол-сульфокислоте
- Нитрование фенолов
- Нитрование фенолов разбавленной азотной кислотой
- Готовые работы на аналогичную тему
- Нитрование фенолов концентрированной азотной кислотой
- Нитрование фенолов другими нитрующими агентами
- Замещение сульфогруппы нитрогруппой
- 📺 Видео
I. Реакции с участием гидроксильной группы
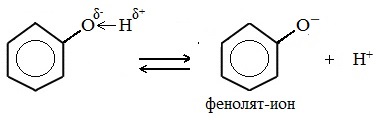
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода:
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
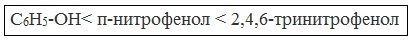
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2 — , Br — )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
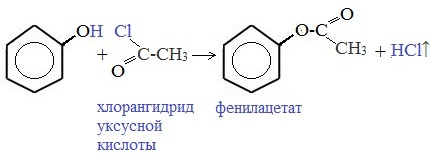
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот:
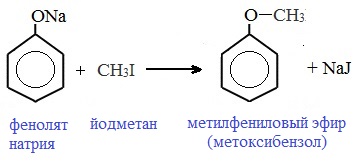
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II . Реакции, с участием бензольного кольца
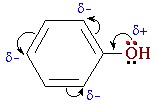
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+ М -эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
1) Нитрование
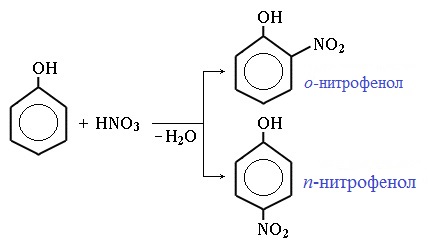
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
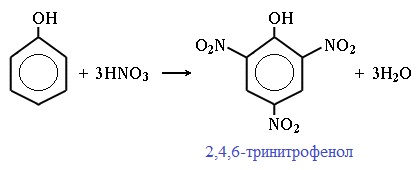
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.
2) Галогенирование
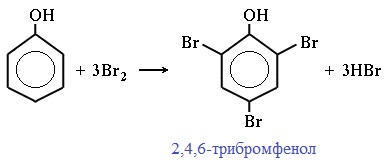
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол! ):
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: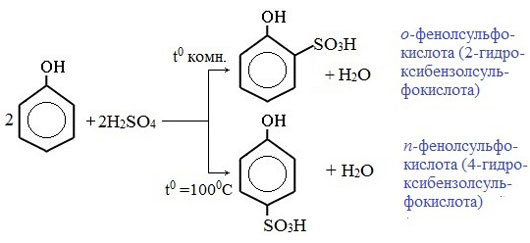
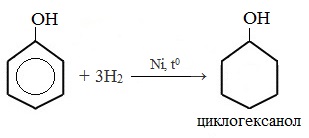
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
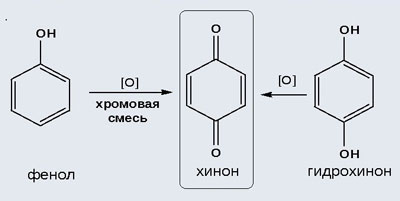
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! — обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Видео:Какие продукты образуются при реакции фенола с азотной кислотой? 1) 2-нитрофенол; 2) 3-нитрСкачать

Классификация фенолов
Видео:9.3. Фенол: Химические свойстваСкачать

По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Видео:Опыты по химии. Свойства фенолаСкачать

Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Видео:Реакции 16ти металлов с азотной кислотой разной концентрации Reactions of 16 metals with nitric acidСкачать

Химические свойства фенолов
| Сходство и отличие фенола и спиртов. |
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
Видео:9.2. Фенол: Способы полученияСкачать

2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
Видео:Реакции металлов с азотной кислотой. Химический опытСкачать

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видео:Получение ФЕНОЛАСкачать

5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Видео:ФенолыСкачать

Получение фенолов
Видео:Химические свойства феноловСкачать

1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
Видео:Нитрование фенола.Скачать

2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
Видео:Азотная кислота и металлы за 13 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Видео:Получение ФЕНОЛАСкачать

Нитрование фенолов
Вы будете перенаправлены на Автор24
В зависимости от концентрации азотной кислоты при нитровании фенола образуются различные производные. Нитрование фенолов по разному протекает при разных условиях реакции. Так выделяют:
- Нитрование фенолов разбавленной азотной кислотой;
- Нитрование фенолов концентрированной азотной кислотой;
- Нитрование фенолов другими нитрующими агентами;
- Замещение сульфогруппы нитрогруппой.
Видео:Как правильно писать ОВР с азотной кислотой? В интернете кто-то неправСкачать

Нитрование фенолов разбавленной азотной кислотой
Фенол нитрируется разбавленной азотной кислотой даже при комнатной температуре. При этом образуется много побочных продуктов окисления кольца. Однако по этому методу можно получить орто-, так и пара-замещенные нитрофенолы:
Эти продукты легко разделяются вследствии меньшей растворимости о-нитрофенола и его лучшей летучести за счет внутримолекулярной водородной связи между гидроксильной и нитрогруппой:
Таким образом полученные изомеры легко разделяются перегонкой с водяным паром. При этом о-нитрофенол имеет большую летучесть (меньшую температуру кипения) вследствие образования внутримолекулярных водородных связей. Для п-изомера, в отличие от орто-, характерные межмолекулярные водородные связи с молекулами воды или между собой в зависимости от концентрации:
Готовые работы на аналогичную тему
Видео:Взаимодействие металлов с кислотами. 8 класс.Скачать

Нитрование фенолов концентрированной азотной кислотой
При воздействии на фенол азотной кислотой средней концентрации образуется 2,4-динитрофенол. А при нитровании фенола концентрированной $HNO_3$ легко образует тринитрофенол (пикриновая кислота):
Пикриновую кислоту впервые получил П. Вульф 1771, а название ей дал Ж. Дюма.
Получение пикриновой кислоты при нитровании фенола сопровождается нежелательным окислениями и осмолениями. Поэтому в целях предотвращения таких побочных процессов сначала сульфируют фенол к образованию 4-гидрокси-1,3-бензолдисульфоновои кислоты, значительно более устойчивой к окислению при воздействии концентрированной $HNO_3$. При этом в дисульфоновой кислоте замещается не только атом водорода в о-положении, но и обе сульфогруппы и нитрогруппы (электрофильное замещение). Именно таким способом в промышленности получают пикриновую кислоту:
Видео:36. Фенолы (часть 2)Скачать

Нитрование фенолов другими нитрующими агентами
Для нитрования фенолов в качестве нитрующего агента кроме азотной кислоты можно использовать ацетилнитрат и $N_2O_4$, эти реагенты способствуют преимущественному нитрованию в орто-положение к гидроксильной группе.
Видео:10 класс - Химия - Фенол. Получение. Химические свойства. ПолучениеСкачать

Замещение сульфогруппы нитрогруппой
Как это показано выше — если обработать фенол последовательно серной, а затем азотной кислотой, то можно получить 2,4,6-тринитрофенол (пикратная кислота). Сначала за реакцией сульфирования образуется 4-гидроксибензол-1,3-дисульфокислота, которая нитрируется на холоде азотной кислотой в свободное opтo-положение. При повышении температуры сульфогруппы замещаются на две нитрогруппы:
Реакция, по которой сульфогруппы замещаются на нитро или другие группы, чаще всего встречается как побочный процесс. Ее механизм аналогичен электрофильному замещению протона с той разницей, что высвобождается другой катион. Лучше всего она проходит, когда в ядре присутствуют сильные орто-, пара-oриентанты, или такие группы, которые образуют относительно устойчивые молекулы. Сульфогруппа проявляет такую способность потому, что она выделяется в виде нейтральной молекулы $SO_3$, что связывается водой. Это пример так называемого шсо-замещения, когда электрофил атакует то же положение, в котором уже находится заместитель.
Обратную реакцию десульфирования — с заменой сульфогруппы на атом водорода можно осуществить нагревом аренсульфокислоты с разведенной серной кислотой при 180-200 $^circ$С. Введение сульфогруппы можно использовать для временной блокировки определенных положений в ароматическом кольце объемным заместителем — сульфогруппой, которую затем можно заместить на другую группу ($NO_2$, $Cl$, $Br$) или атом водорода.
Первая стадия этого преобразования предусматривает сульфирование фенола. По этой реакции можно ввести только две сульфогруппы. Введение первой имеющейся в ядре гидроксильной группой направляется в паро-положение. Замещение в образовавшейся 4-фенолсульфокислоте проходит по второму положению согласно согласованной ориентацией гидроксильной и сульфогруппы, что направляет вторую сульфогруппу в пара-положение. Две сульфогруппы так дезактивируют дальнейшее замещение, что фенолдисульфокислота может быть выделена из реакционной смеси. Дальнейшее взаимодействие с азотной кислотой ведет к образованию пикратной кислоты.
Реакция, по которой сульфогруппы замещается нитро или другой группой, чаще всего встречается как побочный процесс. Ее механизм аналогичен электрофильному замещению протона с той разницей, что высвобождается другой катион. Лучше всего она проходит, когда в ядре присутствуют сильные орто-, пара-ориентанты, или такие группы, которые образуют относительно устойчивые молекулы. Сульфогруппа проявляет такую способность благодаря тому, что она выделяется в виде нейтральной молекулы $SO_3$, которая связывается водой. Это пример так называемого ипсо-замещения, когда электрофил атакует то же положение, в котором уже находится заместитель.
📺 Видео
Химические свойства фенола. 10 класс.Скачать

Химия 10 класс (Урок№7 - Фенолы и ароматические спирты.)Скачать