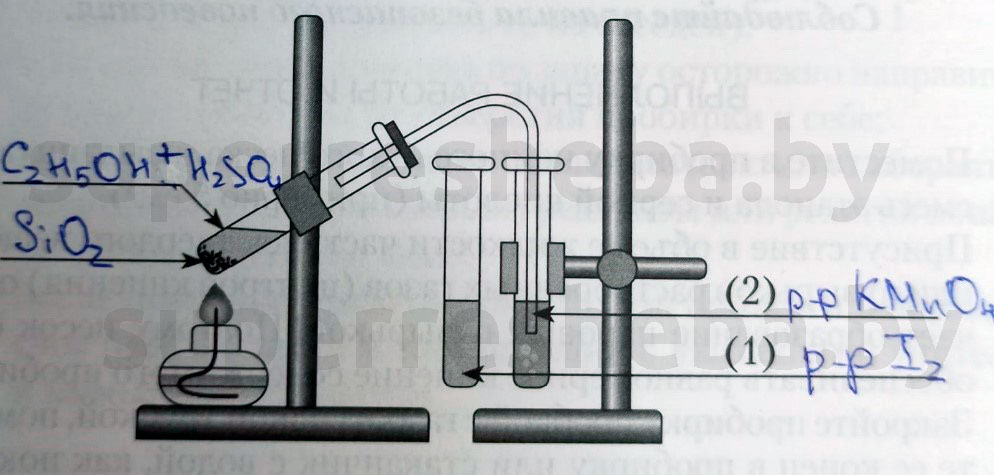
Напишите над стрелками формулы или названия веществ в пробирках.
Объясните явления, которые наблюдаются в процессе получения этилена.
В процессе получения мы наблюдали появление пузырьков газа и обесцвечивание растворов иода и перманганата калия. (Причины обесцвечивания приведены далее).
Приведите уравнение реакции получения этилена.
+ ° C 2 H 4 ↑ + H 2 O .
Объясните явления, наблюдаемые при пропускании этилена в пробирки с растворами иода (1) и перманганата калия (2).
В процессе получения этилена мы наблюдали обесцвечивание растворов иода и перманганата калия, потому что образовывались бесцветные продукты реакции. Раствор перманганата обесцвечивался, т.к. в ходе реакции перманганат переходил в щелочь и оксид марганца (IV), а раствора иода – потому что молекулы иода встраивались в молекулу этилена.
Приведите уравнения реакции этилена с раствором иода.
Приведите схему реакции этилена с раствором K M n O 4 mathrm K M n O 4 .
Приведите уравнение реакции горения этилена.
1. Напишите, благодаря наличию какого структурного фрагмента в молекулах алкенов они вступают в реакции с иодной и бромной водой. К какому типу относятся данные реакции?
Алкены вступают в реакции с иодной и бромной водой благодаря наличию двойной связи. Эти реакции относятся к реакциям присоединения.
2. В каких условиях реагируют с бромом алканы? К какому типу относится реакция алканов с бромом?
Алканы реагируют с бромом на свету. Это реакция замещения.
3. Сравните отношение к бромной воде алканов и алкенов. Можно ли различить этан и этен при помощи бромной воды?
Да, можно. При пропускании этана через бромную воду раствор брома не будет обесцвечиваться, а при пропускании этена — будет.
Видео:Взаимодействие этилена с бромной водойСкачать

Лабораторная работа по химии «Качественное определение углерода в органических веществах. Получение этилена и изучение его свойств»
Разделы: Химия
Тема урока: Качественное определение углерода в органических веществах. Получение этилена и изучение его свойств.
— обеспечить закрепление знаний о химических свойствах предельных и непредельных углеводородов;
— экспериментально подтвердить теоретические знания о лабораторных способах получения этилена и его взаимодействия с веществами;
— наблюдение химических явлений.
— формирование практических умений и навыков обращения с лабораторным оборудованием;
— развить исследовательские умения наблюдать, анализировать, делать выводы.
— развитие познавательного интереса к изучению химии;
— воспитание культуры проведения опытов и соблюдения правил техники безопасности.
Тип занятия: урок формирования и совершенствования умений и навыков.
Вид занятия: лабораторная работа;
Методическое обеспечение: инструкционная карта на выполнение лабораторной работы №7, презентация Power Point.
Оснащение: мультимедиа проектор, компьютер, набор реактивов для выполнения лабораторной работы №7.
Урок сопровождается презентацией. Приложение 1
I. Организационный момент
Приветствие, проверка отсутствующих, проверка готовности студентов к занятию.
II. Сообщение темы занятия, постановка целей урока
Сегодня мы приступаем к выполнению Лабораторной работы №7, по теме: «Качественное определение углерода в органических веществах. Получение этилена и изучение его свойств».
Цель нашего занятия: выявить свойства предельных и непредельных углеводородов с помощью характерных химических реакций. Освоить навыки получения этилена в лабораторных условиях.
Послушайте внимательно притчу, и сделайте выводы:
В очень давние времена при дворе китайского императора жил-был один старый садовник. Цветы и плоды из императорских садов славились по всему Китаю. Росло в саду грушевое дерево, которое плодоносило раз в десять лет, и лишь тогда созревали груши когда было теплое лето. Однажды весной император вызвал своего садовника и приказал, что бы осенью тот принес ему зрелые груши. И пообещал наградить его золотом: «Я дам тебе столько золота, сколько будут весить груши, которые ты мне принесешь. А если не исполнишь — прикажу казнить».
Лето выдалось холодное, не было ни какой надежды, что груши созреют. Но садовник снял недозрелые груши, разложил их в своей комнате и стал окуривать их ладаном. Груши налились, стали янтарно-желтыми и пахли медом. Но садовник не понес груши императору, а раздал детям и после этого исчез. Секрет дозревания груш исчез вместе с ним.
Прошло много столетий прежде чем проверили состав дыма ладана. Оказалось, что в его дыме имеется бесцветный легкий газ — этилен. В настоящее время он используется для дозревания плодов. Назовите другие области применения этилена?
(Предполагаемый ответ: Этилен применяется при изготовлении каучука, растворителей, этилового спирта; при полимеризации этилена получаю полиэтилен — синтетическое высокомолекулярное вещество.)
III. Проверка теоретических знаний студентов
Фронтальный опрос студентов:
1. Какие из этих веществ изомерны между собой?
2. Какое слово лишнее в ряду: метан, пентан, бутен, гексан, октан, декан.
3. Исправьте ошибку в строении молекулы и назовите алкен:
4. Назовите алкен следующего строения:
5. Каким способом в лабораторных условиях получают этилен, запишите уравнение реакции на доске?
(Предполагаемый ответ: Дегидратация спиртов при нагревании и с использованием в качестве катализатора Н2SO4.
Уравнение реакции: 
6. Почему непредельные углеводороды химически более активны, чем предельные?
(Предполагаемый ответ: Непредельные углеводороды химически более активны за счет наличия кратных связей. «Пи»- связь менее прочная, чем «сигма» — связь, поэтому она легко разрушается под действием различных реагентов)
7. Допишите реакцию:
Какие вещества можно идентифицировать с помощью данной реакции
Реакция с бромной водой является качественной реакцией на все непредельные углеводороды.)
8. Какие продукты реакции образуются при полном окислении углеводородов?
(Ответ: При полном окислении углеводородов в избытке кислорода образуются углекислый газ СО2 и вода Н2О .)
9. Вставьте пропущенные слова:
При присоединении веществ типа НХ, где Х = гплоген, — ОН группа, к несимметричным алкенам, атом водорода присоединяется к атому . у . связи, связанному с . числом атомов . .
(Ответ: углерода; кратной (двойной); наибольшим; водорода )
10. Завершите предложение:
Полимеризацией называется процесс соединения одинаковых молекул (мономеров), протекающий за счет разрыва кратных связей, с образованием . .
(Ответ: высокомолекулярного соединения (полимера).)
Часть студентов получает письменные задания: (Приложение 2)
IV. Текущий инструктаж — представление правил техники безопасности с использование презентации.
Прежде чем приступить к самостоятельно работе, необходимо ознакомиться с правилами техники безопасности:
1. Соблюдать осторожность при работе с нагревательными приборами.
2. Спиртовку зажигать, не наклоняя к другой спиртовке, а поднося зажженную спичку к фитилю спиртовки.
3. Гасить спиртовку, накрывая колпаком.
4. При работе с реактивами соблюдать осторожность, не допуская попадания на одежду и кожу.
На данной лабораторной работе вы впервые сталкиваетесь с жидкостями органического происхождения, которые легко проникают в организм в виде паров через кожу. Пары как правило раздражают верхние дыхательные пути, слизистые оболочки глаз и носа.
5. В избежании ожога слизистых оболочек не следует подносить реактивы к лицу, пробовать их на вкус.
V. Самостоятельная работа студентов
Каждый из вас получил инструкционную карту на выполнение лабораторной работы №7. (Приложение 3). Ваша задача подробно изучить инструкционную карту: понять какие цели стоят перед вами при выполнении данной работы; какие умения и навыки вы должны приобрести в ходе выполнения работы. Проверьте соответствует ли набор реактивов заявленному в перечне приборов и реактивов. Еще раз обратите внимания на правила техники безопасности. Тщательно изучите методику проведения опытов, и проделайте опыты. Оформите все записи в тетрадь соответственно предъявляемым в инструкционной карте требованиям.
VI. Итоговые отчеты студентов о проделанной работе
Обратите внимание на пункт инструкционной карты «подведение итогов». После того как вы проделаете все опыты и заполните таблицу с данными приступайте к выполнению итогового задания.
1. Объясните, почему при сгорании муки образуется обуглившаяся масса черного цвета, ведь органические вещества сгорая разлагаются на воду и углекислый газ?
(Предполагаемый ответ: масса черного цвета свидетельствует об образовании углерода, это говорит о том, что произошла реакция неполного окисления, то есть при недостатке кислорода.)
2. Какую роль играет концентрированная серная кислота при получении этилена из этилового спирта.
(Предполагаемый ответ: Концентрированная серная кислота выступает катализатором данного процесса.)
3. Запишите уравнение реакции этилена с йодной водой в структурной форме.
4. Объясните, почему этилен обесцвечивает раствор перманганата калия.
(Предполагаемый ответ: Раствор перманганата калия обесцвечивается в при действии на него этиленом потому, что в процессе реакции образуются двухатомные спирты (диолы) — бесцветные вещества.)
Каждый должен предоставить отчет о проделанной работе в виде: грамотна оформленной тетради, заполненной таблицы с данными о проделанных опытах, и выполненным итоговым заданием из инструкционной карты.
(По усмотрению преподавателя задаются дополнительные вопросы.)
VII. Подведение итогов занятия
Если у кого-то есть вопросы прошу их задавать. Все ли вам понятно? Оценки за урок.
VIII. Домашнее задание
Повторить материал учебника со страниц 189-221.
Составьте цепочку превращений используя изученный материал по темам: «Алканы», «Алкены», «Алкадиены», «Алкины».
Видео:Реакция этилена с раствором перманганата калияСкачать

Получение этилена и опыты с ним
методическая разработка по химии (10 класс) на тему
Практическая работа по химии
Видео:Взаимодействие этилена с бромной водойСкачать

Скачать:
| Вложение | Размер |
|---|---|
| poluchenie_etilena_i_opyty_s_nim.doc | 197.5 КБ |
Видео:Практическая работа "Получение этилена и опыты с ним" 10 классСкачать

Предварительный просмотр:
«Получение этилена и опыты с ним»
Цель: уметь получать этилен в лабораторных условиях, доказывать его наличие, подтверждая химическими реакциями, пользоваться химическим оборудованием и реактивами.
Оборудование : металлический штатив, спиртовка, спички, лучинка, штатив с пробирками.
Реактивы: этиловый спирт – С 2 Н 5 ОН, H 2 SO 4 — концентрированная, раствор КМnO 4 , йодная вода, песок прокаленный.
Правила техники безопасности
Осторожно работайте с химическим оборудованием!
Осторожно обращайтесь с концентрированной серной кислотой H 2 SO 4 !
- Запрещается пробовать вещества на вкус (а);
- брать вещества руками (б);
- менять пробки и пипетки от различных банок или склянок (в);
- надо работать только над столом (г);
- смыть водой, затем нейтрализующим веществом реактив, если он попал на кожу или одежду (д);
Прежде чем выполнять работу ответьте на вопросы и используйте их в формулировке выводов:
- Почему серная кислота, применяющаяся в опыте, должна быть концентрированной?
- К какому классу углеводородов относиться этилен? Как это можно доказать?
- Почему этилен легко обесцвечивает йодную воду и раствор перманганата калия, а метан не обесцвечивает их?
Опыт 1. Получение этилена
- Рассмотрите и соберите прибор как показано на рисунке, проверьте его на герметичность.
- Отмерьте мерным цилиндром 1мл этилового спирта и перелейте в пробирку, затем осторожно добавьте 3 мл концентрированной серной кислоты.
- Поместите в смесь немного предварительно прокаленного песка (или кусочек пемзы), чтобы избежать толчков жидкости при кипении
- Закройте пробирку пробкой с газоотводной трубкой и укрепите в штативе. Конец газоотводной трубки опустите в пробирку с йодной водой (бромной водой).
- Осторожно нагревайте смесь!
- Оформите работу в соответствии с образцом (табл.1)
- Опишите физические свойства этилена:
- Агрегатное состояние
- Цвет
- Запах
Опыт 2. Взаимодействие этилена с йодной (бромной) водой
• Пропускайте этилен через 1-2 мл йодной (бромной) воды.
• Следите, чтобы нагревание смеси не прекращалось. Не допускайте переброс жидкости из пробирки в прибор.
• Какие изменения происходят с йодной (бромной) водой? Объясните наблюдаемое явление.
Опыт 3. Взаимодействие этилена с раствором перманганата калия
• Пропускайте газ через 1-2 мл раствора перманганата калия.
• Объясните, что наблюдаете?
Опыт 4. Горение этилена на воздухе
• Выньте газоотводную трубку из раствора, и повернув её отверстием к верху, подожгите выделяющийся газ.
• Каким (светящимся или несветящимся) пламенем горит этилен? Дайте объяснение.
• Потушите спиртовку. Выделение этилена постепенно прекратится.
Рисунок с соответствующими надписями. Наблюдения.
📸 Видео
Опыты по химии. Получение этилена и опыты с нимСкачать

ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Химия с нуля — Химические свойства АлкеновСкачать

Получение и изучение свойств этилена. Опыт 2Скачать

Опыты по химии. Растворение йода в воде и спиртеСкачать

Горение этиленаСкачать

Получение этилена и изучение его свойств. Практическая работа №2. 11 классСкачать

Взаимодействие ацетилена с бромной водойСкачать

Отношение бензола к бромной воде и раствору перманганата калияСкачать

Непредельные углеводороды (алкены)Скачать

Получение этилена и его горениеСкачать

Взаимодействие фенола с бромной водойСкачать

МАГИЯ в Химии — Способы Получения АлкеновСкачать

Получение этилена и изучение его свойствСкачать

Галилео. Эксперимент. Эндотермическая реакцияСкачать

2.3. Алкены: Химические свойстваСкачать