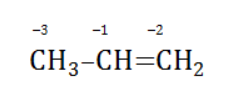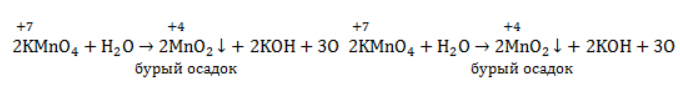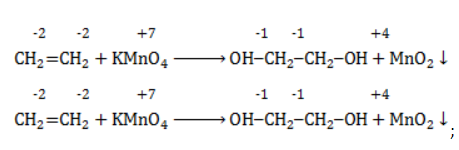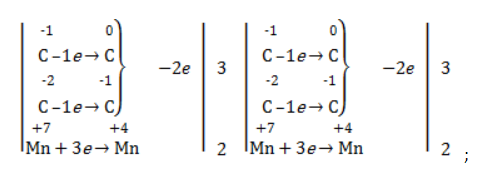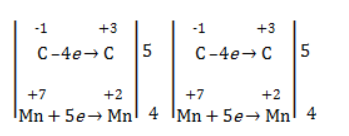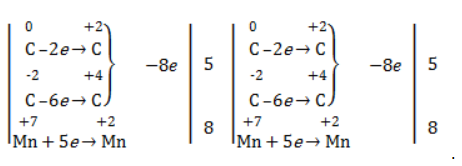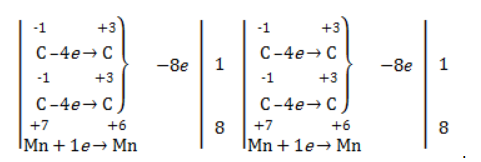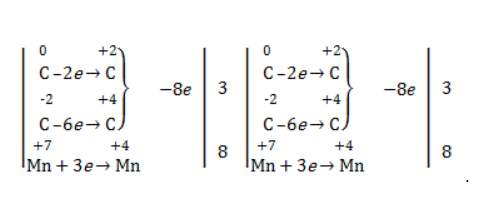В отличие от предельных углеводородов, алкены характеризуются высокой химической активностью, обусловленной особенностями строения молекулы. При обычных условиях алкены охотно вступают в реакции неполного окисления с превращением в органические соединения других классов. Универсальный реагент в процессах окисления алкенов – перманганат калия.
- Понятие о неполном окислении
- Определение степеней окисления
- Влияние среды на окислитель
- Мягкое окисление
- Жесткое окисление
- Окисление перманганатом калия в кислой среде
- Окисление алкенов в щелочной среде
- Окисление в нейтральном растворе
- Заключение
- Взаимодействие этилена с бромной водой
- Реакция этилена с раствором перманганата калия
- Практическая работа № 2 Получение этилена и изучение его свойств.
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Химия: теория и методика преподавания в образовательной организации
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- 📸 Видео
Видео:Взаимодействие этилена с раствором перманганата калияСкачать

Понятие о неполном окислении
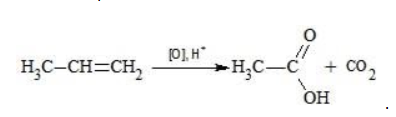
В химии органических соединений под окислением понимается взаимодействие, при котором происходит обеднение реагента водородом или обогащение кислородом, сопровождающееся отдачей электронов молекулой. Обратный процесс называется восстановлением.
Полное окисление происходит при горении углеводородов с разрушением молекулы. Продуктами в этом случае являются углекислый газ и вода. При неполном окислении продуктами становятся различные вещества.
Высокая реакционная способность алкенов обусловливается присутствием в молекуле двойной связи. Один из ее компонентов – слабая 
Определение степеней окисления
Для того чтобы правильно записать уравнение реакции неполного окисления алкена, нужно определить степени окисления атомов до вступления во взаимодействие и после него. Они рассчитываются исходя из электроотрицательности элементов.
Например, при окислении пропена перманганатом калия 


- В составе группы
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
, отнимая у водородных атомов по одному отрицательному заряду. На связи
сдвига электронов нет. Следовательно, атом углерода приобретает степень окисления -2 -2;
- В группе
аналогичный подсчет показывает для углерода степень окисления -1 -1 (для каждого водорода соответственно +1 +1);
- В радикале
углерод оттягивает на себя отрицательные заряды с трех водородных атомов и имеет степень окисления -3 -3.
В общем виде результат можно записать следующим образом:
Расчет степеней окисления в кислородсодержащих соединениях производится аналогично с учетом большей электроотрицательности кислорода.
Видео:Реакция этилена с раствором перманганата калияСкачать

Влияние среды на окислитель
Состав раствора (наряду с температурой) определяет, до какого соединения окислится восстановитель – алкен. Окислитель в растворах с различным уровнем кислотности (щелочности) также ведет себя неодинаково.
Неорганическая соль 


В нейтральной и слабощелочной среде марганец приобретает степень окисления +4 +4:
Кислород из перманганат-аниона присоединяется к алкену по месту двойной связи.
Под воздействием серной кислоты марганец восстанавливается до степени окисления +2 +2:
При окислении со щелочью (гидроксид лития достаточно высокой концентрации) марганец восстановится до +6 +6:
Видео:Окисление органических соединений перманганатом калияСкачать

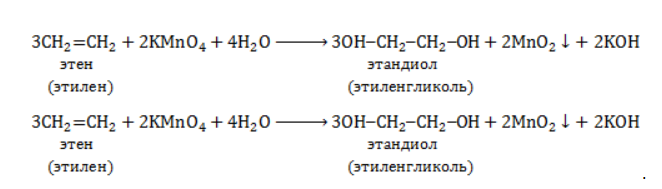
Мягкое окисление
Процесс в нейтральной или слабощелочной среде при обычной температуре представляет собой так называемое мягкое окисление перманганатом калия, или гидроксилирование. В алкене разрывается 
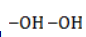
- кислород из перманганат-иона;
- вода.
Продукт реакции – диол (двухатомный спирт). Например, окисление этилена перманганатом калия приводит к образованию этиленгликоля:
Для составления полного уравнения нужно:
- определить степени окисления реагентов:
- рассчитать электронный баланс:
- расставить коэффициенты:
- ввести в уравнение недостающие реагенты и продукты, исходя из равенства состава в левой и правой частях уравнения, и определить окончательные коэффициенты:
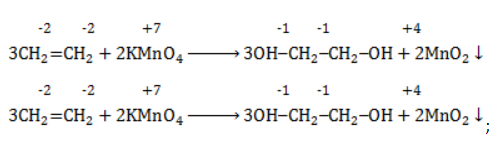
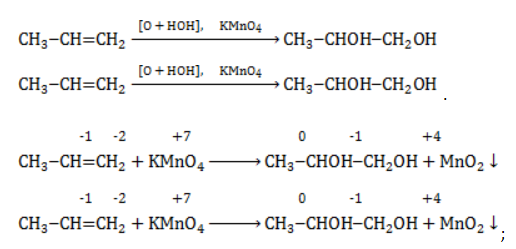
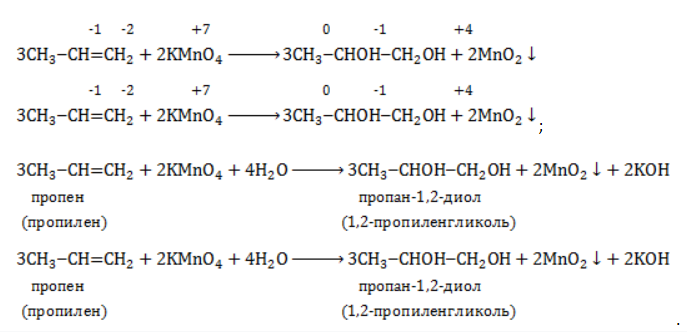
Реакция окисления пропена в нейтральной среде перманганатом калия составляется аналогично:
Дальше мягкое окисление не идет, так как 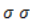
Видео:Опыты по химии. Получение этилена и опыты с нимСкачать

Жесткое окисление
Жесткими называют процессы окисления, протекающие в нейтральном растворе в условиях повышенной температуры, а также при добавлении кислоты или щелочи. В этих случаях двойная связь в алкене разрушается полностью, а продуктами реакции становятся кетоны, кислоты (с промежуточным окислением до альдегида) либо соли.
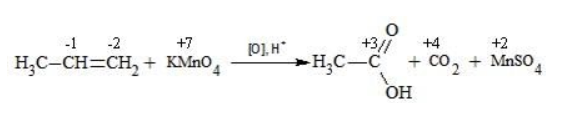
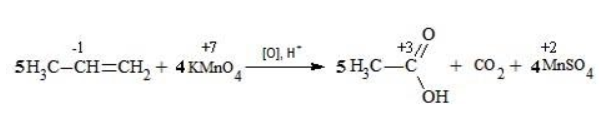
Окисление перманганатом калия в кислой среде
Пропен в содержащем кислоту растворе 

Степени окисления участвующих в реакции углеродных атомов и марганца составят:
Электронный баланс определяется только с учетом углерода, вошедшего в состав кислоты:
Сначала расставляются коэффициенты в окислителе, восстановителе и в продуктах окисления:
Затем вписываются недостающие вещества и полностью рассчитываются коэффициенты:
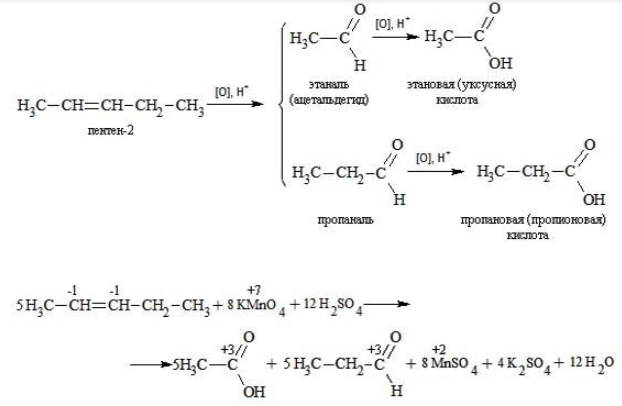
Еще один пример жесткого окисления алкенов перманганатом калия с серной кислотой – реакция с участием пентена-2. Молекула расщепляется по месту двойной связи, и ее фрагменты окисляются через промежуточное образование альдегидов до двух кислот:
Электронный баланс составляется для двух углеродных атомов алкена, поскольку оба они являются восстановителями.
Правило, по которому осуществляется окисление углерода, отражено в таблице:
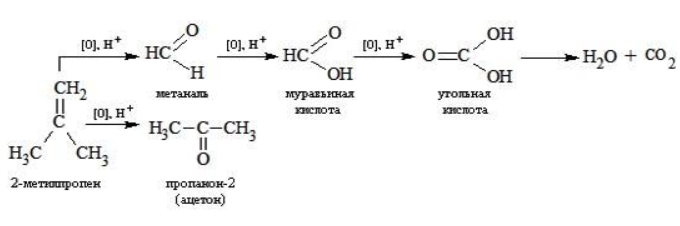
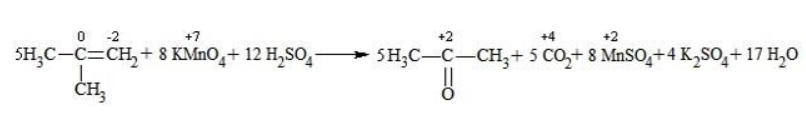
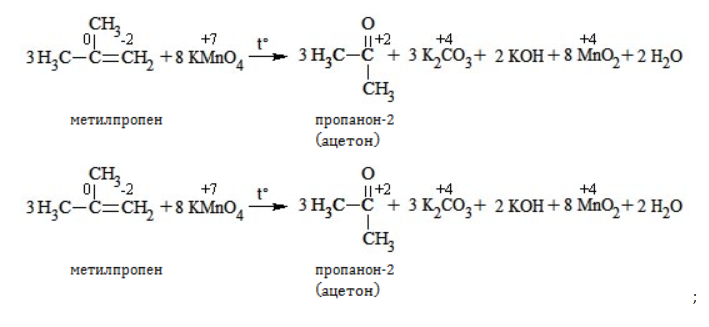
Так, в 2-метилпропене первичный атом окисляется через промежуточные формальдегид (метаналь) и муравьиную кислоту полностью – до углекислого газа, а третичный – только до ацетона:
Окисление алкенов в щелочной среде
При нагревании с концентрированной щелочью алкены окисляются до солей:
Если один из углеродных атомов – первичный, он окисляется до углекислого газа:
Окисление в нейтральном растворе
В условиях высокой температуры образующаяся щелочь вступает в реакцию, в результате которой окисление алкенов продолжается до образования кетонов или солей. Так, при жестком окислении пропена в нейтральной среде получаются те же продукты, что и в присутствии концентрированного гидроксида калия: ацетат 




Кетон – результат окисления третичного углеродного атома, и дальнейшую реакцию они не поддерживают. Например, при окислении метилпропена как конечный продукт образуется ацетон:
Видео:Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать

Заключение
Взаимодействие с раствором перманганата калия в мягких или жестких условиях является показателем высокой реакционной способности алкенов, которая обусловлена присутствием в молекуле легко разрываемой -связи. Реакции мягкого и жесткого окисления относятся к числу характерных химических свойств алкенов как ненасыщенных углеводородов.
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Взаимодействие этилена с бромной водой
Наличие кратной связи в молекуле этилена можно определить пропусканием этилена через раствор брома Br2 в воде (бромной воды) жёлтого цвета. Бромная вода быстро обесцвечивается. Бром присоединяется к этилену, при этом разрушается двойная связь.
Так при помощи бромной воды можно определить, что этилен — непредельный углеводород.
Видео:ОКИСЛЕНИЕ АЛКЕНОВ ЕГЭ / жёсткое, мягкое окисление в органике с KMnO4Скачать

Реакция этилена с раствором перманганата калия
Наличие кратной связи вмолекуле этилена можно определить пропусканием этилена через подкисленный раствор перманганата калия KMnO4 розового цвета. В процессе реакции этилен будет окисляться до двухатомного спирта — этиленгликоля, при этом происходит обесцвечивание раствора перманганата калия.
Эта реакция является качественной реакцией на двойную связь.
Видео:Взаимодействие ацетилена с раствором перманганата калияСкачать

Практическая работа № 2 Получение этилена и изучение его свойств.
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Нечаев Дмитрий Валерьевич, учитель химии
ГУ ЛНР «ЛУВК « ИНТЕЛЛЕКТ»
Практическая работа № 2
Получение этилена и изучение его свойств.
Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички.
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
В пробирку налили 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпали немного прокаленного песка (чтобы предотвратить толчки жидкости при кипении). Закрыли пробирку пробкой с газоотводной трубкой, закрепили ее в штативе и осторожно нагрели содержимое пробирки.
В пробирке начинается выделяться газ — этилен.
В ходе реакции концентрированная серная кислота забирает воду из спирта, врезультате образуется этилен.
Такую реакцию называют – реакция дегидратации.
Изучение свойств этилена.
В другую пробирку налили 2-3 мл бромной воды. Опустили газоотводную трубку первой пробирки до дна пробирки с бромной водой и пропускали через неё выдедяющийся газ.
При пропускании газа через бромную воду, происходит обесцвечивание бромной воды.
В ходе реакции происходит окисление этилена бромной водой по двойной связи.
В третью пробирку налили 2-3 мл разбавленного раствора KMnO 4 , поодкисленного серной кислотой, и пропустили через него газ.
При пропускании газа через подкисленный раствор KMnO4 , происходит обесцвечивание раствора KMnO 4 .
В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия.
Выделяющиеся газ первой пробирки подожгли.
Этилен на воздухе горит ярким светящимся пламенем.
Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей.
Общий вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата калия.
Какой из гомологов этена имеет плотность по воздуху 1,45?
Ответ: D (возд.) = Mr ( алкена)/Mr (воздуха);
Mr ( алкена) = D (возд.)* Mr (воздуха);
Mr ( алкена) = 1,45*29 = 42.
Какой из гомологов пропена имеет плотность по водороду 14?
Ответ: D (Н2) = Mr ( алкена)/Mr (Н 2 );
Mr ( алкена) = 14*2 = 28.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 858 человек из 78 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 46 человек из 20 регионов
Курс профессиональной переподготовки
Химия: теория и методика преподавания в образовательной организации
- Сейчас обучается 376 человек из 64 регионов
«Мотивация здорового образа жизни. Организация секций»
Свидетельство и скидка на обучение каждому участнику
- Для всех учеников 1-11 классов
и дошкольников - Интересные задания
по 16 предметам
«Как закрыть гештальт: практики и упражнения»
Свидетельство и скидка на обучение каждому участнику
Видео:Окисление алкенов с Тасей | Химия ЕГЭСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 844 389 материалов в базе
Ищем педагогов в команду «Инфоурок»
Другие материалы
- 13.02.2018
- 1769
- 3
- 13.02.2018
- 657
- 0
- 13.02.2018
- 636
- 1
- 13.02.2018
- 69192
- 768
- 13.02.2018
- 1491
- 6
- 13.02.2018
- 1129
- 0
- 13.02.2018
- 310
- 0
- 13.02.2018
- 1626
- 1
«Учись, играя: эффективное обучение иностранным языкам дошкольников»
Свидетельство и скидка на обучение
каждому участнику
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 13.02.2018 144584
- DOCX 209.6 кбайт
- 1030 скачиваний
- Рейтинг: 4 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Нечаев Дмитрий Валерьевич. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 4 года и 2 месяца
- Подписчики: 0
- Всего просмотров: 295039
- Всего материалов: 25
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:ОВР с перманганатом калия.Скачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Онлайн-конференция о профессиональном имидже педагога
Время чтения: 2 минуты
Вузы РФ не будут повышать стоимость обучения на первом курсе
Время чтения: 1 минута
Российские школьники начнут изучать историю с первого класса
Время чтения: 1 минута
Онлайн-семинар о здоровом образе жизни и организации секций
Время чтения: 2 минуты
Минпросвещения рекомендует школьникам сдавать телефоны перед входом в школу
Время чтения: 1 минута
С 1 сентября в российских школах будут исполнять гимн России
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
📸 Видео
ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Реакция серной кислоты и перманганата калия. Химическая реакция.Скачать

Реакция Между Перманганатом Калия, Сульфатом Марганца и Серной Кислотой. Сульфат Марганца(4).Скачать

Окисление Толуола Перманганатом Калия В Сернокислой СредеСкачать

Перманганат калия: химические свойства, качественные реакции, ОВР в органике и неорганикеСкачать

Химия с нуля — Химические свойства АлкеновСкачать

ОБЕСЦВЕЧИВАНИЕ РАСТВОРА. Реакция Перманганата Калия, Серной Кислоты И Перекись Водорода.Скачать

Реакция Йодида Калия, Перманганата Калия и Серной Кислоты. Выпадение Йода. Реакция KI, KMnO4 и H2SO4Скачать

Практическая работа №13. Свойства газа этилена. 9 класс.Скачать

Отношения бензола к бромной воде и раствору перманганата калияСкачать



 углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей