Получение и применение этилена.
Этилен впервые был получен немецким химиком Иоганном Бехером в 1680 году при действии купоросного масла на винный спирт. Вначале его отождествляли с «горючим воздухом», т.е. с водородом. Позднее, в 1795 году этилен подобным же образом получили голландские химики Дейман, Потс-ван-Труствик, Бонд и Лауеренбург и описали под названием «маслородного газа», так как обнаружили способность этилена присоединять хлор с образованием маслянистой жидкости — хлористого этилена («масло голландских химиков»). Изучение свойств этилена, его производных и гомологов началось с середины ХIХ века. Начало практическому использованию этих соединений положили классические исследования А.М. Бутлерова и его учеников в области непредельных соединений и особенно созданная Бутлеровым теория химического строения. В 1860 году он получил этилен действием меди на йодистый метилен, установив структурную формулу этилена. Этилен представляет собой бесцветный газ, обладающий слабым, едва ощутимым запахом. Он плохо растворим в воде (при 0°С в 100 г воды растворяется 25,6 мл этилена), горит светящимся пламенем, образует с воздухом взрывчатые смеси. Термически менее устойчив, чем метан. Уже при температурах выше 350°С этилен частично разлагается на метан и ацетилен:
3С2Н4 2СН4 + 2С2Н2 При температуре около 1200°С диссоциирует главным образом на ацетилен и водород:
С2Н4 С2Н2 + Н2 В природных газах (за исключением вулканических) этилен не встречается. Он образуется при пирогенетическом разложении многих природных соединений, содержащих органические вещества. Процесс пиролиза для получения этилена осуществляется в печах различного устройства пропусканием газообразных углеводородов или их паров в присутствии катализаторов при температуре 760-780°С. Обычно используются печи трубчатого типа. Этилен можно также получить дегидрированием этана:
2СН4 t° С2Н4 + 2Н2 и осторожным гидрированием ацетилена:
С2Н2 + Н2 кат С2Н4 Для получения этилена и его гомологов методом пиролиза в качестве сырья используют этан, пропан, бутан, содержащиеся в попутных газах нефтедобычи, газах термического и каталитического крекингов, а также жидкие углеводороды: газовый бензин и низкоактановые бензино-легроиновые фракции прямой гонки нефти. Производительность существующих печей для пиролиза углеводородов составляет 3,5-4 т перерабатываемого сырья в час. Печи новой конструкции рассчитаны на переработку 7-10т сырья в час. При определённых условиях пиролиза бензина при получении 1т этилена может быть одновременно выделено: пропилена — 0,65т; изобутилена — 0,11т; н- бутиленов — 0,11т, дивинила — 0,12т; бензола — 0,165т и толуола — 0,08т, использование которых позволит значительно улучшить технико-экономические показатели нефтехимических производств. Из этилена получают более 200 ценных соединений, важнейшими из которых являются хлористый этил, дихлорэтан-1,2, этиленхлоргидрин, окись этилена, диоксан, этиленгликоль, этиловый эфир этиленгликоля, уксусногликолевый эфир, диэтиленгликоль, этиламин, этаноламин, диэтаноламин, триэтаноламин.
Галогенирование этилена.
Обычной реакцией между галогенами и непредельными углеводородами является присоединение атомов галогена по месту двойной связи с образованием галогенопроизводных с чётным числом атомов галогена. Однако у олефинов с разветвлёнными цепями, а при высокой температуре и у олефинов нормального строения галогенирование протекает сложнее, с образованием полихлоридов и непредельных моногалогенопроизводных. Активность галогенов в реакциях присоединения понижается с увеличением их молекулярного веса. Фтор реагирует весьма энергично, реакция присоединения хлора протекает несравненно медленнее. При хлорировании этилена сначала получается дихлорэтан:
С2Н4 + Сl2 С2Н4Сl2 + 201 кДж Но хлорирование этилена может идти и дальше, в результате чего образуется трихлорэтан и тетрахлорэтан. Выход этих продуктов растёт с повышением температуры реакции. Для торможения цепной реакции замещения при хлорировании этилена и получения более чистого дихлорэтана процесс ведут при низких температурах и в присутствии небольших количеств хлорного железа и О2 . Следует отметить, что Е.В. Алексеевский в 1928 году установил, что при пропускании смеси этилена и хлора над углём при 120°С получается чистый дихлорэтан с выходом в 80% от теоретического. Процесс получения дихлорэтана хлорированием этилена в промышленности осуществляется в реакторе с мешалкой или башне барботажного типа. Заранее тщательно высушенные, во избежании коррозии аппаратуры, хлор и этилен с небольшим избытком последнего (5-10%) поступают раздельно в нижнюю часть реактора1 и барботируют через слой дихлорэтана. Рисунок 1
Избыточный дихлорэтан стекает в сборник 2. Газы, содержащие пары дихлорэтана, хлористый водород, не прореагировавший этилен, поступают в вымораживатель для извлечения дихлорэтана, а оставшиеся газы промываются водой для удаления хлороводорода, после чего выводятся из системы. Из сборника 2 дихлорэтан- сырец насосом 3 направляется в смеситель 4, где растворённый хлористый водород нейтрализуется 5-10%-ным раствором едкого натра. Затем азеотропная смесь дихлорэтан-вода отгоняется при температуре 72°С в колонне азеотропной сушки, не показанной на схеме, и для освобождения от трихлорэтана и других примесей поступает в ректификационную колонну 10. Процесс осуществляется в среде жидкого дихлорэтана, который растворяет хлор и этилен и обеспечивает необходимый отвод тепла из зоны реакции. Циркуляция дихлорэтана через выносной теплообменник позволяет вести реакцию с хорошим выходом при температуре 30-40°С. Дихлорэтан получил широкое практическое применение как неогнеопасный растворитель при извлечении жиров, а также для синтеза таких ценных химических продуктов, как этиленгликоль и его эфиры, этилендиамин, дибензил, хлористый винил, полисульфидный синтетический каучук (тиокол) и др. Дихлорэтан используется для борьбы с вредителями с/х (окуривание или фумигация). Дихлорэтан легко отщепляет хлористый водород, превращаясь в хлористый винил: активир. уголь
СН2Сl-СН2Сl 480-520°С СН2 = СНСl + НСl Производство этого важного для промышленности мономера осуществляется и другими методами. При хлорировании этилена при температуре 430°С образуется хлористый винил:
СН2 = СН2 + Сl2 СН2 = СНСl + НСl Хороший выход наблюдается и при дегидрохлорировании дихлорэтана спиртовым раствором щёлочи:
СН2Сl-СН2Сl + NaOH 75°С, 2,5 атм СН2 = СНСl + NaСl + Н2О Для получения этиленгликоля дихлорэтан нагревают в автоклавах с известью или раствором щелочи. При взаимодействии с известью достаточно 15-20 минутного нагревания при 190°С и 100 атм давления, чтобы получить с выходом 80-85% (А.Л. Клебанский и И.М. Долгопольский, 1933г.). Хорошие результаты получают при омылении в автоклаве формиатом натрия в присутствии метанола:
СН2Сl-СН2Сl +2НСООNa + 2СН3ОН
СН2ОН-СН2ОН +2NaCl +2НСООСН3 Образующийся муравьино-метиловый эфир действием щелочи переводится в формиат натрия и метиловый спирт, которые снова реагируют с дихлорэтаном. Процесс проводится непрерывно. Практический интерес представляют также некоторые непредельные хлорфторпроизводные углеводородов, которые можно получить дихлорированием хлорфторпроизводных предельных углеводородов при действии цинковой пыли, например:
CCl2F-CCl2F + Zn ZnCl2 + CClF = CF2
CCl2F-CCl2F+ Zn ZnCl2 + CF2 = CF2 Эти непредельные соединения способны полимеризоваться под влиянием перекисей и других инициаторов с образованием важных в практическом отношении продуктов. Как непредельные соединения перфторолефины могут быть использованы и для ряда других синтезов.
Гидратация этилена
Гидратация этилена является сейчас одним из основных производственных методов получения этилового спирта. Она осущесвляется в промышленности двумя путями: 1. В жидкой фазе при помощи серной кислоты; 2. Прямым присоединением воды в газовой фазе с участием твёрдых катализаторов. Способность этилена присоединять элементы воды была известна ещё в конце ХVIII века. А.М. Бутлеров в 60-тых годах прошлого столетия применил реакцию гидратации при помощи серной кислоты к различным этиленовым углеводородам. Реакции, приводящие к образованию спирта при взаимодействии этилена с серной кислотой, могут быть в общем виде представлены следующими уравнениями: 1.
СН2 = СН2 + НОSО2ОН СН3СН2ОSО2ОН этилсульфат 2.
СН3-СН2ОSО2ОН + Н2О СН3СН2ОН+НОSО2ОН 3.
2СН2 = СН2 + НОSО2ОН СН3СН2НОSО2ОСН2СН3 диэтилсульфат 4.
СН3СН2НОSО2ОСН2СН3 + 2Н2О 2С2Н3ОН+ +НОSО2ОН Побочными продуктами являются диэтиловый эфир, продукты полимеризации и обугливания этилена и др. Эфир образовывается главным образом при реакции между диэтилсульфатом и спиртом
(С2Н3)2SО4 + С2Н3ОН (С2Н5)2О + С2Н5НSО4 На ход реакции большое влияние оказывает концентрация этилена в исходном газе. При уменьшении концентрации соляной кислоты, t° реакции, парционального давления этилена и интенсивности перемешивания реагирующих веществ. С повышением концентрации кислоты скорость поглощения этилена увеличивается (93%-ная кислота поглощает в 10раз медленнее, чем 97,5%-ная), так как увеличивается скорость образования диэтилсульфата. В таком же направлении действует и повышение температуры до определённого предела. На рисунке 2 изображена схема производства спирта непрерывным способом.
Газовая смесь, содержащая не менее 30% этилена, или чистый этилен, подаётся в нижнюю часть абсорбционной колонны 1 и поднимается вверх навстречу орошающей смеси из серной кислоты и этилсульфатов. Абсорбционная колонна представляет собой вертикальный цилиндрический аппарат, выложенный внутри кислотоупорным кирпичом. Внутри цилиндра имеются тарелки с колпачками и змеевиковые холодильники, изготовленные из хромоникелевой стали. На верхнюю тарелку абсорбера подаётся насосом 97-98%-ная серная кислота. К этой кислоте уже в абсорбере добавляется некоторое количество кислоты, содержащей диэтилсульфат и этилсульфат. Такая смесь лучше поглощает этилен, чем чистая серная кислота. Происходит поглощение этилена с образованием этилсерной кислоты и диэтилсульфата. Эта реакция экзотермическая. Для поддержания нужной температуры необходимо непрерывно отводить избыточное тепло, что и осуществляется при помощи водяных холодильников. Газ, отходящий из верхней части абсорбера, промывается в специальных скрубберах 2 — водой и 3 — щёлочью и используется или для пиролиза, или в качестве топлива. Вытекающий из нижней части абсорбера экстракт, представляющий собой смесь соляной кислоты с этил- и диэтилсульфатом, охлаждается в холодильнике 4 до 40°С и смешивается с водой. Из смесителя 5 охлаждённый экстракт направляется в гидролизёр 6 типа тарельчатой колонны, где при t°=80-90°С идёт реакция гидролиза с образованием спирта. Гидролизат, содержащий, кроме спирта, ещё и дтэтиловый эфир, соляную кислоту и небольшое количество побочных продуктов, подаётся в отгонную колонну 7. Здесь происходит отгонка эфира, спирта и других легколетучих веществ и одновременно заканчивается гидролиз оставшейся этилсерной кислоты. В нижнюю часть колоны 7 подаётся острый пар. Пары спирта-сырца после нейтрализации раствором щёлочи в колонне8 направляются на очистку и ректификацию. После ректификации получается этиловый спирт-ректификат (95% объёмных), практически ничем не отличающийся от спирта, получаемого путём брожения. В качестве побочного продукта выделяется диэтиловый эфир в количестве около 10% от спирта-ректификата. Недостатками сернокислотного метода является большой расход серной кислоты (на 1 кг спирта берётся 1,8-2 кг серной кислоты в пересчёте на моногидрат) и сильная коррозия многих частей аппаратуры. Непосредственное присоединение воды к этилену давно являлось заманчивым делом, но на пути к осуществлению этой реакции стоял целый ряд затруднений. Реакция является обратимой и идёт с выделением теплоты:
С2Н4 + Н2О С2Н5ОН + 45 кДж В результате исследований и промышленных испытаний установлены следующие основные условия взаимодействия газообразного этилена и водяных паров: 1. Температура 275-300°С; 2. Давление при гидратации 65-75 атм; 3. Концентрация этилена в циркулирующем газе 85% (объёмных); 4. Молярное отношение воды к этилену 0,7:1; 5. Концентрация применяющейся здесь фосфорной кислоты в плёнке катализатора не ниже 83%; 6. За 1 час проходит 1800 м3газа через кубометр катализатора. Для сдвига равновесия в сторону гидратации этилена необходимо понижение температуры и повышение давления. Процесс прямой гидратации этилена состоит из несколько непрерывно протекающих стадий: 1. Компрессия исходного этилена до давления, необходимого для гидратации, и возвращение не прореагировавшего этилена; 2. Приготовление исходной парогазовой смеси; 3. Гидратация этилена; 4. Нейтрализация фосфорной кислоты, уносимой из зоны реакции; 5. Охлаждение парогазовой смеси и конденсация паров спирта и воды; 6. Очистка циркулирующего газа. Установка получения этилового спирта каталитической гидратацией этилена представлена на рисунке 3.
1. — теплообменник 2. — печь 3. — реактор 4. — ёмкость для спирта-сырца 5. — холодильник 6. — промывная колонна. Парофазная каталитическая гидратация этилена является более перспективным методом, и наша промышленность сейчас ориентируется на этот более прогрессивный метод. Синтетический этиловый спирт требует для своего производства гораздо меньше трудовых затрат, он аналогичен по составу и качеству спирту, получаемому из пищевых продуктов, и широко применяется в различных отраслях промышленности.
- Химические свойства алкенов
- Химические свойства алкенов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Галогенирование алкенов
- 1.3. Гидрогалогенирование алкенов
- 1.4. Гидратация
- 1.5. Полимеризация
- 2. Окисление алкенов
- 2.1. Каталитическое окисление
- 2.2. Мягкое окисление
- 2.2. Жесткое окисление
- 2.3. Горение алкенов
- 3. Замещение в боковой цепи
- 4. Изомеризация алкенов
- Химические свойства этилена. Формула этилена
- Взаимосвязь между строением молекулы и свойствами вещества
- Физические свойства
- Получение газа в лаборатории и промышленности
- Взаимодействие олефинов с элементами главной подгруппы седьмой группы
- Промышленное производство этанола
- Гидрогенизация и горение этилена
- Реакции окисления
- Полимеризация олефинов
- 📺 Видео
Видео:Уравнивание реакций горения углеводородовСкачать

Химические свойства алкенов
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Видео:Взаимодействие этилена с бромной водойСкачать

Химические свойства алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
| Например, при гидрировании бутена-2 образуется бутан. |
| Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление. |
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан. |
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
| Например, при взаимодействии этилена с бромоводородом образуется бромэтан. |
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. |
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен. |
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
| Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида) |
| Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида |
2.2. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
| Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия: |
| Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон: |
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
| Например, уравнение сгорания пропилена: |
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500 о С или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
| Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1 |
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Видео:Реакция этилена с раствором перманганата калияСкачать

Химические свойства этилена. Формула этилена
Непредельные углеводороды с двойной химической связью в молекулах относят к группе алкенов. Первым представителем гомологического ряда является этен, или этилен, формула которого: C2H4. Алкены часто называют олефинами. Название является историческим и возникло в 18-м веке, после получения продукта взаимодействия этилена с хлором – этилхлорида, имеющего вид маслянистой жидкости. Тогда этен и назвали маслородным газом. В нашей статье мы изучим его химические свойства, а также получение и применение в промышленности.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Взаимосвязь между строением молекулы и свойствами вещества
Согласно теории строения органических веществ, предложенной М. Бутлеровым, характеристика соединения полностью зависит структурной формулы и вида связей его молекулы. Химические свойства этилена также определяются пространственной конфигурацией атомов, гибридизацией электронных облаков и наличием в его молекуле пи-связи. Два негибридизованных p-электрона атомов углерода перекрываются в плоскости, перпендикулярной плоскости самой молекулы. Формируется двойная связь, разрыв которой обусловливает способность алкенов к реакциям присоединения и полимеризации.
Видео:Взаимодействие этилена с бромной водойСкачать

Физические свойства
Этен – это газообразное вещество, с едва уловимым своеобразным запахом. Оно плохо растворимо в воде, но хорошо растворяется в бензоле, тетрахлорметане, бензине и других органических растворителях. Исходя из формулы этилена С2Н4, его молекулярная масса равна 28, то есть этен немного легче воздуха. В гомологическом ряду алкенов с увеличением их массы агрегатное состояние веществ изменяется по схеме: газ – жидкость – твердое соединение.
Видео:Практическая работа №13. Свойства газа этилена. 9 класс.Скачать

Получение газа в лаборатории и промышленности
Нагревая этиловый спирт до 140 °С в присутствии концентрированной серной кислоты, можно получить этилен в лабораторных условиях. Еще один способ – отщепление атомов водорода от молекул алканов. Действуя едким натрием или калием на галогензамещенные соединения предельных углеводородов, например на хлорэтан, добывают этилен. В промышленности наиболее перспективным способом его получения является переработка природного газа, а также пиролиз и крекинг нефти. Все химические свойства этилена — реакции гидратации, полимеризации, присоединения, окисления — объясняются наличием в его молекуле двойной связи.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Взаимодействие олефинов с элементами главной подгруппы седьмой группы
Все члены гомологического ряда этена присоединяют атомы галогенов по месту разрыва пи-связи в своей молекуле. Так, водный раствор брома красно-коричневого цвета обесцвечивается, в результате чего образуется уравнение этилена — дибромэтан:
Аналогично протекает реакция с хлором и йодом, в ней присоединение атомов галогенов также происходит по месту разрушения двойной связи. Все соединения – олефины могут взаимодействовать с галогеноводородами: хлороводородом, фтороводородом и т.д. В результате реакции присоединения, протекающей по ионному механизму, образуется вещества – галогенопроизводные предельных углеводородов: хлорэтан, фторэтан.
Видео:Химия с нуля — Химические свойства АлкеновСкачать

Промышленное производство этанола
Химические свойства этилена часто используют для получения важных веществ, широко применяемых в промышленности и быту. Например, нагревая этен с водой в присутствии ортофосфорной или серной кислот, под действием катализатора происходит процесс гидратации. Он идет с образованием этилового спирта – многотоннажного продукта, получаемого на химических предприятиях органического синтеза. Механизм реакции гидратации протекает по аналогии с другими реакциями присоединения. Кроме того, взаимодействие этилена с водой также происходит в результате разрыва пи-связи. К свободным валентностям атомов углерода этена присоединяются атомы водорода и гидроксогруппа, входящие в состав молекулы воды.
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Гидрогенизация и горение этилена
Несмотря на все вышесказанное, реакция соединения водорода не имеет большого практического значения. Однако она показывает генетическую связь между различными классами органических соединений, в данном случае алканов и олефинов. Присоединяя водород, этен превращается в этан. Противоположный процесс – отщепление от предельных углеводородов атомов водорода приводит к образованию представителя алкенов – этена. Жесткое окисление олефинов, называемое горением, сопровождается выделением большого количества тепла, реакция является экзотермической. Продукты сгорания одинаковы для веществ всех классов углеводородов: алканов, непредельных соединений ряда этилена и ацетилена, ароматических веществ. К ним относятся углекислый газ и вода. Воздух в реакции с этиленом образует взрывчатую смесь.
Видео:Получение этилена из этилового спиртаСкачать

Реакции окисления
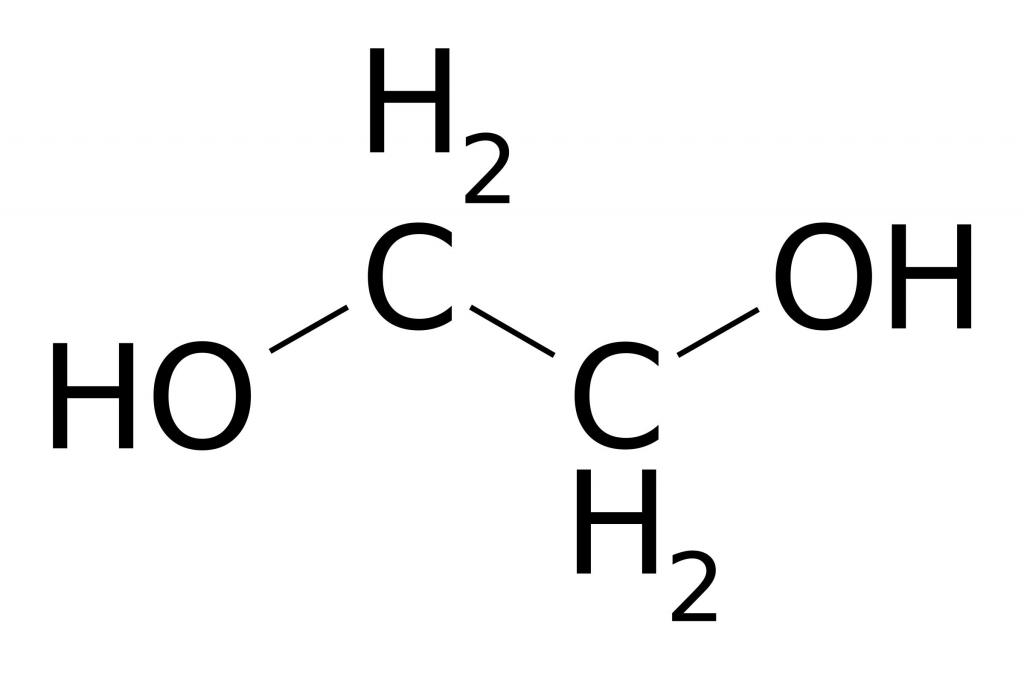
Этен может окисляться раствором перманганата калия. Это одна из качественных реакций, с помощью которой доказывают наличие двойной связи в составе определяемого вещества. Фиолетовая окраска раствора исчезает вследствие разрыва двойной связи и образования двухатомного предельного спирта – этиленгликоля. Продукт реакции имеет широкий спектр применения в промышленности в качестве сырья для получения синтетических волокон, например лавсана, взрывчатых веществ и антифризов. Как видим, химические свойства этилена используются для получения ценных соединений и материалов.
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Полимеризация олефинов
Повышение температуры, увеличение давления и применение катализаторов – это необходимые условия для проведения процесса полимеризации. Его механизм отличается от реакций присоединения или окисления. Он представляет собой последовательное связывание многих молекул этилена в местах разрыва двойных связей. Продуктом реакции является полиэтилен, физические характеристики которого зависят от величины n — степени полимеризации. Если она невелика, то вещество находится в жидком агрегатном состоянии. Если показатель приближается к 1000 звеньев, то из такого полимера изготовляют полиэтиленовую пленку, гибкие шланги. Если степень полимеризации превышает 1500 звеньев в цепи, то материал представляет собой твердое вещество белого цвета, жирное на ощупь.
Он идет на изготовление цельнолитых изделий и пластиковых труб. Галогенпроизводное соединение этилена – тефлон обладает антипригарными свойствами и является широко применяемым полимером, востребованным при изготовлении мультиварок, сковород, жаровен. Его высокая способность противостоять истиранию используется в производстве смазок к автомобильным двигателям, а низкая токсичность и толерантность к тканям человеческого организма позволили применять тефлоновые протезы в хирургии.
В нашей статье мы рассмотрели такие химические свойства олефинов, как горение этилена, реакции присоединения, окисления и полимеризации.
📺 Видео
Взаимодействие этилена с раствором перманганата калияСкачать

Опыты по химии. Получение этилена и опыты с нимСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Галогены (F, Cl, Br, I). Химические свойстваСкачать
ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать