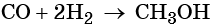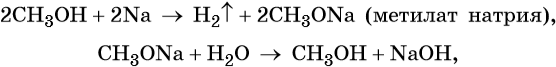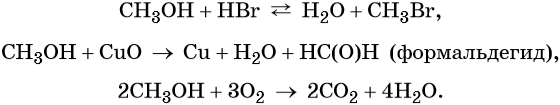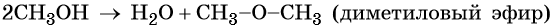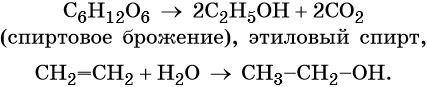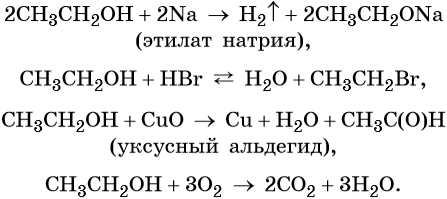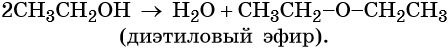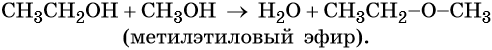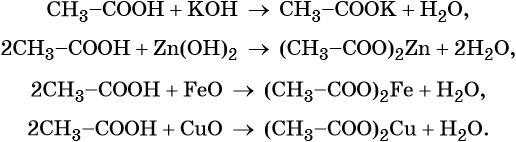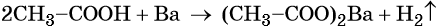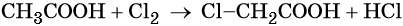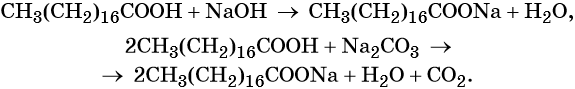Метанол CH3OH, метиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение метанола
- Водородные связи и физические свойства метанола
- Изомерия метанола
- Химические свойства метанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.2. Межмолекулярная дегидратация
- 4. Окисление метанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение метанола
- 5. Дегидрирование спиртов
- Получение метанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Промышленное получение метанола из «синтез-газа»
- Этанол и метанол реакция
- Тренировочные задания
- Свойства спиртов
- Получение спиртов
- Одноатомные спирты
- Многоатомные спирты
- Свойства спиртов
- Этиленгликоль
- Глицерин
- Эмульгаторы
- Растворители
- Похожие записи:
- Этанол и метанол реакция
- Тренировочные задания
- Свойства спиртов
- Получение спиртов
- Одноатомные спирты
- Многоатомные спирты
- Свойства спиртов
- Этиленгликоль
- Глицерин
- Эмульгаторы
- Растворители
- Acetyl
- 📹 Видео
Видео:Можно ли отличить опасный для здоровья метанол от этилового спиртаСкачать

Строение метанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства метанола
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому метанол – жидкость с относительно высокой температурой кипения (температура кипения метанола +64,5 о С).
Водородные связи образуются не только между молекулами метанола, но и между молекулами метанола и воды. Поэтому метанол очень хорошо растворимы в воде. Молекулы метанола в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Метанол смешивается с водой в любых соотношениях.
Видео:Как отличить метанол от этанола?Скачать

Изомерия метанола
Для метанола не характерно наличие структурных изомеров – ни изомеров углеродного скелета, ни изомеров положения гидроксильной группы, ни межклассовых изомеров.
Видео:Как определить наличие метанола в домашних условиях?Скачать

Химические свойства метанола
Метанол – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
1. Кислотные свойства метанола
| Метанол – неэлектролит, в водном растворе не диссоциирует на ионы; кислотные свойства у него выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
Метанол с растворами щелочей практически не реагирует, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому метанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, метанол взаимодействует с калием с образованием метилата калия и водорода . |
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, метилат калия разлагается водой: |
CH3OK + H2O → CH3-OH + KOH
Видео:СПИРТЫ: ЭТАНОЛ И МЕТАНОЛ НашПотребНадзоp#shortsСкачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, метанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии метанола с аммиаком образуется метиламин. |
2.3. Этерификация (образование сложных эфиров)
Метанол вступает в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, метанол реагирует с уксусной кислотой с образованием метилацетата (метилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, метанол взаимодействует с азотной кислотой : |
Видео:ЧТО БУДЕТ если ВЫПИТЬ МЕТАНОЛСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации метанола при температуре до 140 о С образуется диметиловый эфир: |
Видео:Как отличить метиловый спирт от этилового? 3 проверенных метода.Скачать

4. Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
Видео:Как отличтить этанол от метанола И ниотдать концы хрен знает зачемСкачать

5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола образуется альдегид.
Видео:Чем отличается метиловый спирт от этиловогоСкачать

Получение метанола
Видео:Горение спиртовСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
Видео:Несколько лайфхаков со спиртом. Химия – просто.Скачать

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Однако получить метанол гидратацией алкенов нельзя.
Видео:Метанол. Этанол. Глицерин. Урок 17. Химия 10 классСкачать

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании формальдегида образуется метанол |
CH2=O + H2 → CH3-OH
Видео:2CH3OH + 3O2 → 2CO2 + 4H2O | Реакция горения метанолаСкачать

4. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
Видео:Качественная реакция на этанолСкачать

Этанол и метанол реакция
Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильные группы (–OH).
По числу гидроксильных групп спирты делят на одноатомные, двухатомные, трёхатомные и многоатомные.
Предельными одноатомными спиртами называют класс химических веществ, отвечающий общей формуле CnH2n+1OH и содержащий в своей молекуле функциональную гидроксильную группу –OH, связанную с углеводородным радикалом.
Родоначальником гомологического ряда предельных одноатомных спиртов является метиловый спирт, или метанол. Его структурная формула CH3OH.
Метиловый спирт представляет собой бесцветную жидкость с характерным запахом, которая смешивается с водой во всех отношениях. Его температура кипения равна +64,7 °С, температура плавления –93,9 °С. В промышленности его получают из смеси оксида углерода (II) и водорода в присутствии катализатора — окиси цинка и хрома при высокой температуре:
Метиловый спирт реагирует с щелочными металлами с образованием соответствующих метилатов, вступает в обратимые реакции с галогенводородными кислотами, а также в окислительно-восстановительные реакции:
При межмолекулярной дегидратации метилового спирта (катализатор — концентрированная серная кислота) происходит образование простого эфира:
Метиловый спирт применяют в производстве формальдегида, полимерных материалов, в качестве растворителя в различных процессах.
Метиловый спирт очень ядовит. Известны многочисленные случаи тяжёлых отравлений этим соединением, часто со смертельным исходом.
Ближайший гомолог метилового спирта — этиловый спирт, или этанол. Его структурная формула CH3–CH2–OH. Он представляет собой бесцветную жидкость с характерным запахом. Смешивается с водой во всех отношениях. Его температура кипения равна +78,3 °С, температура плавления –114,2 °С.
Разработано несколько промышленных методов получения этанола. Наиболее важными являются спиртовое брожение сахаристых веществ, например глюкозы в присутствии дрожжей, а также каталитическая гидратация этилена:
Этиловый спирт реагирует с щелочными металлами с образованием соответствующих этилатов, вступает в обратимые реакции с галогенводородными кислотами, а также в окислительно-восстановительные реакции:
При межмолекулярной дегидратации этилового спирта (катализатор — концентрированная серная кислота) происходит образование простого эфира:
Если в реакцию этерификации взять смесь метилового и этилового спиртов одним из продуктов реакции может быть эфир несимметричного строения:
Этиловый спирт широко применяется в химической промышленности для производства красителей, ядохимикатов, пороха, пластмасс, уксусной кислоты и т. д. Этиловый спирт применяют в медицине и парфюмерии.
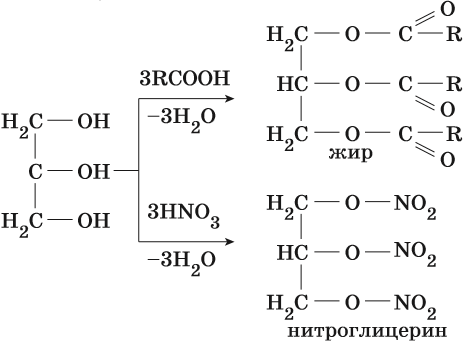
Трехатомные спирты. Эти спирты содержат три гидроксильные группы при разных углеродных атомах. Общая формула трёхатомных спиртов CnH2n-1(OH)3. Простейшим представителем трехатомных спиртов является глицерин. Его структурная формула HOCH2–CH(OH)–CH2OH. Он представляет собой бесцветную сиропообразную жидкость, сладкую на вкус. Смешивается с водой и этиловым спиртом во всех отношениях. Его температура кипения равна +290 °С, температура плавления +17 °С.
Получают глицерин омылением жиров, а также из непищевого сырья.
Глицерин способен образовывать жиры при реакции с карбоновыми кислотами, а его реакция со смесью азотной и серной кислот приводит к образованию тринитрогилцерина NO2–OCH2–CH(O–NO2)–CH2O–NO2— мощного взрывчатого вещества.
При взаимодействии глицерина со свежеосаждённым гидроксидом меди образуется глицерат меди, имеющий характерный ярко-синий цвет. Эта реакция является качественной для определения глицерина.
Глицерин применяют для изготовления полиэфирных полимеров, взрывчатых веществ, в парфюмерии, текстильной и пищевой промышленности.
Уксусная кислота H3CC(O)OH представляет собой бесцветную жидкость с резким запахом. Безводная уксусная кислота, имеющая температура плавления 16,6 °С называется ледяной.
Уксусная кислота широко распространена в природе. Она образуется при уксуснокислом брожении жидкостей, содержащих спирт, содержится в растениях и т. д.
В промышленности уксусную кислоту получают из уксусного альдегида или жидкофазным окислением углеводородов в присутствии солей марганца в качестве катализатора, например:
Уксусная кислота является слабой кислотой. Её производные называют ацетаты.
Она вступает в реакцию с основаниями и амфотерными гидроксидами (реакция нейтрализации), основными и амфотерными оксидами. Во всех случаях образуются соль и вода:
Уксусная кислота может реагировать с активными металлами с образованием солей и выделением водорода:
При хлорировании уксусной кислоты в присутствии красного фосфора образуется хлоруксусная кислота:
Уксусную кислоту используют в качестве полупродукта при производстве ацетонового шелка, красителей и др. Уксусную кислоту также широко применяют в пищевой промышленности. Водные растворы уксусной кислоты с концентрацией 70—80% называются уксусной эссенцией, а с концентрацией 3—5% — столовым уксусом.
Стеариновая кислота СН3(СН2)16СООН представляет собой бесцветные кристаллы с температурой плавления 69,6 °С. В воде стеариновая кислота очень мало растворима. Эта кислота входит в состав животных и растительных жиров, которые и служат источником её получения. Используют стеариновую кислоту в фармацевтической и косметической промышленности. Её натриевая соль — стеарат натрия СН3(СН2)16СООН образуется в результате взаимодействия стеариновой кислоты с гидроксидом или карбонатом натрия.
Стеарат натрия является основной составной частью обычного твёрдого мыла, а стеарат калия — жидкого мыла.
Видео:Этанол - хорошо или плохо? | Science Garage На РусскомСкачать

Тренировочные задания
1. Для метанола верны следующие утверждения:
1) это жидкость с характерным запахом, хорошо растворимая в воде
2) содержит в своём составе карбоксильную группу
3) содержит в своём составе гидроксильную группу
4) не горит на воздухе
5) реагирует с бромной водой
2. Для метанола верны следующие утверждения:
1) это газ при нормальных условиях
2) атомы углерода в нём находятся в состоянии sp-гибридизации
3) реагирует с металлическим натрием
4) реагирует с гидроксидом натрия
5) горит на воздухе
3. Для этанола верны следующие утверждения:
1) это жидкость с характерным запахом, не растворимая в воде
2) это низкокипящий газ, хорошо растворимый в воде
3) реагирует с гидроксидом натрия
4) реагирует с хлороводородом
5) реагирует с калием
4. Для этанола верны следующие утверждения:
1) его используют в медицине и пищевой промышленности
2) реагирует с концентрированными щелочами
3) не вступает в окислительно-восстановительные реакции
4) при дегидратации даёт ацетилен
5) при дегидратации даёт этилен
5. Для глицерина верны следующие утверждения:
1) все атомы в его молекуле находятся в состоянии sp-гибридном состоянии
2) реагирует с водой
3) даёт ярко-синее окрашивание со свежеосаждённым раствором гидроксида меди (II)
4) реагирует с угольной кислотой
5) реагирует с азотной кислотой
6. Для глицерина верны следующие утверждения:
1) это предельный двухатомный спирт
2) это предельный трехатомный спирт
3) реагирует с бромной водой
4) реагирует с железом
5) реагирует с натрием
7. Для уксусной кислоты верны следующие суждения:
1) это жидкость с характерным резким запахом, нерастворимая в воде
2) это жидкость с характерным резким запахом, хорошо растворимая в воде
3) все атомы углерода находятся в состоянии sp2-гибридизации
4) атом углерода карбоксильной группы находится в состоянии sp2-гибридизации
5) сгорает на воздухе с образованием углекислого газа и водорода
8. Для уксусной кислоты верны следующие суждения:
1) сильнее соляной кислоты, но слабее угольной кислоты
2) сильнее угольной кислоты, но слабее соляной кислоты
3) не реагирует с основаниями
4) окисляет серу
5) реагирует со щелочами
9. Для стеариновой кислоты верны следующие суждения:
1) это непредельная одноосновная кислота
2) содержит в своём составе карбоксильную группу и углеводородный радикал C17H35
3) сильнее уксусной кислоты
4) сильнее соляной кислоты
5) в виде сложных эфиров входит в состав растительных и животных жиров
10. Для стеариновой кислоты верны следующие суждения:
1) это твёрдое вещество белого цвета, не растворимое в воде
2) реагирует с сульфатом натрия
3) реагирует с гидроксидом натрия
4) относится к сильным кислотам
5) содержит в своём составе углеводородный радикал формулы C15H31
Видео:Окисление этанола (тест на алкоголь)Скачать

Свойства спиртов
Получение спиртов
Спирты — производные углеводородов, в молекулах которых есть одна или несколько гидроксильных групп OH.
Все спирты делятся на одноатомные и многоатомные
Одноатомные спирты
Одноатомные спирты — спирты, у которых имеется одна гидроксильная группа.
Бывают первичные, вторичные и третичные спирты:
— у первичных спиртов гидроксильная группа находится у первого атома углерода, у вторичных — у второго, и т.д.
Свойства спиртов, которые являются изомерными, во многом похожи, но в некоторых реакциях они ведут себя по-разному.

Сравнивая относительную молекулярную массу спиртов (Mr) c относительными атомными массами углеводородов, можно заметить, что спирты имеют более высокую температуру кипения. Это объясняется наличием водородной связи между атомом H в группе ОН одной молекулы и атомом O в группе -ОН другой молекулы.
При растворении спирта в воде образуются водородные связи между молекулами спирта и воды. Этим объясняется уменьшение объёма раствора (он всегда будет меньше, чем сумма объёмов воды и спирта по отдельности).
Наиболее ярким представителем химических соединений этого класса является этиловый спирт. Его химическая формула C2H5-OH. Концентрированный этиловый спирт (он же — винный спирт или этанол) получают из разбавленных его растворов путём перегонки; действует опьяняюще, а в больших доза — это сильный яд, который разрушает живые ткани печени и клетки мозга.

При этом нужно отметить, что этиловый спирт полезен в качестве растворителя, консерванта, средства понижающего температуру замерзания какого-либо препарата. Ещё один не менее известный представитель этого класса — метиловый спирт (его ещё называют — древесный или метанол). В отличии от этанола метанол смертельно опасен даже в самых малых дозах! Сначала он вызывает слепоту, затем просто «убивает»!
Многоатомные спирты
Многоатомные спирты — спирты, имеющие несколько гидроксильных групп OH.
Двухатомными спиртами называются спирты,содержащие две гидроксильные группы (группа ОН); спирты содержащие три гидроксильные группы — трёхатомные спирты. В их молекулах две или три гидроксильные группы никогда не оказываются присоединёнными к одному и тому же атому углерода.

Двухатомные спирты ещё называют гликолями, так как они обладают сладким вкусом, — это характерно для всех многоатомных спиртов
Многоатомные спирты с небольшим числом атомов углерода — это вязкие жидкости, высшие спирты — твёрдые вещества. Многоатомные спирты можно получать теми же синтетическими методами, что и предельные многоатомные спирты.
1. Получение этилового спирта (или винный спирт) путём брожения углеводов:
Суть брожения заключается в том, что один из простейших сахаров — глюкоза, получаемый в технике из крахмала, под влиянием дрожжевых грибков распадается на этиловый спирт и углекислый газ. Установлено, что процесс брожения вызывают не сами микроорганизмы, а выделяемые ими вещества — зимазы. Для получения этилового спирта обычно используют растительное сырьё, богатое крахмалом: клубни картофеля, хлебные зёрна, зёрна риса и т.д.
2. Гидратация этилена в присутствии серной или фосфорной кислоты
3. При реакции галогеналканов со щёлочью:
4. При реакции окисления алкенов
5. Гидролиз жиров: в этой реакции получается всем известный спирт — глицерин
Кстати, глицерин входит в состав многих косметических средств как консервант и как средство, предотвращающее замерзание и высыхание!
Свойства спиртов
1) Горение: Как и большинство органических веществ спирты горят с образованием углекислого газа и воды:
При их горении выделяется много теплоты, которую часто используют в лабораториях (лабораторные горелки). Низшие спирты горят почти бесцветным пламенем, а у высших спиртов пламя имеет желтоватый цвет из-за неполного сгорания углерода.
2) Реакция со щелочными металлами
При этой реакции выделяется водород и образуется алкоголят натрия. Алкоголяты похожи на соли очень слабой кислоты, а также они легко гидролизуются. Алкоголяты крайне неустойчивы и при действии воды — разлагаются на спирт и щелочь. Отсюда следует вывод, что одноатомные спирты не реагируют со щелочами!
3) Реакция с галогеноводородом
C2H5-OH + HBr —> CH3-CH2-Br + H2O
В этой реакции образуется галогеноалкан (бромэтан и вода). Такая химическая реакция спиртов обусловлена не только атомом водорода в гидроксильной группе, но и всей гидроксильной группой! Но эта реакция обратима: для её протекания нужно использовать водоотнимающее средство, например серную кислоту.
4) Внутримолекулярная дегидратация (в присутствии катализатора H2SO4)
В этой реакции при действии концентрированной серной кислоты и при нагревании происходит дегидратация спиртов. В процессе реакции образуется непредельный углеводород и вода.
Отщепление атома водорода от спирта может происходить в его же молекуле (то есть происходит перераспределение атомов в молекуле). Эта реакция является межмолекулярной реакцией дегидратации. Например, так:
В процессе реакции происходит образование простого эфира и воды.
5) реакция с карбоновыми кислотами:
Если добавить к спирту карбоновую кислоту, например уксусную, то произойдёт образование простого эфира. Но сложные эфиры менее устойчивы, чем простые эфиры. Если реакция образования простого эфира почти необратима, то образование сложного эфира — обратимый процесс. Сложные эфиры легко подвергаются гидролизу, распадаясь на спирт и карбоновую кислоту.
6) Окисление спиртов.
Кислородом воздуха при обычной температуре спирты не окисляются, но при нагревании в присутствии катализаторов идёт окисление. Примером может служить оксид меди (CuO), марганцовка (KMnO4), хромовая смесь. При действии окислителей получаются различные продукты и зависят от строения исходного спирта. Так, первичные спирты превращаются в альдегиды (реакция А), вторичные — в кетоны (реакция Б), а третичные спирты устойчивы к действию окислителей.
- — a) для первичных спиртов
- — б) для вторичных спиртов
- — в) третичные спирты оксидом меди не окисляются!
Что касается многоатомных спиртов, то они имеют сладковатый вкус, но некоторые из них ядовиты. Свойства многоатомных спиртов похожи на одноатомные спирты, при этом различие в том, что реакция идёт не по одной к гидроксильной группе, а по нескольким сразу.
Одно из основных отличий — многоатомные спирты легко вступают в реакцию гидроксидом меди. При этом получается прозрачный раствор ярко сине-фиолетового цвета. Именно этой реакцией можно выявлять наличие многоатомного спирта в каком-либо растворе.
Взаимодействуют с азотной кислотой:
С точки зрения практического применения наибольший интерес представляет реакция с азотной кислотой. Образующийся нитроглицерин и динитроэтиленгликоль используют в качестве взрывчатых веществ, а тринитроглицерин — ещё и в медицине, как сосудорасширяющее средство.
Этиленгликоль
Этиленгликоль — типичный представитель многоатомных спиртов. Его химическая формула CH2OH — CH2OH. — двухатомный спирт. Это сладкая жидкость, которая способно отлично растворяться в воде в любых пропорциях. В химических реакциях может участвовать как одна гидроксильная группа (-OH), так и две одновременно.
этиленгликоль
Этиленгликоль — его растворы — широко применяются как антиобледенительное средство (антифризы). Раствор этиленгликоля замерзает при температуре -34 0 C, что в холодное время года может заменить воду, например для охлаждения автомобилей.
При всей пользе этиленгликоля нужно учитывать, это это очень сильный яд!
Глицерин
Все мы видели глицерин. Он продаётся в аптеках в тёмных пузырьках и представляет собой вязкую бесцветную жидкость, сладковатую на вкус. Глицерин — это трёхатомный спирт. Он очень хорошо растворим в воде, кипит при температуре 220 0 C.
Химические свойства глицерина во многом сходны со свойствами одноатомных спиртов, но глицерин может реагировать с гидроксидами металлов (например, гидроксидом меди Cu(OH)2), при этом образуются глицераты металлов — химические соединения, подобные солям.
Реакция с гидроксидом меди — типовая для глицерина. В процессе химической реакции образуетс ярко-синий раствор глицерата меди
Эмульгаторы
Эмульгаторы — это высшие спирты, эфиры и другие сложные химические вещества, которые при смешивании с другими веществами, например жирами, образуют стойкие эмульсии. Кстати, все косметические средства также являются эмульсиями! В качестве эмульгаторов часто используют вещества, представляющие собой искусственный воск (пентол, сорбитанолеат), а также триэтаноламин, лицетин.
Растворители
Растворители — это вещества, используемые в основном для приготовления лаков для волос и ногтей. Они представлены в небольшой номенклатуре, так как большинство таких веществ легко воспламенимо и вредно для организма человека. Наиболее распространённым представителем растворителей является ацетон, а также амилацетат, бутилацетат, изобутилат.
Есть также вещества, называемые разбавители. Они, в основном применяются вместе с растворителями для приготовления различных лаков.
41. Метанол и этанол
Метиловый спирт, или метанол, его особенности:
1) структурная формула – СН 3 ОН;
2) это бесцветная жидкость с температурой кипения 64,5 °C;
3) ядовит (может вызывать слепоту, смерть);
4) в больших количествах метиловый спирт получается синтезом из оксида углерода (II) и водорода при высоком давлении (20–30 МПа) и высокой температуре (400 °C) в присутствии катализатора (около 90 % ZnО и 10 % Сr 2 O 3 ): СО + 2Н 2 -> СН 3 ОН;
5) метиловый спирт образуется и при сухой перегонке дерева, поэтому его называют также древесным спиртом. Применяется он в качестве растворителя, а также для получения других органических веществ.
Этиловый (винный) спирт, или этанол, его особенности:
1) структурная формула – СН 3 СН 2 ОН;
2) температура кипения 78,4 °C;
3) этанол – это одно из важнейших исходных веществ в современной промышленности органического синтеза.
Способы получения этанола:
1) для получения используются различные сахаристые вещества (виноградный сахар, глюкоза, которая путем «брожения» превращается в этиловый спирт). Реакция протекает по схеме:
C 6 H 12 O 6 (глюкоза) -> 2C 2 H 5 OH + 2CO 2 .
2) глюкоза в свободном виде содержится, например, в виноградном соке, при брожении которого получается виноградное вино с содержанием спирта от 8 до 16 %;
3) исходным продуктом для получения спирта может служить полисахарид крахмал, который содержится, например, в клубнях картофеля, зернах ржи, пшеницы, кукурузы;
4) для превращения в сахаристые вещества (глюкозу) крахмал предварительно подвергают гидролизу.
Для этого мука или измельченный картофель заваривается горячей водой и по охлаждении в него добавляется солод.
Солод – это проросшие, а затем подсушенные и растертые с водой зерна ячменя.
В солоде содержится диастаз, который действует на процесс осахаривания крахмала каталитически.
Диастаз – это сложная смесь ферментов;
5) по окончании осахаривания к полученной жидкости прибавляются дрожжи, под действием ферментов которых (зимазы) образуется спирт;
6) его отгоняют и затем очищают повторной перегонкой.
В настоящее время осахариванию подвергается также полисахарид – целлюлоза (клетчатка), которая образует главную массу древесины.
Для этого целлюлоза подвергается гидролизу в присутствии кислот (например, древесные опилки при 150–170 °C обрабатываются 0,1–5 %-ной серной кислотой под давлением 0,7–1,5 МПа).
Похожие записи:
No related posts.
Видео:Химия 10 класс (Урок№6 - Одноатомные предельные спирты.)Скачать

Этанол и метанол реакция
Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильные группы (–OH).
По числу гидроксильных групп спирты делят на одноатомные, двухатомные, трёхатомные и многоатомные.
Предельными одноатомными спиртами называют класс химических веществ, отвечающий общей формуле CnH2n+1OH и содержащий в своей молекуле функциональную гидроксильную группу –OH, связанную с углеводородным радикалом.
Родоначальником гомологического ряда предельных одноатомных спиртов является метиловый спирт, или метанол. Его структурная формула CH3OH.
Метиловый спирт представляет собой бесцветную жидкость с характерным запахом, которая смешивается с водой во всех отношениях. Его температура кипения равна +64,7 °С, температура плавления –93,9 °С. В промышленности его получают из смеси оксида углерода (II) и водорода в присутствии катализатора — окиси цинка и хрома при высокой температуре:
Метиловый спирт реагирует с щелочными металлами с образованием соответствующих метилатов, вступает в обратимые реакции с галогенводородными кислотами, а также в окислительно-восстановительные реакции:
При межмолекулярной дегидратации метилового спирта (катализатор — концентрированная серная кислота) происходит образование простого эфира:
Метиловый спирт применяют в производстве формальдегида, полимерных материалов, в качестве растворителя в различных процессах.
Метиловый спирт очень ядовит. Известны многочисленные случаи тяжёлых отравлений этим соединением, часто со смертельным исходом.
Ближайший гомолог метилового спирта — этиловый спирт, или этанол. Его структурная формула CH3–CH2–OH. Он представляет собой бесцветную жидкость с характерным запахом. Смешивается с водой во всех отношениях. Его температура кипения равна +78,3 °С, температура плавления –114,2 °С.
Разработано несколько промышленных методов получения этанола. Наиболее важными являются спиртовое брожение сахаристых веществ, например глюкозы в присутствии дрожжей, а также каталитическая гидратация этилена:
Этиловый спирт реагирует с щелочными металлами с образованием соответствующих этилатов, вступает в обратимые реакции с галогенводородными кислотами, а также в окислительно-восстановительные реакции:
При межмолекулярной дегидратации этилового спирта (катализатор — концентрированная серная кислота) происходит образование простого эфира:
Если в реакцию этерификации взять смесь метилового и этилового спиртов одним из продуктов реакции может быть эфир несимметричного строения:
Этиловый спирт широко применяется в химической промышленности для производства красителей, ядохимикатов, пороха, пластмасс, уксусной кислоты и т. д. Этиловый спирт применяют в медицине и парфюмерии.
Трехатомные спирты. Эти спирты содержат три гидроксильные группы при разных углеродных атомах. Общая формула трёхатомных спиртов CnH2n-1(OH)3. Простейшим представителем трехатомных спиртов является глицерин. Его структурная формула HOCH2–CH(OH)–CH2OH. Он представляет собой бесцветную сиропообразную жидкость, сладкую на вкус. Смешивается с водой и этиловым спиртом во всех отношениях. Его температура кипения равна +290 °С, температура плавления +17 °С.
Получают глицерин омылением жиров, а также из непищевого сырья.
Глицерин способен образовывать жиры при реакции с карбоновыми кислотами, а его реакция со смесью азотной и серной кислот приводит к образованию тринитрогилцерина NO2–OCH2–CH(O–NO2)–CH2O–NO2— мощного взрывчатого вещества.
При взаимодействии глицерина со свежеосаждённым гидроксидом меди образуется глицерат меди, имеющий характерный ярко-синий цвет. Эта реакция является качественной для определения глицерина.
Глицерин применяют для изготовления полиэфирных полимеров, взрывчатых веществ, в парфюмерии, текстильной и пищевой промышленности.
Уксусная кислота H3CC(O)OH представляет собой бесцветную жидкость с резким запахом. Безводная уксусная кислота, имеющая температура плавления 16,6 °С называется ледяной.
Уксусная кислота широко распространена в природе. Она образуется при уксуснокислом брожении жидкостей, содержащих спирт, содержится в растениях и т. д.
В промышленности уксусную кислоту получают из уксусного альдегида или жидкофазным окислением углеводородов в присутствии солей марганца в качестве катализатора, например:
Уксусная кислота является слабой кислотой. Её производные называют ацетаты.
Она вступает в реакцию с основаниями и амфотерными гидроксидами (реакция нейтрализации), основными и амфотерными оксидами. Во всех случаях образуются соль и вода:
Уксусная кислота может реагировать с активными металлами с образованием солей и выделением водорода:
При хлорировании уксусной кислоты в присутствии красного фосфора образуется хлоруксусная кислота:
Уксусную кислоту используют в качестве полупродукта при производстве ацетонового шелка, красителей и др. Уксусную кислоту также широко применяют в пищевой промышленности. Водные растворы уксусной кислоты с концентрацией 70—80% называются уксусной эссенцией, а с концентрацией 3—5% — столовым уксусом.
Стеариновая кислота СН3(СН2)16СООН представляет собой бесцветные кристаллы с температурой плавления 69,6 °С. В воде стеариновая кислота очень мало растворима. Эта кислота входит в состав животных и растительных жиров, которые и служат источником её получения. Используют стеариновую кислоту в фармацевтической и косметической промышленности. Её натриевая соль — стеарат натрия СН3(СН2)16СООН образуется в результате взаимодействия стеариновой кислоты с гидроксидом или карбонатом натрия.
Стеарат натрия является основной составной частью обычного твёрдого мыла, а стеарат калия — жидкого мыла.
Видео:10 класс - Химия - Химические свойства этанола. Применение на базе свойствСкачать

Тренировочные задания
1. Для метанола верны следующие утверждения:
1) это жидкость с характерным запахом, хорошо растворимая в воде
2) содержит в своём составе карбоксильную группу
3) содержит в своём составе гидроксильную группу
4) не горит на воздухе
5) реагирует с бромной водой
2. Для метанола верны следующие утверждения:
1) это газ при нормальных условиях
2) атомы углерода в нём находятся в состоянии sp-гибридизации
3) реагирует с металлическим натрием
4) реагирует с гидроксидом натрия
5) горит на воздухе
3. Для этанола верны следующие утверждения:
1) это жидкость с характерным запахом, не растворимая в воде
2) это низкокипящий газ, хорошо растворимый в воде
3) реагирует с гидроксидом натрия
4) реагирует с хлороводородом
5) реагирует с калием
4. Для этанола верны следующие утверждения:
1) его используют в медицине и пищевой промышленности
2) реагирует с концентрированными щелочами
3) не вступает в окислительно-восстановительные реакции
4) при дегидратации даёт ацетилен
5) при дегидратации даёт этилен
5. Для глицерина верны следующие утверждения:
1) все атомы в его молекуле находятся в состоянии sp-гибридном состоянии
2) реагирует с водой
3) даёт ярко-синее окрашивание со свежеосаждённым раствором гидроксида меди (II)
4) реагирует с угольной кислотой
5) реагирует с азотной кислотой
6. Для глицерина верны следующие утверждения:
1) это предельный двухатомный спирт
2) это предельный трехатомный спирт
3) реагирует с бромной водой
4) реагирует с железом
5) реагирует с натрием
7. Для уксусной кислоты верны следующие суждения:
1) это жидкость с характерным резким запахом, нерастворимая в воде
2) это жидкость с характерным резким запахом, хорошо растворимая в воде
3) все атомы углерода находятся в состоянии sp2-гибридизации
4) атом углерода карбоксильной группы находится в состоянии sp2-гибридизации
5) сгорает на воздухе с образованием углекислого газа и водорода
8. Для уксусной кислоты верны следующие суждения:
1) сильнее соляной кислоты, но слабее угольной кислоты
2) сильнее угольной кислоты, но слабее соляной кислоты
3) не реагирует с основаниями
4) окисляет серу
5) реагирует со щелочами
9. Для стеариновой кислоты верны следующие суждения:
1) это непредельная одноосновная кислота
2) содержит в своём составе карбоксильную группу и углеводородный радикал C17H35
3) сильнее уксусной кислоты
4) сильнее соляной кислоты
5) в виде сложных эфиров входит в состав растительных и животных жиров
10. Для стеариновой кислоты верны следующие суждения:
1) это твёрдое вещество белого цвета, не растворимое в воде
2) реагирует с сульфатом натрия
3) реагирует с гидроксидом натрия
4) относится к сильным кислотам
5) содержит в своём составе углеводородный радикал формулы C15H31
Видео:Reaction of Sodium metal with methanol or methyl alcohol and ethanol or ethyl alcoholСкачать

Свойства спиртов
Получение спиртов
Спирты — производные углеводородов, в молекулах которых есть одна или несколько гидроксильных групп OH.
Все спирты делятся на одноатомные и многоатомные
Одноатомные спирты
Одноатомные спирты — спирты, у которых имеется одна гидроксильная группа.
Бывают первичные, вторичные и третичные спирты:
— у первичных спиртов гидроксильная группа находится у первого атома углерода, у вторичных — у второго, и т.д.
Свойства спиртов, которые являются изомерными, во многом похожи, но в некоторых реакциях они ведут себя по-разному.

Сравнивая относительную молекулярную массу спиртов (Mr) c относительными атомными массами углеводородов, можно заметить, что спирты имеют более высокую температуру кипения. Это объясняется наличием водородной связи между атомом H в группе ОН одной молекулы и атомом O в группе -ОН другой молекулы.
При растворении спирта в воде образуются водородные связи между молекулами спирта и воды. Этим объясняется уменьшение объёма раствора (он всегда будет меньше, чем сумма объёмов воды и спирта по отдельности).
Наиболее ярким представителем химических соединений этого класса является этиловый спирт. Его химическая формула C2H5-OH. Концентрированный этиловый спирт (он же — винный спирт или этанол) получают из разбавленных его растворов путём перегонки; действует опьяняюще, а в больших доза — это сильный яд, который разрушает живые ткани печени и клетки мозга.

При этом нужно отметить, что этиловый спирт полезен в качестве растворителя, консерванта, средства понижающего температуру замерзания какого-либо препарата. Ещё один не менее известный представитель этого класса — метиловый спирт (его ещё называют — древесный или метанол). В отличии от этанола метанол смертельно опасен даже в самых малых дозах! Сначала он вызывает слепоту, затем просто «убивает»!
Многоатомные спирты
Многоатомные спирты — спирты, имеющие несколько гидроксильных групп OH.
Двухатомными спиртами называются спирты,содержащие две гидроксильные группы (группа ОН); спирты содержащие три гидроксильные группы — трёхатомные спирты. В их молекулах две или три гидроксильные группы никогда не оказываются присоединёнными к одному и тому же атому углерода.

Двухатомные спирты ещё называют гликолями, так как они обладают сладким вкусом, — это характерно для всех многоатомных спиртов
Многоатомные спирты с небольшим числом атомов углерода — это вязкие жидкости, высшие спирты — твёрдые вещества. Многоатомные спирты можно получать теми же синтетическими методами, что и предельные многоатомные спирты.
1. Получение этилового спирта (или винный спирт) путём брожения углеводов:
Суть брожения заключается в том, что один из простейших сахаров — глюкоза, получаемый в технике из крахмала, под влиянием дрожжевых грибков распадается на этиловый спирт и углекислый газ. Установлено, что процесс брожения вызывают не сами микроорганизмы, а выделяемые ими вещества — зимазы. Для получения этилового спирта обычно используют растительное сырьё, богатое крахмалом: клубни картофеля, хлебные зёрна, зёрна риса и т.д.
2. Гидратация этилена в присутствии серной или фосфорной кислоты
3. При реакции галогеналканов со щёлочью:
4. При реакции окисления алкенов
5. Гидролиз жиров: в этой реакции получается всем известный спирт — глицерин
Кстати, глицерин входит в состав многих косметических средств как консервант и как средство, предотвращающее замерзание и высыхание!
Свойства спиртов
1) Горение: Как и большинство органических веществ спирты горят с образованием углекислого газа и воды:
При их горении выделяется много теплоты, которую часто используют в лабораториях (лабораторные горелки). Низшие спирты горят почти бесцветным пламенем, а у высших спиртов пламя имеет желтоватый цвет из-за неполного сгорания углерода.
2) Реакция со щелочными металлами
При этой реакции выделяется водород и образуется алкоголят натрия. Алкоголяты похожи на соли очень слабой кислоты, а также они легко гидролизуются. Алкоголяты крайне неустойчивы и при действии воды — разлагаются на спирт и щелочь. Отсюда следует вывод, что одноатомные спирты не реагируют со щелочами!
3) Реакция с галогеноводородом
C2H5-OH + HBr —> CH3-CH2-Br + H2O
В этой реакции образуется галогеноалкан (бромэтан и вода). Такая химическая реакция спиртов обусловлена не только атомом водорода в гидроксильной группе, но и всей гидроксильной группой! Но эта реакция обратима: для её протекания нужно использовать водоотнимающее средство, например серную кислоту.
4) Внутримолекулярная дегидратация (в присутствии катализатора H2SO4)
В этой реакции при действии концентрированной серной кислоты и при нагревании происходит дегидратация спиртов. В процессе реакции образуется непредельный углеводород и вода.
Отщепление атома водорода от спирта может происходить в его же молекуле (то есть происходит перераспределение атомов в молекуле). Эта реакция является межмолекулярной реакцией дегидратации. Например, так:
В процессе реакции происходит образование простого эфира и воды.
5) реакция с карбоновыми кислотами:
Если добавить к спирту карбоновую кислоту, например уксусную, то произойдёт образование простого эфира. Но сложные эфиры менее устойчивы, чем простые эфиры. Если реакция образования простого эфира почти необратима, то образование сложного эфира — обратимый процесс. Сложные эфиры легко подвергаются гидролизу, распадаясь на спирт и карбоновую кислоту.
6) Окисление спиртов.
Кислородом воздуха при обычной температуре спирты не окисляются, но при нагревании в присутствии катализаторов идёт окисление. Примером может служить оксид меди (CuO), марганцовка (KMnO4), хромовая смесь. При действии окислителей получаются различные продукты и зависят от строения исходного спирта. Так, первичные спирты превращаются в альдегиды (реакция А), вторичные — в кетоны (реакция Б), а третичные спирты устойчивы к действию окислителей.
- — a) для первичных спиртов
- — б) для вторичных спиртов
- — в) третичные спирты оксидом меди не окисляются!
Что касается многоатомных спиртов, то они имеют сладковатый вкус, но некоторые из них ядовиты. Свойства многоатомных спиртов похожи на одноатомные спирты, при этом различие в том, что реакция идёт не по одной к гидроксильной группе, а по нескольким сразу.
Одно из основных отличий — многоатомные спирты легко вступают в реакцию гидроксидом меди. При этом получается прозрачный раствор ярко сине-фиолетового цвета. Именно этой реакцией можно выявлять наличие многоатомного спирта в каком-либо растворе.
Взаимодействуют с азотной кислотой:
С точки зрения практического применения наибольший интерес представляет реакция с азотной кислотой. Образующийся нитроглицерин и динитроэтиленгликоль используют в качестве взрывчатых веществ, а тринитроглицерин — ещё и в медицине, как сосудорасширяющее средство.
Этиленгликоль
Этиленгликоль — типичный представитель многоатомных спиртов. Его химическая формула CH2OH — CH2OH. — двухатомный спирт. Это сладкая жидкость, которая способно отлично растворяться в воде в любых пропорциях. В химических реакциях может участвовать как одна гидроксильная группа (-OH), так и две одновременно.
этиленгликоль
Этиленгликоль — его растворы — широко применяются как антиобледенительное средство (антифризы). Раствор этиленгликоля замерзает при температуре -34 0 C, что в холодное время года может заменить воду, например для охлаждения автомобилей.
При всей пользе этиленгликоля нужно учитывать, это это очень сильный яд!
Глицерин
Все мы видели глицерин. Он продаётся в аптеках в тёмных пузырьках и представляет собой вязкую бесцветную жидкость, сладковатую на вкус. Глицерин — это трёхатомный спирт. Он очень хорошо растворим в воде, кипит при температуре 220 0 C.
Химические свойства глицерина во многом сходны со свойствами одноатомных спиртов, но глицерин может реагировать с гидроксидами металлов (например, гидроксидом меди Cu(OH)2), при этом образуются глицераты металлов — химические соединения, подобные солям.
Реакция с гидроксидом меди — типовая для глицерина. В процессе химической реакции образуетс ярко-синий раствор глицерата меди
Эмульгаторы
Эмульгаторы — это высшие спирты, эфиры и другие сложные химические вещества, которые при смешивании с другими веществами, например жирами, образуют стойкие эмульсии. Кстати, все косметические средства также являются эмульсиями! В качестве эмульгаторов часто используют вещества, представляющие собой искусственный воск (пентол, сорбитанолеат), а также триэтаноламин, лицетин.
Растворители
Растворители — это вещества, используемые в основном для приготовления лаков для волос и ногтей. Они представлены в небольшой номенклатуре, так как большинство таких веществ легко воспламенимо и вредно для организма человека. Наиболее распространённым представителем растворителей является ацетон, а также амилацетат, бутилацетат, изобутилат.
Есть также вещества, называемые разбавители. Они, в основном применяются вместе с растворителями для приготовления различных лаков.
41. Метанол и этанол
Метиловый спирт, или метанол, его особенности:
1) структурная формула – СН 3 ОН;
2) это бесцветная жидкость с температурой кипения 64,5 °C;
3) ядовит (может вызывать слепоту, смерть);
4) в больших количествах метиловый спирт получается синтезом из оксида углерода (II) и водорода при высоком давлении (20–30 МПа) и высокой температуре (400 °C) в присутствии катализатора (около 90 % ZnО и 10 % Сr 2 O 3 ): СО + 2Н 2 -> СН 3 ОН;
5) метиловый спирт образуется и при сухой перегонке дерева, поэтому его называют также древесным спиртом. Применяется он в качестве растворителя, а также для получения других органических веществ.
Этиловый (винный) спирт, или этанол, его особенности:
1) структурная формула – СН 3 СН 2 ОН;
2) температура кипения 78,4 °C;
3) этанол – это одно из важнейших исходных веществ в современной промышленности органического синтеза.
Способы получения этанола:
1) для получения используются различные сахаристые вещества (виноградный сахар, глюкоза, которая путем «брожения» превращается в этиловый спирт). Реакция протекает по схеме:
C 6 H 12 O 6 (глюкоза) -> 2C 2 H 5 OH + 2CO 2 .
2) глюкоза в свободном виде содержится, например, в виноградном соке, при брожении которого получается виноградное вино с содержанием спирта от 8 до 16 %;
3) исходным продуктом для получения спирта может служить полисахарид крахмал, который содержится, например, в клубнях картофеля, зернах ржи, пшеницы, кукурузы;
4) для превращения в сахаристые вещества (глюкозу) крахмал предварительно подвергают гидролизу.
Для этого мука или измельченный картофель заваривается горячей водой и по охлаждении в него добавляется солод.
Солод – это проросшие, а затем подсушенные и растертые с водой зерна ячменя.
В солоде содержится диастаз, который действует на процесс осахаривания крахмала каталитически.
Диастаз – это сложная смесь ферментов;
5) по окончании осахаривания к полученной жидкости прибавляются дрожжи, под действием ферментов которых (зимазы) образуется спирт;
6) его отгоняют и затем очищают повторной перегонкой.
В настоящее время осахариванию подвергается также полисахарид – целлюлоза (клетчатка), которая образует главную массу древесины.
Для этого целлюлоза подвергается гидролизу в присутствии кислот (например, древесные опилки при 150–170 °C обрабатываются 0,1–5 %-ной серной кислотой под давлением 0,7–1,5 МПа).
Видео:Предельные одноатомные спирты строение, номенклатура | Химия 10 класс #23 | ИнфоурокСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 📹 Видео7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать  |