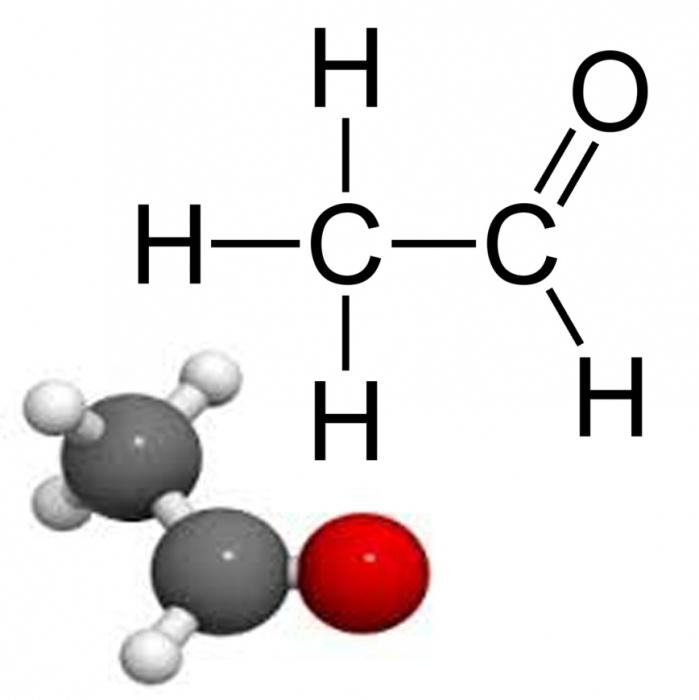
Он хорошо растворим в воде, спирте и эфире.
Рис. 1. Строение молекулы этаналя.
Таблица 1. Физические свойства этаналя.
Плотность (0 o С), г/см 3
Температура плавления, o С
Температура кипения, o С
Видео:Взаимодействие уксусной кислоты с гидроксидом натрияСкачать

Получение этаналя
Наиболее популярным способом получения этаналя является окисление этанола:
Кроме этого используются и другие реакции:
- пиролиз кальциевый (бариевых) солей карбоновых кислот:
- гидратация ацетилена и его гомологов (реакция Кучерова)
- каталитическое окисление ацетилена
Видео:Все задания №32 из сборника ЕГЭ 2023 (часть 2) | Химия ЕГЭ для 10 класса | УмскулСкачать

Химические свойства этаналя
Типичные реакции, характерные для этаналя – реакции нуклеофильного присоединения. Все они протекают преимущественно с расщеплением:
- p-связи в карбонильной группе
— присоединение синильной кислоты
— присоединение гидросульфита натрия
- связи С-Н в карбонильной группе
— окисление аммиачным раствором оксида серебра (реакция «серебряного зеркала») – качественная реакция
— окисление гидроксидом меди (II)
Видео:Все задания №32 из сборника ЕГЭ 2023 (часть 1) | Химия ЕГЭ для 10 класса | УмскулСкачать

Применение этаналя
Этаналь используется в основном для производства уксусной кислоты и в качестве исходного сырья для синтеза многих органических соединений. Кроме этого этаналь и его производные идут на изготовление некоторых лекарств.
Видео:Спирты: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

Примеры решения задач
| Задание | Эквимолекулярная смесь ацетилена и этаналя полностью реагирует с 69,6 г Ag2O, растворенного в аммиаке. Определите состав исходной смеси. |
| Решение | Запишем уравнения реакций, указанных в условии задачи: |
Рассчитаем количество вещества оксида серебра (I):
n(Ag2O) = 69,6 / 232 = 2,6 моль.
По уравнению (2) количество вещества этаналя будет равно 0,15 моль. По условию задачи смесь эквимолекулярна, следовательно, ацетилена тоже будет 0,15 моль.
Найдем массы веществ, составляющих смесь:
M(HC≡CH) = 26 г/моль;
m(HC≡CH) = 0,15× 26 = 3,9 г;
| Задание | При каталитическом гидрировании 55 г этаналя образовалась карбоновая кислота. Рассчитайте какая масса кислоты была получена. |
| Решение | Запишем уравнение реакции каталитического окисления этаналя: |
Вычислим количество вещества этаналя (молярная масса равна 44 г/моль):
n(CH3-C(O)H) = 55 / 44 = 1,25 моль.
Согласно уравнению реакции n(CH3-C(O)H) : n(CH3-COOH) = 1:1, т.е.
Тогда масса уксусной кислоты будет равна (молярная масса – 60 г/моль):
На сегодняшний день известны миллионы химических соединений. И большинство из них относится к органическим. Эти вещества делят на несколько больших групп, название одной из них — альдегиды. Сегодня мы рассмотрим представителя этого класса — уксусный альдегид.
Определение
Уксусный альдегид является органическим соединением класса альдегидов. Его могут называть и по-другому: ацетальдегидом, этаналем или метилформальдегидом. Формула уксусного альдегида — CH3-CHO.
Свойства
Получение
В основном уксусный альдегид получают с помощью окисления этилена (процесс Вакера). В роли окислителя выступает хлорид палладия. Еще данное вещество можно получить во время гидратации ацетилена, в которой присутствуют соли ртути. Продуктом реакции является енол, который изомеризуется в искомое вещество. Еще один способ получения уксусного альдегида, который был наиболее популярным задолго до того, как стал известен процесс Вакера, — окисление или дегидратация этанола в присутствии медного или серебряного катализаторов. При дегидратации, помимо искомого вещества, образуется водород, а во время окисления — вода.
Применение
С помощью обсуждаемого соединения получают бутадиен, альдегидные полимеры и некоторые органические вещества, в том числе и одноименную кислоту. Она образуется при его окислении. Реакция выглядит так: «кислород + уксусный альдегид = уксусная кислота». Этаналь — важный прекурсор ко многим производным, и это свойство широко применяется в синтезе
многих веществ. В организмах человека, животных и растений ацетальдегид является участником некоторых сложных реакций. Также он входит в состав сигаретного дыма.
Заключение
Ацетальдегид может приносить как пользу, так и вред. Он плохо воздействует на кожу, является ирритантом и, возможно, канцерогеном. Поэтому его присутствие в организме нежелательно. Но некоторые люди сами провоцируют появление ацетальдегида, куря сигареты и употребляя алкоголь. Подумайте над этим!
Видео:Составление уравнений реакций для генетических цепочек по кислородсодержащим. часть 1Скачать

Общая характеристика
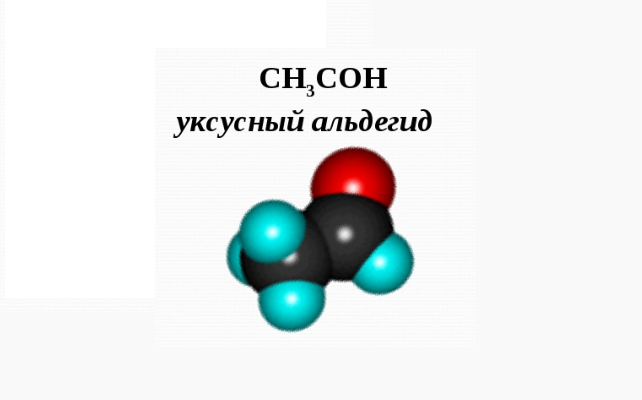
Уксусный альдегид имеет несколько названий: ацетальдегид, этаналь, метилформальдегид. Это соединение является альдегидом уксусной кислоты и этанола. Его структурная формула выглядит следующим образом: CH3-CHO.
Рис. 1. Химическая формула уксусного альдегида.
Особенностью этого альдегида является то, что он встречается как в природе, так и производится искусственным путем. В промышленности объем производства этого вещества может составлять до 1 миллиона тонн в год.
Этаналь встречается в пищевых продуктах, таких как кофе, хлеб, а также это вещество синтезируют растения в процессе метаболизма.
Уксусный альдегид представляет собой жидкость без цвета, но отличающуюся резким запахом. Растворим в воде, спирте и эфире. Является ядовитым.
Рис. 2. Уксусный альдегид.
Жидкость закипает при достаточно низкой температуре – 20,2 градуса по Цельсию. Из-за этого возникают проблемы с ее хранением и транспортировкой. Поэтому хранят вещество в виде паральдегида, а ацетальдегид из него получают в случае необходимости путем нагревания с серной кислотой (либо с любой другой минеральной кислотой). Паральдегид – это циклический тример уксусной кислоты.
Видео:Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать

Способы получения
Получить уксусный альдегид можно несколькими способами. Самый распространенный вариант – окисление этилена или, как еще называют этот способ, процесс Вакера:
Окислителем в данной реакции выступает хлорид палладия.
Также уксусный альдегид можно получить пр взаимодействии ацетилена с солями ртути. Данная реакция носит имя русского ученого и называется реакцией Кучерова. В результате химического процесса образуется енол, который изомеризуется в альдегид
Рис. 3. М. Г. Кучеров портрет.
До открытия метода Вакера в 60-ые годы уксусный альдегид получали при помощи этилового спирта. Этиловый спирт окисляли или дегидрировали. В качестве катализатора выступали медь или серебро:
По химическим свойствам ацетальдегид является типичным представителем альдегидов.
Применяют в промышленности данное вещество для получения уксусной кислоты, бутадиена и различных органических веществ.
Видео:Реакция уксусной кислоты с карбонатом натрияСкачать

Что мы узнали?
Уксусный альдегид – жидкость, имеющая несколько названий. Это вещество имеет свойство кипеть уже при температуре 20,2 градуса. Существуют два основных способа с помощью которых получают этот альдегид: реакция Вакера и реакция Кучерова.
Видео:Химия ЕГЭ 2022 / Задание 32Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:ВПР по химии 11 класс Видеоурок 10/15 ЗАДАНИЕ 12 Химические свойства Органическая химия 10 клСкачать  Уравнение реакции этаналь уксусная кислотаВопрос по химии: Как из этаналя получить уксусную кислоту. Уравнение реакции,пожалуйста. Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ? Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно! Ответы и объяснения 2СН3СОН+Аg2О->СН3СООН+2Аg Существует куча методов, но все они сводятся к окислению этаналя: Например: Знаете ответ? Поделитесь им!Как написать хороший ответ?Чтобы добавить хороший ответ необходимо:
Этого делать не стоит:
Есть сомнения?Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия. Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы! Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются. 🎦 ВидеоЕГЭ по химии 2022 | Задание №16 | Взаимосвязь углеводородов | Ясно Ясно ЕГЭСкачать  Взаимодействие уксусной кислоты с металламиСкачать  Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать  10.1. Альдегиды и кетоны: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать  Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать  Разбор нового формата ЕНТ по химии (2-вариант) | ЕНТ 2024 | ХимияСкачать  Кислородосодержащие органические соединения. Видеоурок 18. Химия 9 классСкачать  Разбор нового формата ЕНТ по химии (3-вариант) | ЕНТ 2024 | ХимияСкачать  Решаем 25 вариант Добротина 2024 - самый сложный из сборника ФИПИ? | ЕГЭ по химии | Катя СтрогановаСкачать  Тесты по химии. Альдегиды. А34 РТ 17-18 этап 3Скачать  Получение уксусной кислоты из ацетата натрия (Synthesis of acetic acid from sodium acetate)Скачать  |